猪繁殖与呼吸综合征病毒Nsp7的原核表达及其多克隆抗体的制备
刘 鹤,刘永刚,石文达,王淑杰,武嘉男,董建国,荣福龙,李丽琴,徐明明,孙 刚,蔡雪辉*
(1.东北农业大学动物医学院,黑龙江哈尔滨150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/动物疫病诊断中心,黑龙江哈尔滨150001;3.黑龙江省动物卫生监督所,黑龙江哈尔滨150090)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由PRRS病毒(PRRSV)引起的,以母猪繁殖障碍,仔猪、育肥猪呼吸道疾病为临床症状的病毒性传染病。该病在1987年首次报道于美国,并呈全球性流行[1]。PRRSV分为欧洲型(Ⅰ型)和北美洲型(Ⅱ型)两种基因型[2]。郭宝清等于1996年首次在我国分离到PRRSV CH-1a株,我国流行的PRRSV的基因型主要为北美洲型[3]。2006年夏季至今,高致病性PRRSV引起PRRS的爆发与流行,给我国养猪业造成严重的经济损失[4]。
PRRSV属于动脉炎病毒科(Arteriviridae)动脉炎病毒属(Arterivirus),单股正链RNA病毒,基因组全长约15.4 kb,包括9个ORF,其中ORF1a、ORF1b编码病毒的非结构蛋白(Nonstructural protein,Nsp),ORF2~ORF7编码病毒的结构蛋白[2]。ORF1a和ORF1b编码多聚蛋白pp1a和pp1ab,最终可以水解为14个Nsp[5],在PRRSV的复制过程中起重要作用[6]。目前Nsp7的结构及其在PRRSV复制周期中的作用尚未明确,研究显示Nsp7抗体产生时间早,抗体水平高,持续时间长,表明Nsp7与机体免疫应答关系较为密切[7]。由于Nsp7基因在Nsp中相对保守,不同病毒株之间差异变化较小,因此适于作为检测抗原检测不同病毒株的抗体水平[8]。本研究采用原核表达系统表达了Nsp7,并制备了抗Nsp7的多克隆抗体。实验结果显示Nsp7具有良好的免疫原性,为进一步揭示PRRSV Nsp7抗体水平变化和抗原定位奠定了基础。
1 材料和方法
1.1 病毒株、血清、菌株与载体 PRRSV HuN4株、PRRSV猪阳性血清和阴性血清、pET30a(+)、大肠杆菌JM109、BL21(DE3)均由中国农业科学院哈尔滨兽医研究所动物疫病诊断中心保存。
1.2 主要试剂 总RNA提取试剂盒购自上海生工生物工程技术服务有限公司;反转录酶、TaqDNA聚合酶、T4 DNA连接酶、pMD18-T试剂盒、限制性内切酶等均购自TaKaRa公司;质粒DNA小量提取试剂盒购自爱思进生物技术有限公司;DNA胶回收试剂盒购自上海华舜生物技术有限公司;浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司;辣根过氧化物酶(HRP)标记的抗猪IgG、异氰酸荧光素(FITC)标记的羊抗鼠IgG和抗猪IgG购自Sigma公司;镍离子亲和纯化柱购自GE公司。
1.3 引物设计与合成 参照GenBank中登录的PRRSV HuN4株全基因组序列(AF635006),设计引物用于扩增PRRSV HuN4株Nsp7基因。引物中引入BamHⅠ和HindⅢ酶切位点(下划线部分),由北京三博志远生物技术有限公司合成。引物序列为:上游引物:5'-CGGATCCTCGCTGACTGGTGCCC TC-3';下游引物:5'-GCGCGGAAGCTTTTCCCACT GAGCTCT-3'。
1.4 病毒RNA的提取 取冻结保存的PRRSV HuN4株细胞培养液,按照UNIQ-10柱式TRIzol总RNA提取试剂盒操作说明书提取病毒RNA。
1.5 病毒基因RT-PCR扩增 以提取的病毒RNA为模板,进行RT-PCR扩增Nsp7基因。PCR反应条件为:95℃5 min;94℃ 1 min、58℃ 1 min、72℃1 min,35个循环;72℃10 min。PCR产物经琼脂糖凝胶电泳鉴定并切胶回收。
1.6 重组质粒的构建 Nsp7基因PCR产物经BamHⅠ和HindⅢ双酶切后与经同样酶切处理的pET30a(+)载体连接,转化JM109感受态细胞。提取重组质粒,进行PCR和双酶切鉴定,重组质粒pET-Nsp7由上海英骏生物技术公司测序。
1.7 Nsp7的表达、可溶性和反应原性分析 将pET-Nsp7转化大肠杆菌BL21(DE3)感受态细胞,构建重组菌pET-Nsp7/BL21。重组菌经IPTG诱导表达,收集诱导后菌体并超声破碎,离心后收集上清液和沉淀,SDS-PAGE试验分析Nsp7的表达与可溶性,以PRRSV阳性血清和阴性血清为一抗,HRP标记的抗猪IgG为二抗进行western blot试验,分析Nsp7的反应原性。
1.8 Nsp7重组蛋白的纯化 以优化的诱导条件进行Nsp7的诱导表达,按His Trap FF组氨酸标签融合蛋白纯化手册进行蛋白纯化。
1.9 Nsp7多克隆抗体的制备及其抗体效价的测定以纯化后的Nsp7免疫BALB/c小鼠,每次免疫50 μg~100 μg,分别间隔2周进行二免和三免,同时设阴性对照。三免3 d后采血,采用间接ELISA测定抗体效价。
1.10 Nsp7多克隆抗体IFA检测 将Marc-145细胞在24孔板培养4 d(37℃5%CO2),接种PRRSV再培养2 d。每孔加1.5 mL等体积比丙酮和甲醇混合液固定细胞,以200倍稀释的多克隆抗体作为一抗,稀释到工作浓度的FITC标记的羊抗鼠IgG作为二抗,同时设PRRSV阳性猪血清和免疫前小鼠阴性血清为对照,进行IFA试验。
2 结果
2.1 Nsp7基因的扩增与重组质粒pET-Nsp7的构建 以提取的PRRSV HuN4株总RNA为模板,经RT-PCR扩增后得到大约800 bp的片段,与预期大小相符。重组质粒pET-Nsp7经BamHⅠ和HindⅢ双酶切后得到约5400 bp和800 bp的两个片段,与预期大小相符(图1);重组质粒测序结果显示扩增的Nsp7基因片段为777 bp。
2.2 重组Nsp7蛋白的表达及纯化 SDS-PAGE结果显示,pET-Nsp7转化至BL21(DE3)中经IPTG诱导后,目的蛋白获得表达,其分子量约38.5 ku(图2)。

2.3 Nsp7的反应原性 以PRRSV阳性血清和阴性血清作为一抗,HRP标记的抗猪IgG为二抗,进行western blot检测,结果显示:重组Nsp7与PRRSV阳性血清作用后,在38.5 ku处出现一条清晰的特异性反应条带,阴性血清则无反应条带(图3),表明诱导表达的重组Nsp7能够被PRRSV阳性血清特异性识别,具有良好的反应原性。
2.4 多克隆抗体效价的检测 将重组Nsp7免疫小鼠,三免3 d后采血,采用间接ELISA测定抗体效价。结果显示,三免后多克隆抗体效价达1∶32000以上(表 1)。
2.5 多克隆抗体的IFA检测 以制备的多克隆抗体作为一抗,FITC标记的羊抗鼠IgG为二抗进行IFA试验。结果显示,多克隆抗体和PRRSV猪阳性血清均能够识别PRRSV感染的Marc-145细胞,并产生荧光信号,而阴性对照则无荧光产生。表明制备的多克隆抗体能够特异性识别PRRSV的Nsp7(图4)。
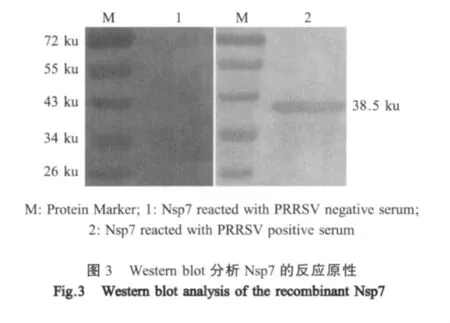

表1 间接ELISA测定多克隆抗体效价Table 1 ELISA titer of the antiserum against Nsp7

3 讨 论
按欧洲型PRRSV Lelystad株各Nsp划分,Nsp7起止位置为 Ser2083~Glu2351,北美 洲 型 PRRSV VR-2332株Nsp7的起止位置为Ser2200~Glu2458氨基酸[9]。因为HuN4株与VR-2332株相比,在Nsp2区域存在2处共30个氨基酸的缺失[10],所以HuN4株Nsp7的起止位置为 Ser2170~Glu2428。Nsp7由 777个碱基编码,共259个氨基酸。目前,PRRSV Nsp7的结构和功能尚未见报道,它在病毒复制周期中的作用仍不明确。
本实验构建了pET-Nsp7高效重组表达质粒,应用原核表达系统以融合蛋白的形式高效表达了重组Nsp7。重组Nsp7以可溶形式表达,能够保持天然构象。通过镍离子亲和层析,获得了高纯度的重组蛋白。重组蛋白与PRRSV阳性血清进行的western blot试验表明其具有良好的反应原性,具备作为检测抗原的优势,可以作为间接ELISA检测的包被抗原,为研究猪体Nsp7抗体水平的消长规律奠定了基础;而且高纯度的重组蛋白有利于进一步开展Nsp7结构和功能的研究。利用纯化的重组蛋白免疫小鼠制备的多克隆抗体,其间接ELISA效价较高,IFA试验表明其能够特异识别PRRSV感染Marc-145细胞后产生的Nsp7,显示出重组蛋白具有良好的免疫原性。制备的多克隆抗体为进一步研究Nsp7的亚细胞定位奠定了基础。
[1]Bilodeau R,Dea S,Sauvageau R A,et al.'Porcine reproductive and respiratory syndrome'in Quebec[J].Vet Rec,1991,129(5):102-103.
[2]Dokland T.The structural biology of PRRSV[J].Virus Res,2010,154(1-2):86-97.
[3]Zhou Lei,Yang Han-chun.Porcine reproductive and respiratory syndrome in China[J].Verus Res,2010,154:31-37.
[4]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-326.
[5]Van Aken D,Zevenhoven-Dobbe J,Gorbalenya A E,et al.Proteolytic maturation of replicase polyprotein pp1a by the nsp4 main proteinase is essential for equine arteritis virus replication and includes internal cleavage of nsp7[J].J Gen Virol,2006,87:3473-3482.
[6]Nelsen C J,Murtaugh M P,Faaberg K S.Porcine reproductive and respiratory syndrome virus comparison:divergent evolution on two continents[J].J Virol,1999,73(1):270-280.
[7]Brown E,Lawson S,Welbon C,et al.Antibody response to porcine reproductive and respiratory syndrome virus(PRRSV)nonstructural proteins and implications for diagnostic detection and differentiation of PRRSV typesⅠandⅡ[J].Clin Vaccine Immunol,2009,16(5):628-635.
[8]Fang Ying,Schneider P,Zhang Wei-ping,et al.Diversity and evolution of a newly emerged North American Type 1 porcine arterivirus:analysis of isolates collected between 1999 and 2004[J].Arch Virol,2007,152(5):1009-1017.
[9]Fang Ying,Snijder E J.The PRRSV replicase:exploring the multifunctionality of an intriguing set of nonstructural proteins[J].Virus Res,2010,154:61-76.
[10]韦祖樟,孙志,袁世山.猪繁殖与呼吸综合征病毒分子生物学研究进展[J].微生物学通报,2008,35(5):408-413.

