规模化猪场大肠杆菌β-内酰胺类药物耐药性检测及其超广谱β-内酰胺酶调查
田国宝,王红宁,张安云,张 毅,杨 鑫,徐昌文
(四川大学生命科学学院/动物疫病防控与食品安全四川省重点实验室/生物资源与生态环境教育部重点实验室/“985工程”西南资源环境与灾害防治科技创新平台,四川成都610064)
大肠杆菌(Escherichia coli)是引起动物腹泻的主要病原之一,也是引起仔猪、雏禽死亡的重要原因。随着抗菌药物的广泛应用,E.coli耐药问题也越来越严重。β-内酰胺类药物是临床常用的抗生素,占抗生素使用总量约30%~40%[1-2]。E.coli对广谱β-内酰胺类药物耐药最主要的耐药机制是产β-内酰胺酶(β-Lactamases)[3],而其中以超广谱β-内酰胺酶(ESBLs)受到最为广泛的关注。
近年来,随着全世界对细菌耐药问题的广泛关注,动物源细菌产β-内酰胺酶及ESBLs研究逐渐增多[4]。而我国动物源细菌对β-内酰胺类药物的耐药性研究很少。本研究对全国19个省97个猪场602株E.coli进行了β-内酰胺类药物耐药谱系检测、耐药基因型分析和分子流行病学调查,为阐明我国猪源E.coli对该类药物的耐药现状和耐药机制,为耐药性控制和药物合理使用提供实验依据。
1 材料和方法
1.1 菌株 2006年2月~2008年12月从19个省97个规模化猪场分离602株E.coli分离株。菌株鉴定结合了菌落形态特征、染色镜检、生化鉴定、16S rDNA序列分析和VITEK 32微生物自动鉴定系统等方法。药敏质控菌ATCC25922(敏感株)、ATCC35218(产β-内酰胺酶株)购自杭州微生物有限责任公司。试验菌株由四川大学动物疾病防控生物工程研究中心保存。样品采样分布见表1。
1.2 主要试剂和设备 抗菌药物及药敏纸片购自英国 Oxoid公司 (Oxoid,Basingstoke,UK),Taq酶、100 bp DNA ladder、Maker DL-2000和DNA凝胶回收试剂盒购于天根生化科技有限公司,dNTP、培养基和常规化学试剂购自宝生物工程(大连)有限公司,PCR引物由上海生工有限公司合成。脉冲场电泳仪购自Bio-Rad公司。
1.3 药敏试验 采用药敏纸片法(KB法)对602株E.coli进行β-内酰胺类、氨基糖苷类、氟喹诺酮类和四环素类等4大类16种抗菌药物进行药物敏感性检测,耐药判定标准参照美国临床及试验标准协会(CLSI)2010[5]。
1.4 产ESBLsE.coli筛选 按照CLSI 2010年标准,选用药敏纸片头孢他啶(CAZ)、头孢他啶/克拉维酸(CAZ/CLA)、头孢噻肟(CTX)和头孢噻肟/克拉维酸(CTX/CLA)筛选产ESBLs菌株。结果判定:以含CLA的药敏纸片与其相应不含CLA的药敏纸片抑菌环直径的差值≥5mm确定为产ESBLs的菌株。
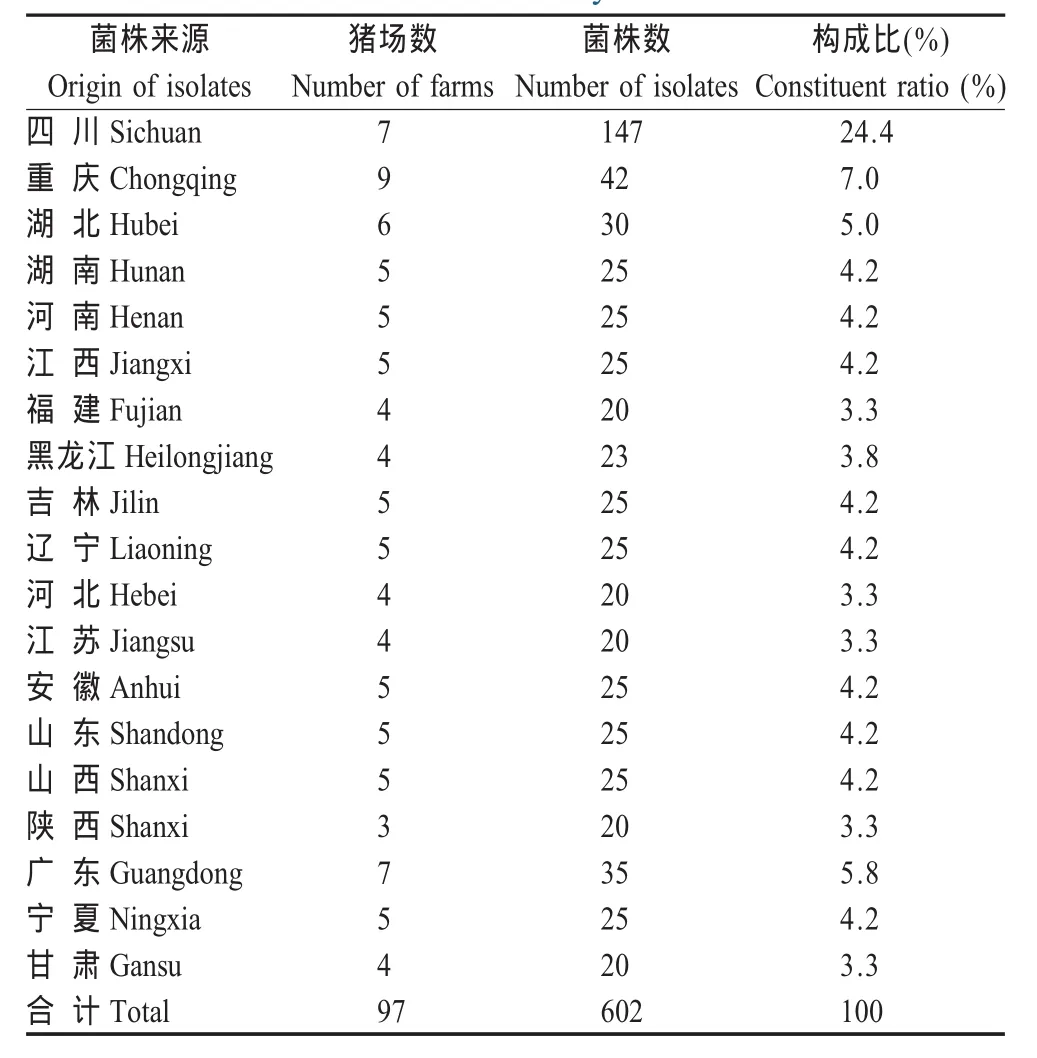
表1 602株猪源E.coli采样分布表Table 1 Sampling distribution of 602E.coliisolates in this study
1.5 β-内酰胺酶耐药基因PCR检测及序列分析采用PCR方法进行9种常见β-内酰胺酶耐药基因的检测。设计并合成9对PCR引物(表2)。PCR反应条件:10×buffer 2.5 μL,DNTP 2 μL,MgCl21.5 μL,上、下游引物各 0.5 μL,模板 DNA 0.5 μL,Taq 酶 0.25 μL,加 ddH2O 至 25 μL。PCR 反应参数:94℃ 8 min; 94℃ 1 min、50℃~57℃ 55 s、72℃ 1 min,共 30个循环;最后延伸 7min。对PCR产物进行测序并利用BLAST软件分析耐药基因的亚型。
1.6 产ESBLs菌株脉冲场凝胶电泳(PFGE) 对部分产ESBLsE.coli进行PFGE,分析菌株间同源性。PFGE电泳结果用Bionumerics 4.0(Applied Maths,Sint-Martens-Latem,Belgium)软件进行分析,同源性判断标准按目前被普遍采用的Tenover标准[6]进行。
2 结果
2.1 药敏试验结果 耐药性检测结果表明情况:602株E.coli分离株对氨苄西林耐药率为88.37%,对先锋霉素耐药率为33.39%,对第二、第三代头孢类药物(头孢西丁、头孢他啶、头孢三嗪和头孢噻肟)耐药率为3.49%~10.63%,而对专用于动物的第三代头孢类头孢噻呋耐药率为11.63%,对氨曲南耐药率为1.99%;同时,E.coli对四环素的耐药率达97.0%,对氟喹诺酮类药物(环丙沙星和氧氟沙星)的耐药率约70%,对氨基糖苷类的庆大霉素耐药率为65.8%,阿米卡星耐药率为7.5%;但对碳青霉烯类药物亚胺培南几乎均为敏感(表3)。

表2 β-内酰胺酶耐药基因扩增引物Table 2 Primer sequences and relative information of β-lactmase genes
2.2 产ESBLsE.coli筛选试验结果 采用纸片扩散法进行了产ESBLs菌株筛选。结果表明,本研究共从602株E.coli中鉴定出57株产ESBLs。
2.3 β-内酰胺酶基因PCR检测及序列分析结果采用PCR方法进行了9种β-内酰胺酶基因的检测。结果显示,共有35株产blaCTX-M(其中9株产blaCTX-M-3,18株产 blaCTX-M-15,9株产 blaCTX-M-22);共有20株产blaSHV(其中 8株产 blaSHV-5;2株产 blaSHV-11,10株产blaSHV-12)。此外,分别有53株产blaTEM-1,14株产blaCMY-2。没有发现blaOXA-23和blaKPC型β-内酰胺酶。
进一步分析发现,ESBLs基因的分布在不同地区存在明显差异。四川、重庆等西南地区主要以流行CTX-M-15,CTX-M-22为主,华东地区以SHV-12为主,东北地区以SHV-5为主,广东地区主要产CTX-M-22,而山东地区主要产CTX-M-3。
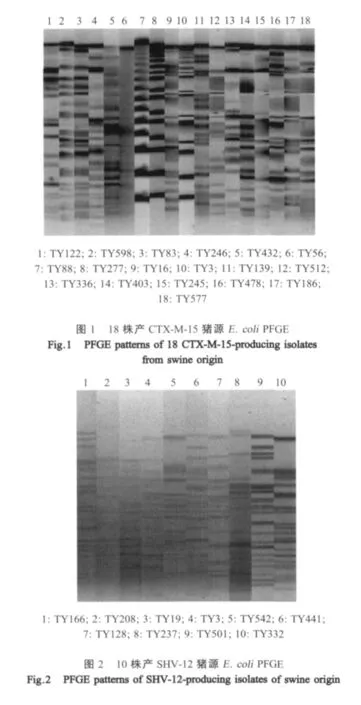
2.4 产ESBLs菌株脉冲场凝胶电泳(PFGE)结果对18株产CTX-M-15和10株产SHV-12的E.coli菌株进行PFGE分型,观察菌株间的同源性 (图1,图 2)。结果表明,18株产 CTX-M-15或 10株产SHV-5E.coli菌株间同源性较低,分属于不同的PFGE型别,表明我国产ESBLsE.coli多为零星发生或者以质粒介导的形式传播。
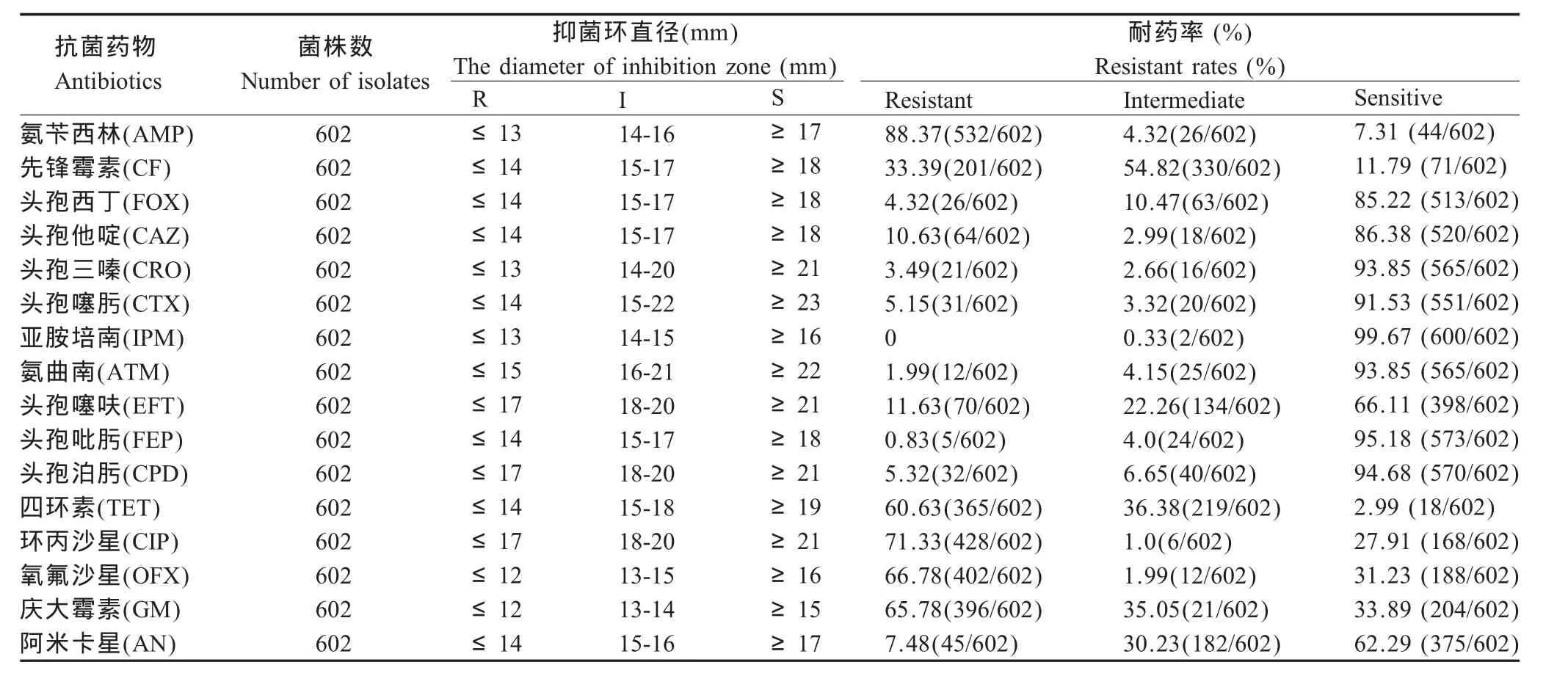
表3 19个省97个规模化猪场602株猪源E.coli耐药情况表Table 3 Resistance to antibiotics of 602E.coliisolates
3 讨 论
本研究药敏结果显示,E.coli对β-内酰胺类、氨基糖苷类、氟喹诺酮类和四环素类药物耐药率高于王红宁等报道的结果(p<0.05),表明随着抗生素药物的大量使用,细菌耐药性越来越严重[7]。同时,药敏结果显示E.coli对青霉素类、第一、二、三和四代头孢类药物的耐药率逐级递减,显示受试菌株对β-内酰胺类药物的耐药率与药物的出现与使用时间相关,药物越新,耐药率越低。Batchelor等报道显示,介导β-内酰胺类药物的耐药基因常常与介导氨基糖苷类、氯霉素类和磺胺类药物的耐药基因在同一质粒上,导致耐药性的共选择(Co-selection)和共同播散,即其他药物(如氨基糖苷类、氯霉素类或磺胺类药物)的使用,可能会使β-内酰胺类药物的耐药性选择出来[8]。因此,一旦耐药细菌存在,即使临床上不使用β-内酰胺类药物,其他抗菌药物的使用同样可以使细菌对β-内酰胺类药物产生耐药。
各个国家、地区流行的优势ESBLs基因型各不相同。葡萄牙动物源性E.coli主要流行TEM-1、OXA和SHV[9];而德国和美国情况相似[10-11]。西班牙动物源性β内酰胺酶多为仅具有窄谱水解活性的TEM-1、SHV-1和经典的OXA酶[12]。香港从猪、牛及鸽子分离了产CTX-M-3、CTX-M-13、CTX-M-14或CTX-M-24E.coli[13]。与李家斌等报道的结果不同[14],本研究表明我国猪源E.coli中主要流行CTX-M型和SHV型ESBLs。值得注意的是,本研究表明CTX-M-15呈现全国流行的态势,而CTX-M-15也是当前国际流行最广危害最严重的β内酰胺酶基因型,本研究发现的产CTX-M-15E.coli与国际上流行的产CTX-M-15E.coli是否相关,有待于进一步研究。
[1]辛海波.β内酰胺类抗生素的耐药与合理应用[J].航空航天医药,2000,(4):225-6.
[2]金少鸿.抗生素在人类医学领域以外使用的危险控制策略[J].中国抗生素杂志,2005,6(30):321-324.
[3]Bradford P.A.Extended-spectrum beta-lactamases in the 21st century:characterization,epidemiology,and detection of this important resistance threat[J].Clin Microbiol Rev,2001,14:933-951.
[4]Li Xian-zhi,Mehrotra M,Ghimire S.β-Lactam resistance and β-lactamases in bacteria of animal origin[J].Vet Microbiol,2007,121:197-214.
[5]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing;Twentieth informational supplement[M].Wayne,PA:CLSI,2010.
[6]Tenover F C,Arbeit R D,Goering R V,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis:Criteria for bacterial strain typing[J].J Clin,Microbiol,1995,33:2233-2239.
[7]Tian Guo-bao,Wang Hong-ning,Zou Li-kou,et al.Detection of CTX-M-15,CTX-M-22,and SHV-2 extended-spectrum bata-lactamases(ESBLs)inEscherichia colifecal-sample isolates from pig farms in China[J].Foodborne Pathog Dis,2009,3(6):297-304.
[8]Batchelor M,Threlfall E J,Liebana E.Cephalosporin resistance among animal-associated Enterobacteria:acurrentpersoective[J].Expert Rev Anti Infect Ther,2005,3(3):403-417.
[9]Ferreira A J,Correia J H,Jaggy A.Thoracolumbar disc disease in 71 paraplegic dogs:influence of rate of onset and duration of clinical signs on treatment results[J].J Small Anim Pract,2002,43(4):158-163.
[10]Guerra B,Junker E,Schroeter A,et al.Phenotypic and genotypic characterization of antimicrobial resistance in GermanEscherichia coliisolates from cattle,swine and poultry[J].J Antimicrob Chemother,2003,52(3):489-492.
[11]Bradford P A,Cherubin C E,Idemyor V,et al.Multiply resistantKlebsiella pneumoniaestrains from two Chicago hospitals:identification of the extended-spectrum TEM-12 and TEM-10 ceftazidime-hydrolyzing beta-lactamases in a single isolate[J].Antimicrob Agents Chemother,1994,38:761-766.
[13]Duan R S,Sit T H,Wong S S,et al.Escherichia coliproducing CTX-M β-lactamases in food animals in Hong Kong[J].Microb Drug Resist,2006,12(2):145-149.
[14]李家斌,李惠,李旭,等.4株产TEM型超广谱β内酰胺酶肠杆菌科细菌的研究[J].中国抗感染化疗杂志,2004,4(6):324-327.

