犬布氏杆菌Cu/Zn-SOD基因的原核表达及多克隆抗体的制备
曾宪斌,熊永忠,贾 坤,张敦伟,佘利旋,夏惠焰,远立国,李守军*
(1.华南农业大学兽医学院,广东广州510642;2.中国农业科学院哈尔滨兽医研究所哈尔滨维科生物技术开发公司,黑龙江哈尔滨150069)
犬布氏杆菌病(Canine Brucellosis)是由犬布氏杆菌(Brucella canis)引起的人畜共患传染病。B.canis为粗糙型布氏杆菌,革兰氏染色阴性。1966年Leland Carmichael首次分离到 B.canis。在我国,1984年尚德秋首次分离到B.canis。B.canis主要感染狗,还可以感染人、猴和兔。主要侵害宿主的生殖系统,引起感染宿主的不育,怀孕母畜流产,公畜附睾炎和前列腺炎,另外还可以引起全身性的淋巴结炎和眼葡萄膜炎。
犬布氏杆菌病的诊断方法有很多种,常用的有细菌分离培养、试管凝集试验(TAT)、玻板凝集试验、虎红平板凝集试验(RBPT)和琼脂免疫凝胶扩散试验(AGID),但这些方法均存在一定缺陷。ELISA方法作为一种快速、敏感、特异的检测方法,是公认的较有效的布氏杆菌病(Brucellosis)检测方法。目前只有牛种和猪种布氏杆菌(Brucella)的ELISA试验是国际贸易中的指定试验。绵羊副睾种Brucella也已有成熟的ELISA诊断技术[1]。ELISA方法在检测B.canis上的应用还需进一步改进抗原和积累数据。Cu/Zn-SOD是Brucella除沙林鼠种和猪种Brucella生物2型外,各生物型均表达的一个蛋白,是建立B.canisELISA检测方法的候选抗原之一。本研究表达、纯化了B.canis重组Cu/Zn-SOD蛋白,并检测其免疫原性,为研究Cu/Zn-SOD蛋白在B.canis的ELISA检测中的应用奠定了基础。
1 材料和方法
1.1 实验材料 B.canis及阴性犬血清由本实验室分离并保存;B.canis阳性血清由北京畜牧兽医研究所提供;pMD18-T Simple Vector、pET-28a(+)Vector、ExTaqDNA聚合酶、T4 DNA连接酶、EcoRⅠ、HindⅢ、DNA Marker均购自宝生物工程(大连)有限公司;质粒小量抽提试剂盒购自OMEGA公司;胶回收小量试剂盒购自上海华舜生物技术有限公司;预染蛋白Marker购自Fermentas公司;辣根过氧化物酶(HRP)标记兔抗犬IgG购自JACKSON公司;HRP标记的羊抗兔IgG购自天根生化科技有限公司;Ni-IDA蛋白纯化柱购自上海生工生物工程技术服务有限公司。
1.2 引物设计 参照GenBenk登录的B.canis基因序列(ATCC 23365),利用Primer 5生物软件设计特异性引物扩增Cu/Zn-SOD基因,引物序列如下:P1:5'-ATGACGACGGTAAAAATGTATGAGG-3';P2:5'-AAGCTTTTATTCGATCACGCCGCAG-3',划线部分分别为EcoRⅠ和HindⅢ酶切位点。预期扩增产物为462 bp。引物由上海英骏生物技术有限公司合成。
1.3 Cu/Zn-SOD基因的PCR扩增 提取B.canis基因组DNA,并以其为模板进行PCR扩增,PCR反应条件为:94℃ 5 min;94℃ 30 s、61℃ 40 s、72℃1 min,30个循环;72℃10 min。PCR产物经琼脂糖凝胶电泳检测。
1.4 Cu/Zn-SOD基因PCR产物的克隆 将纯化的PCR产物连接于pMD18-T载体中,并转化E.coli DH5α感受态细胞,涂布于含氨苄青霉素(100 μg/mL)的LB琼脂平板上,过夜培养后挑取白色单菌落,对菌液PCR鉴定阳性的克隆进行测序,并将测序结果与原序列进行比较分析。重组克隆质粒命名为pMD-SOD。
1.5 重组表达质粒的构建及鉴定 按E.N.Z.A质粒小量抽提试剂盒说明书抽提重组质粒pMD-SOD,采用EcoRⅠ和HindⅢ双酶切并回收SOD基因,再将回收的SOD基因连接到经同样酶切的原核表达载体pET-28a(+)中,连接产物转化于E.coliDH5α。重组表达质粒命名为pET-SOD。对重组表达质粒进行双酶切鉴定并测序。
1.6 重组质粒的诱导表达、SDS-PAGE和western blot分析 将阳性重组质粒pET-SOD转化E.coli BL21(DE3)感受态细胞,挑选阳性菌进行诱导表达。于诱导后6 h取菌液进行SDS-PAGE和western blot鉴定。
1.7 SOD蛋白的纯化及多克隆抗体的制备 将含有阳性重组质粒pET-SOD的BL21(DE3)菌液按1%比例接种于含卡那霉素(100 μg/mL)的新鲜LB液体培养基中,加入终浓度为1.0 mmol/L的无菌IPTG诱导。收集菌体,超声破碎。按Ni-IDA蛋白纯化柱说明书对超声上清液进行纯化。将纯化蛋白与等体积的弗氏完全佐剂充分混匀(蛋白终浓度为0.5mg/mL),新西兰兔背部皮下多点注射,每只3 mL。第2周和第4周分别将纯化蛋白与等体积不完全弗氏佐剂充分混匀(蛋白终浓度为0.5 mg/mL)进行第2次和第3次免疫。在一免、二免、三免后第14 d分别耳静脉采血,离心收集血清,进行western blot分析。三免后第14 d颈静脉采血,离心收集血清,-70℃保存备用。
2 结 果
2.1 Cu/Zn-SOD基因的扩增与重组表达质粒的酶切鉴定 Cu/Zn-SOD基因的PCR产物经1%琼脂糖凝胶进行电泳检测,获得条带与预期产物大小一致(图 1)。

对PCR鉴定阳性的菌扩大培养,抽提质粒。pET-SOD重组质粒经HindⅢ和EcoRⅠ双酶切,得到约5300 bp和460 bp的片段,表明构建了重组质粒pET-SOD。
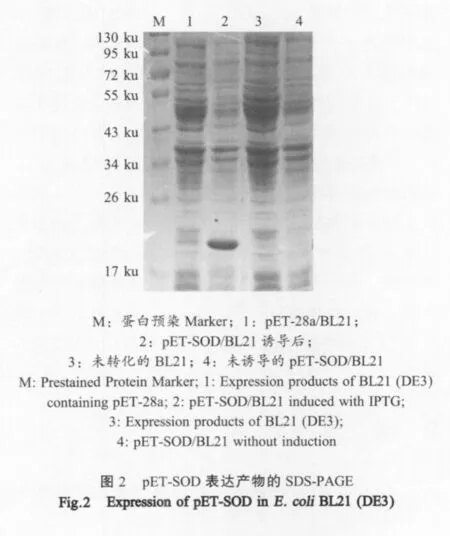
2.2 重组蛋白的诱导表达 将经1 mmol/L的IPTG诱导的pET-SOD/BL21菌体进行SDS-PAGE分析。结果表明,在20 ku左右出现一条明显的条带,与预期大小一致,表明该基因片段在大肠杆菌BL21中得到表达(图2)。
2.3 Western blot检测 重组表达蛋白进行western blot反应,结果显示,20 ku处出现一条明显的印迹,表明重组蛋白可以被B.canis阳性血清识别,具有良好的抗原性(图3)。
2.4 兔抗Cu/Zn-SOD多克隆抗体的western blot分析 分别以一免、二免、三免第14 d的血清(1∶100稀释)作为一抗进行western blot分析,结果表明在20 ku处均出现条带,二免、三免第14 d抗体效价达到最高(图4)。

3 讨论
1999年~2007年间,日本报道了11例Brucellosis患者,其中7例由B.canis引起[2]。2008年,在日本又发现了两例感染B.canis的患者[3]。在我国,随着宠物行业的发展,B.canis对人类的健康威胁也越来越大。2009年何丹运用试管凝集试验和虎红平板凝集试验,对中国农业大学动物医院临床采集的415份犬血清样品进行犬布氏杆菌病血清学检测,检出阳性血清1例[4]。2006年朴东日从实验动物比格犬中分离出2株B.canis,可见在中国部分地区存在B.canis的感染[5]。因此,深入研究B.canis致病机制和建立早期B.canis感染的快速检测方法显得越来越重要。目前,ELISA方法是公认检测B.canis较有效的方法,而选择合适的抗原是建立ELISA方法的关键。
Cu/Zn-SOD在Brucella的致病性和介导机体产生免疫反应方面的作用还存在争议,可能原因是在光滑型Brucella中,其主要的毒力因子是LPS-O侧链,在该因子的存在下,Cu/Zn-SOD的毒力被掩盖而检测不到,另外BrucellaCu/Zn-SOD与真核生物宿主存在部分同源性,所以很可能对部分同源的抗原产生体液免疫反应要比外源性抗原的时间长[6-9]。本研究中利用重组表达的Cu/Zn-SOD蛋白为抗原可以检测B.canis阳性血清中的Cu/Zn-SOD的抗体。分析可能原因有:(1)B.canis是粗糙型Brucella,缺乏LPS-O侧链,所以Cu/Zn-SOD的作用不会被掩盖;(2)患犬感染B.canis的时间比较长,足以产生抗Cu/Zn-SOD的抗体。
本研究构建了B.canisCu/Zn-SOD基因的原核表达载体pET-SOD,将其进行表达、纯化和western blot分析,重组蛋白Cu/Zn-SOD与B.canis阳性血清发生特异性反应;并制备了兔抗B.canis Cu/Zn-SOD多克隆抗体,经western blot分析表明,该多克隆抗体可以与重组蛋白发生特异性反应,表明重组蛋白抗原性良好,为B.canisCu/Zn-SOD蛋白的免疫保护性研究和Cu/Zn-SOD蛋白在B.canis ELISA检测中的应用奠定了基础。
[1]Nielsen K.Diagnosis of brucellosis by serology[J].Vet Microbiol,2002,90:447-459.
[2]Imaoka K.Brucellosis(1999.4-2007.3)Infectious agents surveillance report in Japanese[J].Tokyo:Ministry of Health,Labour and Welfare;and National Institute of Infectious Diseases,2007,28:227-228.
[3]Nomura A,Imaoka K,Imanishi H,et al.HumanBrucella canis infections diagnosed by blood culture[J].Emerg Infect Dis,2010,16(7):1183-1184.
[4]何丹,韦海涛,施振声,等.北京地区犬布氏杆菌病血清学调查[J].中国兽医杂志,2009,45(2):64-65.
[5]朴东日,赵鸿雁,李兰玉,等.从北京某地分离2株犬种布氏菌的鉴定报告[J].中国地方病防治杂志,2006,21(5):263-264.
[6]Latimer E J,Simmers N,Sriranganathan R M,et al.Brucella abortusdeficent in copper/zinc superoxide dismutase is virulent in BALB/C mice[J].Micro-Patho,1992,12:105-113.
[7]Tabatabai L B,Pugh G W Jr.Modulation of immune responses in Balb/c mice vaccinated withBrucella abortusCu-Zn superoxide dismutase synthetic peptide vaccine[J].Vaccine,1994,12(10):919-924.
[8]Vemulapalli R,Cravero S.Overexpression of protective antigen as a novel approach to enhance vaccine effcacy ofBrucella abortusstrain RB51[J].Infect Immun,2000,68:3286-3289
[9]唐浏英.布鲁氏菌以铜/锌为辅基的超氧化物歧化酶的研究进展[J].中国地方病防治杂志,1996,11(1):40-42.

