新城疫病毒感染绵羊诱导免疫应答反应的实验研究
王善辉,池贤凤,李 安,高三阳,李书光,王文秀,沈志强,*
(1.山东省滨州畜牧兽医研究院重点实验室,山东滨州256600;2.山东绿都生物科技有限公司,山东滨州256600)
新城疫是由新城疫病毒(Newcastle disease virus,NDV)引起禽的一种急性、高度传染性疫病,主要侵害鸡和火鸡,亦可感染其他禽类、鸟类及人类。NDV属于副黏病毒科(Paramyxoviridae)禽腮腺炎病毒属(Avulavirus),为单股负链RNA病毒,基因组全长15186bp,包括编码6个蛋白的基因,即3'-NP-P-M-F-HN-L-5'[1-2]。禽类是NDV的自然宿主,但某些非禽类动物也显示自然或实验性感染NDV[3]。最近,Siba等研究显示,NDV在牛体内是高度减毒的,具有宿主限制性,并且能够在其体内诱导产生病毒特异性体液和黏膜免疫抗体反应[4]。
近年来,反向遗传操作技术的发展使一些单股负链RNA病毒作为疫苗载体的研究成为热点。其中,NDV为可携带外原基因的疫苗载体之一。最近,来自于NDV弱毒株LaSota[5-6],中等毒力株Beaudette[7]和强毒株ZJ1[8]的全长感染性cDNA克隆的反向遗传操作系统相继构建,这些系统不只可以研究NDV的发病机制和生物学,而且还可以将NDV用在禽类和非禽类物种的疫苗载体的研究中。NDV脑内接种羊和猪可使其致死,而两种动物均能抵抗大剂量静脉注射NDV[9]。NDV经鼻内和气管内接种羊后,是否能够实现有限感染羊,并产生免疫反应,尚未见报道。因此,在本研究将NDV Clone-30弱毒疫苗株实验性接种绵羊,并且检测其对绵羊致病性和免疫反应,初步对NDV做为羊类传染病疫苗载体的可行性进行研究。
1 材料和方法
1.1 病毒株和细胞 NDV Clone-30疫苗株购自中国兽医药品监察所;SPF鸡种蛋购自济南斯帕法斯家禽有限公司;鸡胚成纤维细胞(CEF)由本实验室制备。
1.2 实验动物与分组 2周岁NDV HI抗体阴性的健康绵羊15只,随机分为3组,每组5只绵羊。第一组为滴鼻接种组;第二组气管灌注接种组;第三组为对照组。
1.3 免疫方法与安全试验观察 将血凝效价为210的NDV Clone-30株用PBS做5倍稀释后,滴鼻接种组每只羊的每个鼻孔滴注2m L,即每只羊共接种4m L;气管接种组的每只羊气管灌注4m L;对照组1、2号羊,每个鼻孔滴注2m L PBS,3号、4号、5号羊气管灌注4m L PBS。每天观察接种羊的临床症状,直至实验结束。
1.4 接种动物排毒的检测 于接种前和接种后1d至10d分别采集绵羊的鼻拭子和肛拭子。取鼻拭子和肛拭子的加抗生素浸液各100μL分别接种于10日龄SPF鸡胚,并传代两次。收集接种96h的鸡胚尿囊液,通过血凝试验检测病毒增殖情况。
1.5 RT-PCR检测接种绵羊血液中NDV 于接种前和接种后1d、3d、5d、7d、14d、21d、28d分别采集绵羊的抗凝血。采用TRIpure法分别提取RNA,以NDV F基因特异性引物,即上游引物P1:5'-AGGGATTGTGGTAACAGGAGA-3',外下游引物P2:5'-GTCACAGACTCTTGTATCCTA-3',内下游引物 P3:5'-TACGGATAGAATCACCAAGGG-3',通过RT-PCR检测血液中是否存在NDV RNA。
1.6 敏感性试验 将10-6TCID50的NDV尿囊液提取的RNA经浓度测定后10-1~10-610倍系列稀释,作为模板进行RT-PCR反应,以检测其敏感性。
1.7 接种动物血凝抗体的检测 于接种前和接种后1d、7d、14d、21d、28d分别采集绵羊血液,分离血清,进行血凝抑制实验。
1.8 间接ELISA法检测接种动物血清特异性IgG抗体 于接种前和接种后1d、7d、14d、21d、28d分别采集绵羊血液,分离血清。采用间接ELISA法检测接种绵羊血清特异性IgG抗体效价。即以纯化的NDV Clone-30株为包被抗原,1∶2000稀释的鼠抗羊IgG作为二抗,TMB为显色液,测定绵羊血清中NDV抗体的效价。
1.9 微量中和实验检测接种动物血清中和抗体 96孔板中每孔加入50μL病毒稀释液。第1孔加入200TCID50/100μL病毒工作液,做系列倍比稀释。第一排中再加入40μL病毒稀释液。加入10μL待检血清于第A2~A11孔,做倍比稀释。其中A2列各孔加入同倍稀释的PBS组绵羊血清,为阴性血清对照。第12列为细胞对照,每孔加入50μL病毒稀释液(4孔)。其它所有孔均加入50μL不同浓度稀释的病毒,使体积至100μL/孔。摇匀病毒-血清混合物,37℃作用2h。微量板中每孔加入细胞液,混匀后于37℃温箱孵育,每日观察细胞病变,3d~4d根据最终病变结果判定血清中和抗体滴度。
2 结 果
2.1 接种绵羊安全性试验结果 安全试验结果显示,空白对照组动物、滴鼻接种组所有动物和气管接种组的4只动物在整个研究过程中肛温均处于正常值范围内。而NDV气管灌注接种组的3号羊肛温在39℃~39.8℃的范围内。临床表现嗜睡,反应迟缓,但其整个过程中食欲未减。
2.2 接种绵羊排毒检测结果 将接种前和接种后1d~10d的绵羊鼻拭子和肛拭子浸于抗生素水中,分别接种10日龄SPF鸡胚并传代两次后取尿囊液做血凝试验,结果显示气管接种组5号羊的肛拭子有排毒反应,其它接种绵羊均无排毒反应(表1)。

表1 血凝试验(HA)检测NDV Clone-30株接种绵羊排毒结果Table 1Virus shedding of NDV Clone-30isolate inoculated sheeps detected by hemagglutination test(HA)
2.3 接种绵羊血液中NDV检测结果 经RT-PCR检测结果显示,所有接种绵羊在接种前和接种后1d、3d、5d、7d、14d、21d的血液 RT-PCR 结果均为阴性;而28d气管免疫组的4号羊血液RT-PCR检测结果为弱阳性(图1)。

2.4 RT-PCR检测NDV敏感性试验结果 将10-6TCID50的NDV尿囊液提取的 RNA 10倍连续稀释后,进行RT-PCR,结果表明,该引物能检测出的最低NDV量约为1TCID50(图2)。

2.5 接种绵羊血凝抑制抗体检测结果 接种绵羊的血凝抑制抗体效价结果显示,所有接种动物都产生较高的血凝抑制抗体,而未接种的对照组绵羊没有产生血凝抑制抗体(p<0.05)(图3)。
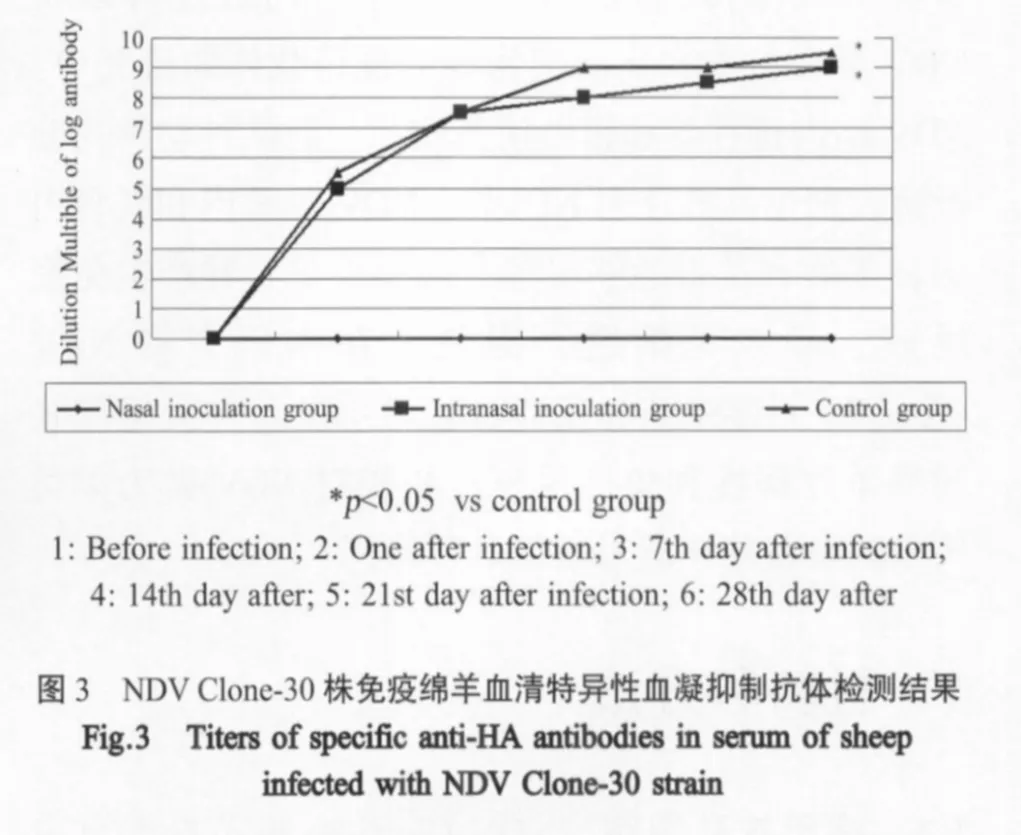
2.6 接种动物血清特异性抗NDV IgG抗体检测结果 通过间接ELISA检测接种前后1d、7d、14d、21d绵羊血清的IgG抗体结果显示,接种绵羊均不同程度的产生血清特异性IgG抗体,与对照组对比差异显著(p<0.05),并且抗体水平随着接种时间延长而增长,21d和28d抗体水平达到峰值(图4)。
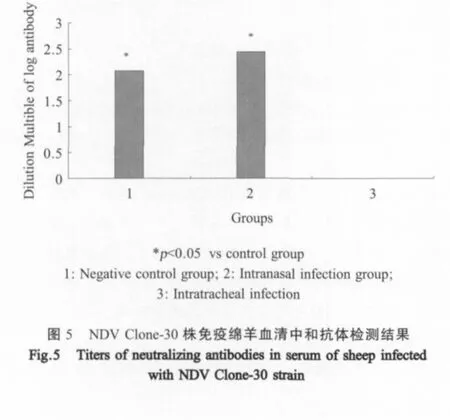
2.7 接种动物血清中和抗体检测结果 采用微量中和试验检测接种羊血清中和抗体滴度,NDV Clone-30株接种组绵羊血清均不同程度产生了中和抗体。滴鼻接种组达1∶152、气管接种组达1∶320。与对照组对比差异显著(p<0.05)。取接种后28d各组绵羊血清中和抗体常用对数值作柱形图(图5)。
4 讨 论
近年来,NDV做为一种新型病毒载体,在疫苗研究领域的应用非常广泛。本研究选择生产实践中广泛应用、免疫效果良好的一株NDV Clone-30弱毒疫苗株分滴鼻和气管灌注两条途径免疫绵羊,通过实验评价NDV做为羊类传染病疫苗载体的可能。
接种动物检测结果显示,NDV在接种绵羊体内未形成毒血症。血凝抑制试验检结果显示,除空白对照组动物外,滴鼻接种组和气管接种组绵羊都检测出了NDV特异性神经氨酸酶抗体。微量中和试验检测结检测出滴鼻接种组和气管接种组绵羊都产生不同程度的中和抗体。ELISA实验检测到NDV特异性IgG抗体滴度很高,其对血凝抑制抗体和中和抗体的滴度有直接影响。两种接种途径比较,滴鼻接种组比气管接种组更安全,而两种接种途径的抗体产生情况基本无差别。
本实验结果表明,用NDV适量感染绵羊安全可靠,并可有效地诱导机体系统免疫应答。NDV可作为宿主限制性疫苗载体用于预防无特效疫苗的羊类疾病,且与气管灌注接种途径比,滴鼻接种途径相对安全。本研究为进一步拓宽NDV做为疫苗载体的应用研究奠定重要实验基础,为NDV载体的新型羊类传染病疫苗的研制提供了可靠试验依据。
[1]Mayo M.A summary of taxonomic changes recently approved by ICTV[J].Arch.Virol,2002,147:1655-1656.
[2]De Leeuw O,Peeters B.Complete nucleotide sequence of Newcastle disease virus:evidence for the existence of a new genus within the subfamily Paramyx ovirinae[J].JGen Virol,1999;80(1):131-136.
[3]Bukreyev A,Huang Zhu-hui,Yang Li-juan,et al.Recombinant Newcastle disease virus expressing a foreign viral antigen is attenuated and highly immunogenic in primates[J].JVirol,2005,79:13275-13284.
[4]Subbiah M,Yan Y,Rockemann D,et al.Experimental infection of calves w ith Newcastle disease virus induces system ic and mucosal antibody responses[J].Arch Virol,2008,153:1197-1200.
[5]Huang Zhu-hui,Krishnamurthy S,Panda A,et a1.High level expression of a foreign gene from the most 30proximal locus of a recombinant Newcastle disease virus[J].J Gen Virol,2001,82:1729-1736.
[6]Peeters B P,de Leeuw O S,Koch G,et a1.Rescue of Newcastle disease virus from cloned cdna:evidence that cleavability of the fusion protein is a major determinant for virulence[J].Virology,1999,73:5001-5009.
[7]Krishnamurthy S,Huang Zhu-hui,Samal S K.Recovery of avirulent strain of Newcastle disease virus from cloned cDNA:expression of a foreign gene results in grow th retardation and attenuation[J].Virology,2000,278:168-182.
[8]Liu Y L,Hu S L,Zhang Y M,et a1.Generation of a velogenic Newcastle disease virus from cDNA and expression of the green fluorescent protein[J].Arch Virol,2007,152:1241-1249.
[9]Hofstad M S.Experimental inoculation of sw ine and sheep with Newcastle disease virus[J].Cornell Vet,1950,40:190-196.

