新型鸭肝炎病毒的分离鉴定及VP1基因序列分析
赵金花,沈志强,朱 辉,李 峰1,,甄洪花,苗立中1,,单 虎
(1.山东省滨州畜牧兽医研究院,山东滨州256600;2.青岛农业大学动物科技学院,山东青岛266109;3.山东绿都生物科技有限公司,山东滨州256600)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由DVH病毒(Duck hepatitis virus,DHV)引起雏鸭的一种以肝脏病变为主要病理变化的急性致死性传染病。近年来,国内外相继报道了新型DHV(N-DHV)。2002年,苏敬良等从北京和广西分离到2株与DHV-1及DHV-3型无血清学相关性的DHV,并将其定为N-DHV[1]。范书才等对从广东分离的DHV GD株进行生物学和理化学特性以及交叉中和试验,鉴定结果表明GD株的抗原性与DHV-1无关,属于N-DHV[2]。2007年,Tseng等在台湾发现一株新型DHV[3-4],同年Kim等在韩国也发现了一株N-DHV,并对其进行基因组序列测定与分析[5-6]。N-DHV的不断出现严重危害养鸭业的发展。
本研究对从广西、河南和山东发病鸭体内分离的3株病毒进行初步鉴定,确定为N-DHV。并对分离株的VP1基因进行序列测定及相关分析,为N-DHV分子流行特点的研究奠定基础。
1 材料和方法
1.1 实验材料 病料样品分别来自广西、河南以及山东发病鸭场;DHV-1及DHV-1阳性血清购自中国兽医药品监察所;N-DHV阳性血清由山东省滨州畜牧兽医研究院实验室制备,中和效价≥1∶64;SPF鸡胚购自济南斯帕法斯家禽有限公司;鸭胚及雏鸭均购自滨州久久鸭场。
1.2 主要试剂 反转录酶(M-MuLV)购自北京百泰克生物技术有限公司;反转录酶抑制剂、dNTP、rTaqDNA聚合酶、DNA Marker购自TaKaRa公司;TRIzol购自上海生工生物工程技术服务有限公司。
1.3 样品处理 将病料样品按1∶5比例加入灭菌生理盐水,匀浆捣碎,反复冻融3次,8000 r/min离心10 min,取上清液加入青霉素、链霉素使其终浓度均为2000 IU/mL,37℃作用30 min,以0.22 μm过滤备用。
1.4 RT-PCR检测 参照文献[7]由上海生工生物工程技术服务有限公司合成鉴定N-DHV的引物。参照TRIzol说明书提取病毒RNA。反转录条件为:70℃ 5 min;42℃ 1 h;70℃ 10 min。PCR反应程序为:94℃ 5 min;94℃ 40 s、58℃ 40 s、72℃1 min,30个循环;72℃10 min。产物经琼脂糖凝胶电泳检测。
1.5 病毒分离 将处理的病料样品经尿囊腔途径接种11日龄鸭胚,接种量为0.2 mL/胚;同时设等量灭菌生理盐水对照组。分别孵化,观察鸭胚的病变和死亡情况,并收获24 h~96 h尿囊液继续传代。
1.6 病毒鸭胚半数致死量(ELD50)测定 以生理盐水将鸭胚分离病毒株作10倍系列稀释,取适宜稀释度鸭胚毒接种11日龄鸭胚,每个稀释度接种5枚,0.2 mL/胚,37℃继续培养,观察并记录鸭胚的死亡数目。按Reed-Muench法计算病毒ELD50。
1.7 血清中和试验 采用固定病毒稀释血清法。将DHV-1和N-DHV阳性血清(中和效价≥1∶64)分别于56℃灭活30 min,进行10倍倍比稀释,各取0.5 mL分别与等量200 ELD50分离株混匀,37℃作用1 h,经尿囊腔分别接种11日龄鸭胚,每组接种5枚,0.2 mL/胚,同时设病毒和生理盐水对照组。37℃培养,观察6 d,记录各组的死胚数目。
1.8 动物回归试验 将病毒液稀释为200 ELD50,颈部皮下注射无DHV母源抗体的3日龄雏鸭5只,0.3 mL/只。另设5只正常对照,隔离饲养观察7 d。
1.9 SPF鸡胚感染试验 取分离的3株病毒鸭胚尿囊液经尿囊腔接种SPF鸡胚,0.2 mL/胚,盲传5代后收获尿囊液。
1.10 细胞接种试验 将分离的3株病毒鸭胚尿囊液分别接种单层鸡胚成纤维细胞,盲传5代后取细胞培养液接种11日龄鸭胚,检测病毒是否能够在其中增殖。
1.11 VP1基因的扩增
1.1 1.1 引物的设计与合成 根据GenBank中登录的 N-DHV VP1基 因 序 列(AP-03337,DQ25613;AP-04009, DQ25613; AP-04114, DQ812093;AP-04203,DQ25613),设计引物:F:5'-CGGATCC GGTGATTCCAATCAGCT-3'和 R:5'-CCCAAGCTTT TCAATTTCCAAATGGA-3'。引物由上海生工生物工程技术服务有限公司合成。分别含有BamHⅠ和HindⅢ酶切位点,扩增片段长度为720 bp。
1.1 1.2 分离株VP1基因的扩增 提取分离株RNA,并进行RT-PCR扩增。PCR反应条件为:94℃5 min;94℃ 50 s、60℃ 50 s、72℃ 1 min,30个循环;72℃10 min。产物琼脂糖凝胶电泳检测,并克隆至pMD18-T载体中进行鉴定,鉴定正确的重组质粒测序。并与GenBank中登录的DHV参考株VP1基因进行序列比对,构建系统进化树。所用病毒株及其GenBank登录号为:DHV-A(03D,DQ249299; 5886, DQ249301; A66, DQ886445)DHV-B(90D,EF067924;04G,EF067923)和 DHV-C(AP-03337, DQ25613; AP-04009, DQ25613;AP-04114,DQ812093;AP-04203,DQ25613)。
2 结果
2.1 RT-PCR扩增结果 采用N-DHV鉴别引物对分离株进行RT-PCR扩增,产物经琼脂糖凝胶电泳后可见约为700 bp清晰条带,与预期片段大小(705 bp)一致(图 1)。

2.2 鸭胚病毒分离结果 将病料样品接种11日龄易感鸭胚,24 h~96 h死亡鸭胚肝脏出血,肿大,收获其尿囊液继续传代。分离获得3株病毒,从广西、河南、山东分离到的病毒分别依次命名为GX株、HN株、LZ株。
2.3 病毒鸭胚ELD50分离病毒GX株、HN株、LZ株的ELD50值分别为10-3.29/0.2 mL、10-4.25/0.2 mL和10-4.65/0.2 mL。
2.4 血清中和试验结果 分别以DHV-1和N-DHV阳性血清与分离株进行交叉中和试验,结果表明:DHV-1阳性血清对分离株无中和作用,接种的鸭胚在48 h~96 h全部死亡,表明分离株不是DHV-1;分离株对照组接种的鸭胚在48 h~96 h也全部死亡,而N-DHV阳性血清对分离株具有保护作用,鸭胚仅在96 h死亡1只,因此分离株可以判定为N-DHV(表 1)。
2.5 动物回归试验结果 攻毒组雏鸭在48 h开始发病死亡,在96 h内GX株、HN株、LZ株的死亡率分别为50%、70%和65%,表明分离的3株病毒的毒力存在一定差异。死亡鸭呈现典型的DVH症状和病理变化,角弓反张、肝脏肿大、有出血点、出血斑,而对照组鸭无任何症状。

表1 血清中和试验结果Table 1 The neutralization tests of the isolates with different anti-serum
2.6 分离株接种SPF鸡胚试验 经SPF鸡胚连续传5代,鸡胚发育正常,无死亡,再返传鸭胚也未出现死亡,表明分离株不能在鸡胚中增殖。
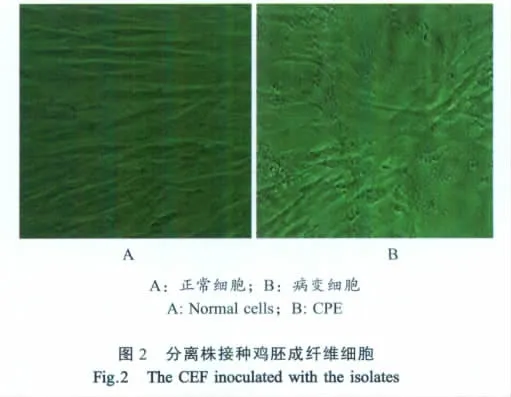
2.7 细胞接种试验结果 分离株接种鸡胚成纤维细胞,传至第3代时细胞出现病变,分离株传代至第5代,接毒60 h后,细胞皱缩、死亡、脱落,产生明显病变。将第5代细胞培养液接种鸭胚后,鸭胚也出现病变、死亡,表明分离株可以在鸡胚成纤维细胞中增殖(图2)。
2.8 分离株VP1基因的PCR扩增结果 VP1基因PCR扩增产物进行琼脂糖凝胶电泳检测结果表明,扩增片段约720 bp,与预期目的片段大小一致(图3)。
2.9 VP1基因序列分析 测序结果表明分离株GX、LZ、HN的VP1基因均为714 bp。将3个分离株的VP1基因序列与GenBank中登录的序列进行同源性比较,结果显示:3个分离株核苷酸序列与DHV-A、DHV-B、DHV-C的序列同源性分别为68.1%~69.6%、70.7%~71.4%、92.4%~94.8%,氨基酸序列同源性分别为75.7%~76.6%、78.4%~79.4%、91.9%~92.8%(图 4)。3个分离株与DHV-C的同源性最高,与DHV-A的同源性最低。与DHV-A相比,分离株的VP1基因存在连续3个氨基酸的插入和1个氨基酸的缺失;而与DHV-B相比,分离株的VP1基因存在连续3个氨基酸的插入和连续2个氨基酸的缺失。3个分离株之间的同源性为98.6%~99.5%,同源性较高,表明我国广西、河南、山东地区均存在韩国N-DHV的流行。
2.10 遗传进化分析 对VP1蛋白氨基酸序列进行比对,绘制遗传进化树,结果表明GX株、HN株和LZ株与DHV-C处于同一分支,亲缘关系较近,但为不同小分支,表明我国分离的DHV-C与韩国分离的DHV-C存在一定差异性,并且与DHV-B相邻,而与DHV-A处于明显不同的分支(图5)。
3 讨 论

RT-PCR作为一种分子生物学检测技术,具有灵敏度高、特异性强、快速等优点,本实验首先采用RT-PCR技术对分离株进行鉴定,并与DHV-1阳性血清进行交叉中和试验,结果表明DHV-1阳性血清不能中和分离株,因此分离株不属于DHV-1,与DHV-1无血清学相关性。动物回归试验结果表明3个分离株的死亡率不同,分离株的毒力存在一定差异。将分离株接种11日龄SPF鸡胚,鸡胚发育正常,再返传鸭胚,鸭胚也发育正常,未发生死亡,表明分离株不能在鸡胚中增殖,这与苏敬良报道N-DHV不能在鸡胚中增殖相一致。
目前,已有学者对N-DHV的基因组全序列进行分析,发现N-DHV的VP1蛋白多暴露于病毒表面,包括了大部分的插入与缺失片段和高变异区,是决定病毒抗原性的主要成分,它能够诱导动物产生中和抗体。VP1蛋白的差异体现了我国N-DHV的流行特点[8-11]。因此,通过对VP1蛋白的核苷酸与氨基酸序列同源性的比较,分析该高变区,这对DHV的遗传变异的研究具有指导意义。本研究通过对VP1蛋白的分析,为N-DHV分子流行特点的进一步研究以及该病的防制提供依据。
[1]苏敬良,黄瑜,贺荣莲,等.新型鸭肝炎病毒的分离及初步鉴定[J].中国兽医科技,2002,32(1):15-16.
[2]范书才,李虹,衷率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[3]Tseng C H,Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res,2007,126:19-31.
[4]Tseng C H,Knowles N J,Tsai H J.Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J].Virus Res,2007,123(2):190-203.
[5]Kim M C,Kwon Y K,Joh S J,et al.Molecular analysis of duck hepatitis virus type I reveals a novel lineage dose to the genusParechovirusin the familyPicornaviridae[J].Gen Virol,2006,87:3307-3316.
[6]Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus reveal the presence of a new gene and serotype when compared to duck hepatitis virus type I type strains[J].Arch Virol,2007,152(11):2059-2072.
[7]何冉娅,罗玉均,孙伟,等.1型鸭病毒性肝炎病毒和新型鸭肝炎病毒鉴别RT-PCR检测方法的建立[J].黑龙江畜牧兽医,2009,(3):14-16.
[8]袁率珍,范书才,李虹,等.新型鸭肝炎病毒基因组序列分析[A].第三届中国兽药大会-兽医生物制品学、兽医微生物学学术论坛论文集.湖南长沙:2010,151-156.
[9]Ding Chun-yu,Zhang Da-bing.Molecular analysis of duck hepatitis type 1[J].Virology,2007,361(1):9-17.
[10]赵立娜,马秀丽,李玉峰,等.新型鸭肝炎病毒分离株JFX08全基因组测定与分析 [J].中国兽医学报,2010,30(2):202-205.
[11]Shi S,Cheng L,Fu G,et al.Genomic sequence of a new serotype duck hepatitis virus[J].Wei Sheng Wu Xue Bao,2009,49(3):309-315.

