辛伐他汀对大鼠缺血再灌注损伤后NGF,GAP-43,Nestin表达的影响
王柏欣 阮 洋 贾秀月 陈 梅 王 昕 邱洪斌 王淑秋 (佳木斯大学,黑龙江 佳木斯 54007)
辛伐他汀是一种羟甲基戊二酰辅酶A(HMG-COA)还原酶抑制剂,能减少胆固醇的生物合成,是一种临床上广泛使用的降血脂药物。最近实验发现辛伐他汀能减轻脑缺血再灌注损伤,但其机制尚未完全阐明。本课题拟观察脑缺血再灌注损伤后大鼠脑组织中神经生长因子(NGF),GAP-43,巢蛋白(Nestin)的表达,旨在探讨辛伐他汀对脑缺血再灌注的保护作用及机制,并为探索神经损伤修复机制及筛选新药、建立新的脑损伤治疗方法奠定理论基础。
1 材料与方法
1.1 动物及分组 健康成年Wistar大鼠,250~300 g,随机分为正常组、假手术组、模型组,辛伐他汀组。模型组和辛伐他汀组都应用线栓法建立大鼠脑缺血再灌注损伤模型,缺血时间为30 min,再灌注时间分别为 1、2、3、5、7 d,每个时间点 6 只大鼠。辛伐他汀组在术后第1天开始,予辛伐他汀20 mg/kg灌胃;假手术组及缺血再灌注模型组用相同体积的等渗盐水灌胃,正常组正常喂养。
1.2 试剂 辛伐他汀由浙江京新药业股份有限公司提供;FITC标记二抗,NGF、GAP-43、Nestin一抗由上海沪峰生物试剂公司提供;辣根过氧化酶标记二抗,β-actin,由北京中杉提供;预染蛋白Marker由 Fermentas公司提供;PVDF膜由美国Millipore公司提供;ECL发光试剂盒,BCA蛋白浓度检测试剂盒由武汉博士德生物工程有限公司提供。
1.3 方法
1.3.1 建立脑缺血再灌注模型 根据大脑中动脉栓塞法制备脑缺血再灌注模型。称重,10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉;将动物仰卧位固定(上门齿、四肢远端用粗线固定于鼠板上),碘伏消毒颈部皮肤,颈部正中切口,分离出颈总动脉、颈外动脉以及颈内动脉,分别接扎颈总动脉及颈外动脉,在颈总动脉距离分叉处将尼龙线导入颈内动脉,插入线栓深度约为(18.0±0.5)mm,感到轻微阻力时立即停止插线。此后缝合伤口,留置线头于体外,30 min后将线拴提至颈总动脉内,完成再灌注。术后将室温控制在25℃ ~30℃,视动物状况注射呋塞咪(速尿)或抗生素预防脑水肿和感染。假手术组除进线1.5 mm外,其余相同。辛伐他汀组在模型制作成功后,在术后第1天开始给药。
1.3.2 大鼠神经功能Zea-longa评分 (1)无神经功能缺失症状、活动正常者,计0分;(2)不能完全伸展对侧前爪,计1分;(3)动物爬行时出现向右转圈(追尾现象),计2分;(4)身体向偏瘫侧倾倒者,计3分;(5)不能自发行走,意识丧失者,计4分。评分为0分和4分者均被剔除,神经功能评价在取材前进行。
1.3.3 组织切片的制备以及免疫荧光检测 在实验结束点将各组动物麻醉,经左心室插管,然后快速灌注生理盐水约250 ml进行心脏灌洗,双肺变白后用4%多聚甲醛灌洗固定直到身体僵硬,迅速断头取脑,于视交叉后冠状切取4 mm厚度组织块,4%多聚甲醛固定,常规脱水,石蜡包埋,切片。分别行HE染色,神经细胞TUNEL染色法,免疫荧光化学法检测。
1.3.4 脑组织蛋白的提取以及Western印迹检测 在实验结束点将各组动物断头取脑,于冰上分离缺血侧顶叶皮层脑组织,用冰生理盐水冲洗后,将脑组织置于组织匀浆器中,按照1:10(wt/vol)加入细胞裂解液,置于冰上进行匀浆,多重复碾几次使脑组织尽量碾碎。完全碾碎后,用移液器将裂解液移至1.5 ml离心管中,然后以12 000 r/min 4℃离心10 min,取上清液置于 -80℃保存。用BCA试剂盒测定蛋白浓度,用 SDS-聚丙烯酰胺凝胶电泳分离后转移到PVDF滤膜,然后用5%脱脂牛奶封闭,特异性一抗,NGF(1∶100),GAP-43(1∶100)、Nestin(1∶100),37℃过夜,辣根过氧化物酶标记二抗 (1∶10 000)孵育2 h后,与ECL发光反应后显影。用Image pro plus图像处理系统分析荧光图片的平均荧光强度。
2 结 果
2.1 激光共聚焦结果分析 正常组、假手术组大鼠荧光强度都很弱,两组之间比较无显著性差异(P>0.05)。模型组与辛伐他汀组各亚组在缺血再灌注后1 d开始升高,在7 d达到高峰;辛伐他汀组与模型组在相同时间点比较,NGF、Nestin、GAP-43的荧光强度明显增强,差异有统计学意义(P<0.05)。见表1 ~表3,图1~图3。
表1 GAP-43的荧光强度的表达 ±s,n=6,平均荧光强度)
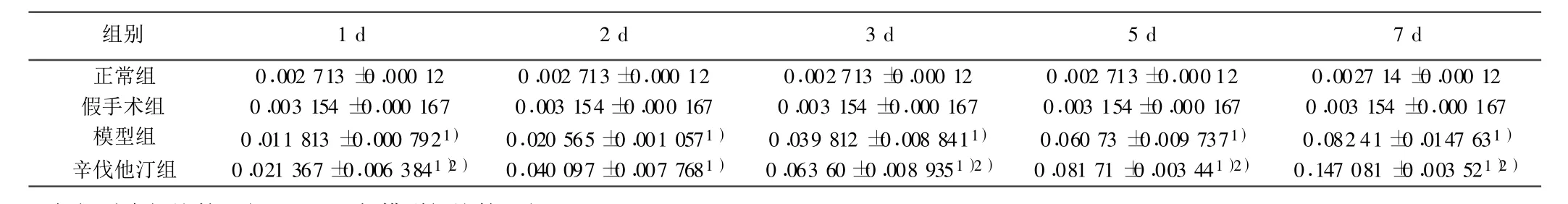
表1 GAP-43的荧光强度的表达 ±s,n=6,平均荧光强度)
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 1 d 2 d 3 d 5 d 7 d正常组 0.002 713 ±0.000 12 0.002 713 ±0.000 12 0.002 713 ±0.000 12 0.002 713 ±0.000 12 0.0027 14 ±0.000 12假手术组 0.003 154 ±0.000 167 0.003 154 ±0.000 167 0.003 154 ±0.000 167 0.003 154 ±0.000 167 0.003 154 ±0.000 167模型组 0.011 813 ±0.000 792 1) 0.020 565 ±0.001 0571) 0.039 812 ±0.008 8411) 0.060 73 ±0.009 7371) 0.082 41 ±0.0147 63 1)辛伐他汀组 0.021 367 ±0.006 3841)2) 0.040 097 ±0.007 7681) 0.063 60 ±0.008 9351)2) 0.081 71 ±0.003 441)2) 0.147 081 ±0.003 521)2)
表2 NGF荧光强度的表达(±s,n=6,平均荧光强度)

表2 NGF荧光强度的表达(±s,n=6,平均荧光强度)
与假手术组比较:1)P<0.05;与模型组比较:2)P<0.05
组别 1 d 2 d 3 d 5 d 7 d正常组 0.003 065 ±0.000 14 0.003 066 ±0.000 14 0.003 065 ±0.000 14 0.003 066 ±0.000 14 0.0030 65 ±0.000 14假手术组 0.002 835 ±0.000 321 0.002 835 ±0.000 321 0.002 835 ±0.000 321 0.002 835 ±0.000 321 0.002 835 ±0.000 321模型组 0.010 227 ±0.001 121 1) 0.022 078±0.006 5671) 0.041 891 ±0.001 158 41) 0.074 107 ±0.034 0571) 0.100 335 ±0.019 4031)辛伐他汀组 0.018 746 ±0.002 7041)2) 0.040 554 ±0.003 7471)2) 0.060 146 ±0.001 060 41)2) 0.109 431 ±0.029 8381)2) 0.145 845 ±0.029 1661)2)
表3 Nestin的荧光强度表达±s,n=6,平均荧光强度)

表3 Nestin的荧光强度表达±s,n=6,平均荧光强度)
与同时间段假手术组比较:1)P<0.05;与同时间段模型组比较:2)P<0.05
组别 1 d 2 d 3 d 5 d 7 d正常组 0.003 888 ±0.000 998 0.003 114 ±0.000 374 3 0.003 114 ±0.000 374 0.003 114 ±0.000 374 0.003 114 ±0.000 374假手术组 0.003 822 3 ±0.000 986 0.003 823 ±0.000 986 0.003 563 ±0.000 857 0.003 546 ±0.000 857 0.002 999 ±0.001 548模型组 0.010 79±0.001 5211) 0.024 863 ±0.002 81) 0.041 324 ±0.001 4471) 0.063 386±0.001 641) 0.089 475 ±0.010 0011)辛伐他汀组 0.020 268±0.0008281)2) 0.042 096±0.002 061)2) 0.069 788 ±0.000 9241)2) 0.094 081 ±0.001 9771)2) 0.133 867 ±0.011 9321)2)
2.2 Western印迹结果比较 正常组、假手术组大鼠脑组织表达量都很弱,两组之间比较无显著性差异(P>0.05)。模型组与辛伐他汀组在缺血再灌注后1 d开始升高,在7 d达到高峰;辛伐他汀组与模型组在相同时间点比较,NGF、Nestin、GAP-43的表达量明显增强,差异有统计学意义(P<0.05)。见图4~图6。

图1 GAP-43激光共聚焦结果
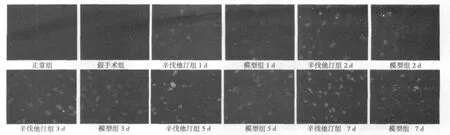
图2 NGF激光共聚焦结果
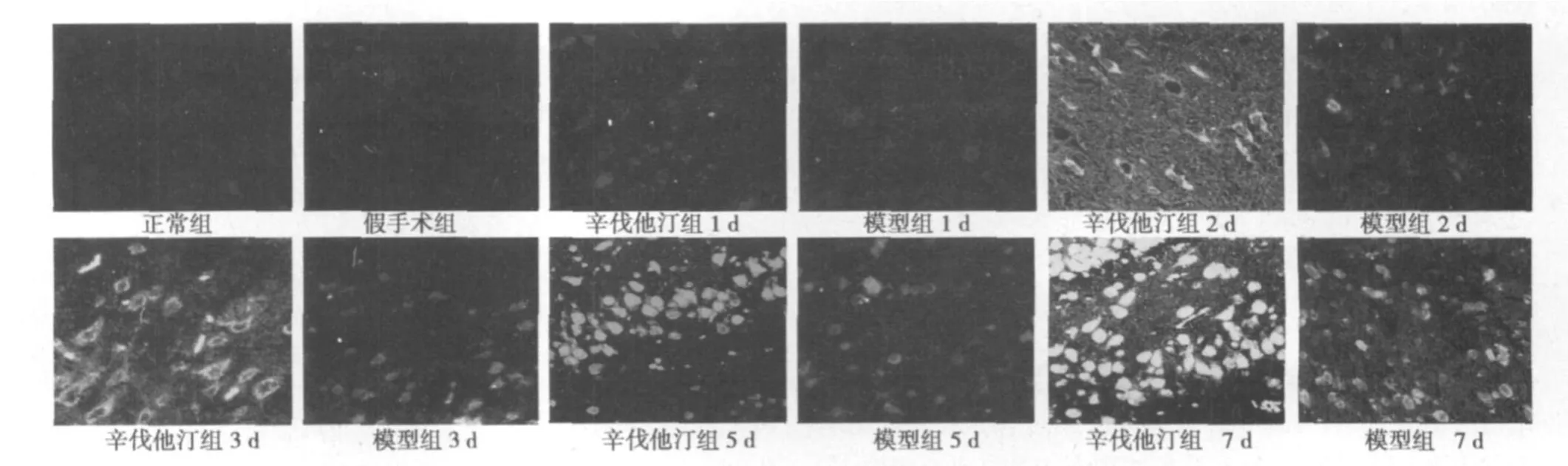
图3 Nestin共聚焦结果
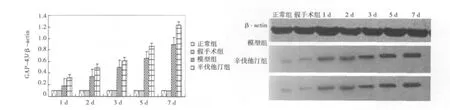
图4 各组GAP-43表达

图5 各组NGF表达

图6 各组Nestin表达
3 讨 论
近年来研究发现,脑缺血损伤可诱导内源性神经干细胞的增殖〔1〕,巢蛋白(Nestin)是神经干细胞特异表达的中间丝蛋白中的第Ⅵ类中间丝蛋白,作为神经干细胞的标记物,Nestin是一种独特的神经干细胞特异性抗原,在神经胚胎发育过程中不断增殖的神经上皮干细胞中短暂地表达,在正常成年动物脑中仅在室管膜下层、内皮细胞和脉络膜中有表达。研究表明,在脑损伤及脑缺血时Nestin在胶质细胞中迅速表达,是中枢神经系统早期损伤的标志物〔2〕。还有研究表明,Nestin被中枢神经系统和周围神经系统大多数增殖活跃的前体细胞所表达,发育成熟的神经系统Nestin表达降低,而损伤的神经系统Nestin表达又重新增高〔3〕。因此,探讨脑缺血损伤后Nestin的表达情况,有助于了解脑缺血后的神经修复机制
GAP-43是神经组织特异性磷酸蛋白,分布于神经元、再生的施万细胞和神经胶质细胞,被认为是神经元轴突生长发育和可塑性的分子标记物〔4,5〕。神经生长相关蛋白GAP-43可促进神经细胞生长、轴突再生和突触重构。神经损伤与再生时,轴突内GAP-43的含量可增加20~100倍〔6,7〕,为神经元轴突的修复和再生提供了足够的营养供给。
NGF是一组由多种细胞分泌的对神经组织起特殊营养作用的蛋白质或多肽分子,是神经营养因子家族成员之一。研究表明,NGF不仅具有中枢神经系统营养因子的作用,而且能促进受损神经元的再生,改善神经元的病理状态〔8〕,亦对缺血、缺氧后神经损伤具有重要的保护和修复作用〔9〕。
有报道认为他汀类药可能通过多种途径、多种机制保护缺血脑组织、挽救缺血半暗带〔10〕。本研究结果显示,缺血再灌注损伤后,NGF、GAP-43、Nestin表达均增加,说明损伤可诱导NGF、GAP-43、Nestin的合成;辛伐他汀可显著上调大鼠缺血脑组织中NGF、GAP-43、Nestin的表达,表明辛伐他汀可以通过上调NGF、GAP-43、Nestin的表达,减轻缺血损伤,从而起到神经保护作用。
1 Korzhevskii DE,Lentsman MV,Gilyarov AV,et al.Induction of nestin synthesis in rat brain cells by ischemic damage〔J〕.Neuro Sci Behav Physiol,2008;38(2):139-40.
2 Yagita Y,Kitagava K,Sasaki T,et al.Differential expression of Musashil and nestin in the adult rat hippocampus after ischemia〔J〕.J Neurosic Res,2002;69(6):750-6.
3 Pekny M,Johansson CB,Eliasson C,et al.Abnormal reaction to central nervous system injury in mice lacking glial fibrillay acidic protein and vimentin〔J〕.Cell Biol,1999;145(3):503-14.
4 Wang XY,Zhang JT.Effects of ginsenoside Rglonsynaptic plasticity of freely moving and its mechanism of action 〔J〕.Acta Pharmacol Sin,2001;22(7):1157-62.
5 Hassiotis M,Ashwell KW,Marotte LR,et al.GA P-43 Immunoreactivity in the brain of the developing and adult walla〔J〕.Anat Embr,2002;206(1-2):97-118.
6 Tolner EA,van Vliet EA,Holtmaat AJ,et al.GAP-43 mRNA and protein expression in the hippocampal and parahippocampal region during the course of epileptogenesis in rats 〔J〕.Eur J Neurosci,2003;17(11):2369-80.
7 Carrasco J,Penkowa M,Giralt M,et al.Role of metallothionein-III following central nervous system damage〔J〕.Neurobiol Dis,2003;13(1):22-36.
8 Snider WD,Johnson EM.Neurotrophic molecules〔J〕.Ann Neurol,1989;26:489-93.
9 Korsching S.The role of nerve growth factor in the CNS〔J〕.TiNS,1986;7:487.
10 谢 坤,李 勇.他汀类药物的多效性研究〔J〕.世界临床药物,2005;26(10):589-91.

