香菇多糖口服和注射给药对DTH小鼠耳后淋巴结和小肠派氏结中T淋巴细胞的影响①
江益平 徐晓飞 周 联 白莎莎 董 燕 (广州中医药大学免疫研究室,广州510405)
香菇多糖是临床常用的肿瘤辅助治疗用药,研究表明香菇多糖是有效的T细胞激活剂,能有效地活化T细胞,诱导IL-2的分泌,激活NK细胞,增强肿瘤患者TH细胞和TC细胞的功能,使机体通过免疫功能有效地抑制肿瘤的生长和转移[1,2]。
DTH是依赖T细胞的细胞免疫反应,其主要特征是致敏机体在抗原攻击部位出现迟发型炎症反应,参与此免疫应答的细胞主要是CD4+Th1细胞,也称作为TD细胞。传统的DTH实验是DNFB半抗原的背部或腹部致敏,耳廓攻击,通过耳肿胀程度从而反映机体T细胞免疫应答水平的高低。本实验在对比耳肿胀度的基础上,着重观察参与DTH反应的主要淋巴结——右耳后淋巴结(Retroauricular lymph nodes,RLN)以及小肠派氏结(Peyer's patch,PP)中T淋巴细胞比例和活化情况,对比口服和腹腔注射香菇多糖对小鼠两处淋巴结中T细胞的变化,探讨肠道粘膜免疫在机体整体免疫中的重要作用。
1 材料与方法
1.1 动物 NIH 小鼠,雄性,6~8周龄,体重18~22克,由广东省医学实验动物中心提供,动物许可证号:SCXK(粤)2006-0015。
1.2 药物、试剂和主要仪器 香菇多糖喷干粉由无限极(中国)有限公司提供,硫酸-苯酚法结合3,5-二硝基水杨酸比色定糖法检测多糖含量为52%[3];环磷酰胺(Cyclophosp homide,CY),江苏恒瑞医药股份有限公司,批号H32020875;2,4-二硝基氟苯(DNFB)为日本东京化成工业株式会社产品;PE-Cy7-anti-mouse CD3,FITC-anti-mouse B220、PE-anti-mouse CD25和FITC-antimouse CD69为eBioscience产品;其它试剂均为进口分析纯或国产分析纯试剂;电子分析天平,德国Sartorius产品,d=0.1 mg;台式冷冻高速离心机,美国Beckman产品;流式细胞仪,美国BD公司产品。
1.4 实验方法
1.4.1 动物分组、造膜与给药 28只NIH小鼠按体重随机分成4组,正常组(7只),模型组(7只),香菇多糖灌胃组(7只),香菇多糖注射组(7只)。正常组和模型组灌胃纯水0.2 ml/(10 g◦d),香菇多糖灌胃组灌胃香菇多糖800 mg/(kg◦d),香菇多糖注射组腹腔注射香菇多糖800(mg/kg◦d)。在给药的第二天,各组小鼠的背部脱毛剂脱毛1 cm×1 cm,脱毛后的第二天,脱毛区用5%DNFB丙酮20μl涂抹致敏小鼠。给药的第四天,正常组腹腔注射生理盐水0.2 ml/10 g,其余各组均注射环磷酰胺85 mg/kg。给药的第七天,各组小鼠的右耳用1%DNFB进行攻击,左耳用丙酮做对照。
1.4.2 耳片的制备 攻击后30小时,各组小鼠脱颈椎处死,剪下左右耳廓,以耳廓中心位置打出直径8.5 mm的圆形耳片。电子分析天平称取左右耳片质量,并以“右耳质量(mg)-左耳质量(mg)”计算各组小鼠耳肿胀度。
1.4.3 淋巴细胞的分离 取出各组小鼠的右耳后淋巴结和小肠派氏结,分别置于盛有冷PBS的无菌培养皿中。用注射器针芯在120目筛网上挤压淋巴结,PBS冲洗筛网后收集培养皿中的细胞悬液。冷PBS洗涤细胞两次1 000 r/min,4℃,10分钟离心后,细胞计数,将细胞浓度调整至1×107ml-1。
1.4.4 流式细胞术检测 从上述制备的淋巴细胞悬液中各取出100μl置于两套流式管中,其中一套加入 PE-Cy7-anti-mouse CD3 0.25μg和FITC-antimouse B220 0.5μg;另外一套加入PE-Cy7-anti-mouse CD3 0.25μg,PE-anti-mouse CD25 0.25μg和FITC-antimouse CD69 0.5μg三种流式抗体,混匀后室温避光孵育20分钟。冷PBS洗涤细胞两次1 000 r/min,4℃,10分钟离心后,400μl PBS重悬细胞后,上机检测。
2 结果
2.1 口服和注射香菇多糖对环磷酰胺免疫抑制小鼠DTH实验的影响 环磷酰胺能够有效抑制小鼠的DTH反应,模型组与正常组比较,差异有显著性意义,P<0.05;口服或注射香菇多糖后,小鼠DTH反应能力均有增强,其中口服组的作用更明显,与模型组比较,差异有显著性意义,P<0.05(图1)。
2.2 口服和注射香菇多糖对环磷酰胺免疫抑制的DTH小鼠RLN和PP中T、B淋巴细胞比例的影响腹腔注射环磷酰胺后,DTH小鼠RLN和PP中CD3+细胞的比例明显升高,模型组与正常组比较,差异均有显著性意义,P<0.05。注射或口服香菇多糖后,小鼠的耳后淋巴结中的T细胞比例仍会升高,口服组的比例略高于注射组,但与模型组比较,差异均没有显著性意义。注射或口服香菇多糖后,小鼠小肠派氏结中的T细胞比例均有所下降,其中口服组与模型组比较,差异有显著性意义,P<0.05(图2)。

图1 香菇多糖对免疫抑制小鼠DTH实验的影响(±s,n=7)Fig.1 Effect of lentinan on DTH of immune suppressive mice(±s,n=7)
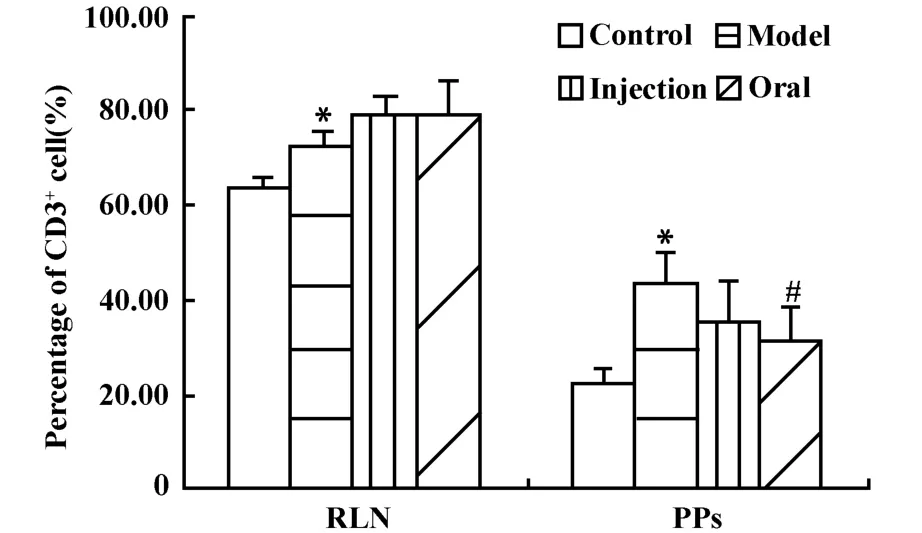
图2 香菇多糖对DTH小鼠耳后淋巴结和派氏结中CD3+细胞比例的影响(±s,n=7)Fig.2 Effect of lentinan on percentage of CD3+cells in RLN and PPs of DTH mice(±s,n=7)
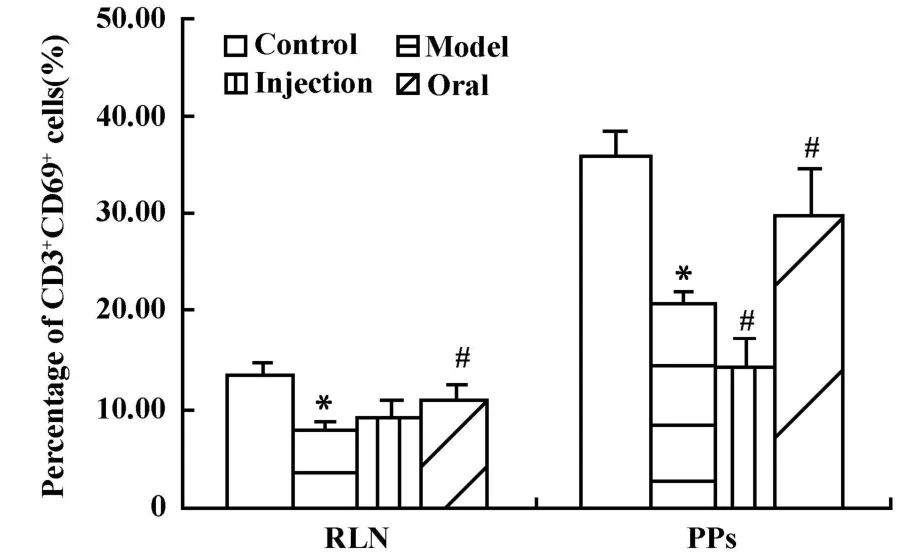
图3 香菇多糖对DTH小鼠耳后淋巴结和派氏结中CD3+CD69+细胞比例的影响(±s,n=7)Fig.3 Effect of lentinan on percentage of CD3+CD69+cellsin RLN and PPs of DTH mice( ±s,n=7)
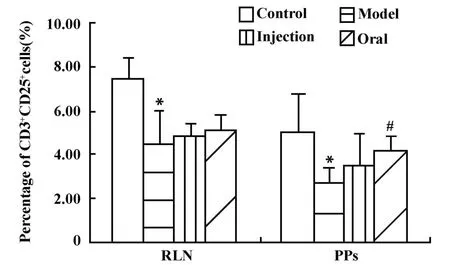
图4 香菇多糖对DTH小鼠耳后淋巴结和派氏结中CD3+CD25+细胞比例的影响(±s,n=7)Fig.4 Effect of lentinan on percentage of CD3+CD25+cellsin RLN and PPs of DTH mice( ±s,n=7)
2.3 口服和注射香菇多糖对环磷酰胺免疫抑制的DTH小鼠耳后淋巴结和小肠派氏结中T淋巴细胞活化的影响 腹腔注射环磷酰胺后,DTH小鼠耳后淋巴结和小肠派氏结中T细胞活化比例明显下降,与正常组比较,差异均有显著性意义,P<0.05。口服或注射香菇多糖后,耳后淋巴结中的CD3+CD69+细胞的比例均有升高,其中口服组与模型组比较,差异有显著性意义,P<0.05。针对派氏结,口服香菇多糖使其中CD3+CD69+细胞的比例明显升高而趋于正常,与模型组比较,差异有显著性意义,P<0.05;但在注射组,其中CD3+CD69+细胞的比例持续下降,与模型组比较,差异有显著性意义,P<0.05;口服和注射香菇多糖后,两处淋巴结中CD3+CD25+细胞的比例均有升高,其中口服组的派氏结处变化与模型组比较,差异有显著性意义,P<0.05(图 3、4)。
3 讨论
腹腔注射环磷酰胺可以杀伤体内的免疫细胞,有效抑制机体的细胞免疫和体液免疫,但是不同的淋巴细胞对环磷酰胺的敏感性不同,有研究表明腹腔注射环磷酰胺后,B淋巴细胞数量的下降明显,从而造成T淋巴细胞比例的相对升高[4,5]。本实验中,腹腔注射85 mg/kg环磷酰胺可以明显抑制小鼠的DTH反应,升高耳后淋巴结和小肠派氏结中T细胞的比例,降低其活化水平,有效抑制系统免疫和肠道粘膜免疫。
派氏结是存在于哺乳动物小肠段的集合淋巴小结,属于肠道粘膜免疫系统的免疫诱导部位,常沿肠系膜对侧分布。派氏结中含有丰富的胸腺源性T细胞和B细胞,T、B细胞在此经过诱导后,分化、成熟,并通过粘附分子、趋化因子和受体介导的淋巴细胞移行和归巢机制到达粘膜效应部位,发挥免疫效应功能[6]。肠道粘膜免疫系统拥有粘膜特有的免疫方式和相对独立的免疫体系,维持着肠道粘膜局部免疫环境的平衡。而作为机体系统免疫的重要组成部分,肠道粘膜免疫系统同样可以通过淋巴细胞的归巢机制影响到机体整体免疫。
香菇多糖最先是由日本学者从香菇子实体中提取出的一种真菌多糖,这类多糖被认为具有明显的抗肿瘤的生物学活性[7]。研究表明,香菇多糖的主要活性结构β-D-葡聚糖可以结合到淋巴细胞表面,活化靶细胞,诱导 IL-1、IL-2、IFN-γ等细胞因子的分泌,从而增强机体的免疫功能[8]。在本实验中,与环磷酰胺免疫抑制模型比较,香菇多糖能够增强免疫抑制小鼠的DTH反应,降低DTH小鼠肠道派氏结、右耳后淋巴结中T细胞比例,提高其活化水平,提示香菇多糖增强了T细胞对外界抗原刺激敏感性,促进T细胞的活化,正向调节机体的细胞免疫功能。
通过观察口服给药和注射给药的对比研究发现,无论是肠道派氏结T细胞比例、活化或是右耳后淋巴结T细胞的活化和小鼠DTH反应,口服给药组的效果都明显优于腹腔注射组,且在本实验的给药周期内,派氏结中T细胞比例和活化情况都强于耳后淋巴结。在刘良、周华等对四君子复方总多糖的免疫调节作用的研究中也发现,无论是系统免疫或肠粘膜局部免疫,口服给药的作用效果都明显优于腹腔注射,这些都提示肠道粘膜免疫系统可能在多糖发挥免疫药效中的重要作用[9,10]。但是,由于多糖这类极性大的大分子物质,在进入肠道后,很难以完整结构吸收入血发挥免疫药理作用[11]。因此,我们认为进肠道的香菇多糖很可能直接接触到肠上皮间的淋巴细胞或通过借助肠道的M细胞和DC接触肠上皮下的免疫细胞,促进局部免疫细胞的活化,调整肠道粘膜免疫系统的免疫状态,在维持肠道局部免疫环境稳定的情况下也可以通过淋巴细胞归巢等机制影响到系统免疫状态。
粘膜免疫的作用方式和功能不同于细胞免疫和体液免疫,它具有自身独特的优势,因此而成为一种理想的免疫途径。肠道粘膜面积巨大,每时每刻接触大量抗原,它是机体抗感染的第一道防线,也是机体感染的主要部位之一,肩负着重要的免疫功能。微生物学与传染病学家Montagne曾经说过“肠道内壁是人体最大的免疫器官”,由此可以看出肠道粘膜免疫系统在人体免疫系统中占据着重要地位。鉴于中药多糖的低吸收率和肠道粘膜免疫与系统免疫之间的联系,肠道粘膜免疫系统很可能是口服香菇多糖发挥免疫调节作用的重要靶点,药物在影响肠道粘膜免疫系统的基础上,再通过淋巴细胞归巢、细胞因子交流等机制进一步影响系统免疫功能。
1 郭 焱,郭 巍,顾红樱.香菇多糖对小鼠免疫功能调节的影响[J].微生物学杂志,2002;22(4):64-64.
2 余飞龙,项建霞.香菇多糖联合化疗治疗恶性肿瘤42例[J].肿瘤学杂志,2001;7(2):119-120.
3 肖建辉.江西虫草多糖含量的快速检测方法研究[J].中药材,2008;31(5):689-692.
4 刘继彦,李永强,彭瑞清 etal.环磷酰胺单次注射对小鼠淋巴细胞及其亚群的早期作用[J].中国肿瘤生物治疗杂志,2005;12(3):179-183.
5 杨 瑛,王 青,周 联.小鼠 PP、MLN、和 ILN 中 CD3+、CD19+细胞组成差异及四君子汤总多糖对其影响[J].现代免疫学杂志,2008;28(5):390-393.
6 范 骏.肠道黏膜免疫[J].国际免疫学杂志,2006;29(2):111-115.
7 Chihara G,Hamuro J,Maeda Y et al.Fractionation and purification of the polysaccharides with marked antitumor activity,especially lentinan,from Lentinus edodes(Berk.)Sing.(an Edible Mushroom)[J].Cancer Res,1970;30(11):2776-2881.
8 Bisen PS,Baghel RK,Sanodiya B S et al.Lentinus edodes:amacrofunguswith pharmacological activities[J].Curr Med Chem,2010;17(22):2419-2430.
9 刘 良,周 华,王培训.四君子汤复方总多糖对小鼠肠道粘膜相关淋巴组织的影响[J].中国免疫学杂志,2000;17(4):204-206.
10 周 华,刘 良,王培训.四君子汤复方总多糖口服和注射给药对免疫功能影响的对比研究[J].中药新药与临床药理,2001;12(3):206-209.
11 高其品,陈慧群,王 坤.银耳多糖在大鼠体内的吸收、分布和排除[J].中国药学杂志,2002;37(3):205-208.

