抗人CD28激发性单抗对T细胞淋巴瘤的抑制作用研究①
胡玲玲 陈昌友 张益红 郭静雅 陆海波 旬神美 邱玉华
(南京医科大学第二附属医院检验科,南京210011)
CD28分子是表达在T细胞表面的重要共刺激分子,是由两条44 kD多肽链以二硫键连接而成的同源二聚体,为Ⅰ型跨膜糖蛋白,属于免疫球蛋白超家族(IgSF)成员。CD28分子与B7-1或B7-2结合可为T细胞活化和增殖提供共刺激信号,从而引发免疫应答[1]。鼠抗人CD28单克隆抗体2F5与T细胞表面CD28分子交联形成多聚化后,产生类似于天然配基B7分子的作用,可促进T细胞活化、增殖与分化,从而介导免疫效应[2]。近年来,利用抗CD28单抗单独或联合抗CD3单抗或细胞因子IL-2等扩增肿瘤特异性T细胞(CTL)的研究正日益深入[3-5]。肿瘤患者外周血单个核细胞(PBMC)与抗CD28单抗共培养后,Foxp3+Treg的比例下调,提示该抗体能够使肿瘤患者的免疫功能得到一定程度的恢复与提高[6]。研究表明,抗CD28特异性单链抗体可活化肿瘤特异性T细胞,进而抑制肿瘤细胞的增长[7]。本研究在已成功研制了鼠抗人CD28单克隆抗体的基础上,观察2F5对人恶性T淋巴瘤细胞株Jurkat体外增殖的抑制效果;建立裸鼠T淋巴细胞瘤动物模型,探讨其对T淋巴瘤的体内抗肿瘤效应。
1 材料与方法
1.1 实验试剂、仪器、细胞株及动物 鼠抗人CD28抗体2F5由本室研制并保存;PE标记的羊抗鼠IgG(Fc;BD,美国);MTT(Sigma,美国);RPMI1640 基础培养基(Gibco,美国);CO2培养箱、离心机(Jouan,法国);倒置显微镜 (Olympus,日本);流式细胞仪(Beckman-Coulter,美国);550型酶标仪(Bio-rad,美国);人恶性 T淋巴瘤细胞株 Jurkat购自ATCC;BALB/c裸鼠(上海斯耐克动物中心,中国)。
1.2 鼠抗人CD28单抗 2F5对 Jurkat细胞膜型CD28分子的识别 收集生长良好的Jurkat细胞,用含1%BSA的PBS洗涤1次,调整细胞浓度至5×106ml-1,取100μl细胞悬液加到流式试管中,加入20μl 50mg/ml的鼠抗人CD28抗体混匀,4℃孵育40分钟。PBS充分洗涤,加入PE标记的羊抗鼠IgG二抗,4℃孵育40分钟,用含1%BSA的PBS洗涤2次,将细胞重悬于300μl PBS溶液中,流式细胞仪分析。采用小鼠同型IgG抗体做对照。
1.3 CD28单抗对Jurkat细胞体外增殖的抑制作用
收集生长状态良好的Jurkat细胞,调整细胞浓度至2.0×106ml-1,100μl/孔加至96孔板。加入100 μl抗 CD28单抗(终浓度为 5 μg/ml),37℃、5%CO2分别培养24、48、72及96小时后,每孔加入20μl浓度为5 g/L的MTT,继续培养4小时,离心弃上清后再加入100μl DMSO,震荡混匀10分钟,570 nm测定吸光度值。每组设置3个复孔,同时设置抗体同型对照和空白对照。抑制率=(同型对照组A值-实验组A值)/同型对照组A值×100%。
1.4 Jurkat细胞荷瘤裸鼠模型的建立 取6周龄、雌性、体重为20~25克的BALB/c裸鼠41只。随机选取35只接种1×107的Jurkat细胞于裸鼠左前肢腋下,接种当天为第1天,逐日观察并记录肿瘤形成时间、成瘤率、肿瘤大小及裸鼠生存状态等指标。当可以检测到肿瘤时,用游标卡尺测量肿瘤大小。肿瘤生长速度以成瘤潜伏期、荷瘤小鼠存活期和肿瘤结节大小来衡量。肿瘤结节体积:υ(mm3)≈(4/3π×长径×短径×高度)×1/8。剩余6 只未作任何处理,作为阴性对照,观察裸鼠的生存状态。
1.5 CD28单抗对Jurkat细胞荷瘤裸鼠的抑瘤作用
在无菌条件下,将抗CD28单抗稀释到1μg/μl。选取16只荷瘤裸鼠随机分成两组,试验组10只,阴性对照组6只,试验组做剪耳标记。首先用游标卡尺测量荷瘤的长、宽 、高,荷瘤体积:V=4π/3×长 ×宽×高≈1/2(长×宽×高),然后采用瘤内抗体多点注射方法,每mm3的瘤体注射1μg抗体。用药后逐日观察,每间隔7天测量裸鼠的肿瘤大小,并记录荷瘤裸鼠生长状态。
1.6 统计学分析方法 所有统计分析在SAS(Statistical Analysis System,SAS Institute Inc.,Cary,NC)统计软件中完成。服从正态分布的数值变量采用±s描述。在同一标本的重复测量中,采用均数估计进行点估计,并通过标准差反映仪器误差的大小。在分析抗CD28抗体对瘤体生长的影响时,采用多水平模型处理重复测量的数据,并考察组间效应及时间趋势。
2 结果
2.1 鼠抗人CD28单克隆抗体2F5对Jurkat细胞膜型CD28分子的识别 流式细胞仪分析结果表明,鼠抗人CD28单克隆抗体2F5可识别Jurkat细胞表面膜型CD28分子,阳型结合率可达93.37%,见图1。
2.2 抗CD28单抗体对Jakurt细胞体外增殖的抑制作用 抗CD28单抗与Jurkat细胞共培养后,显微镜下观察,48小时可见细胞有增殖现象,培养至96小时可见细胞胞质中出现黑色颗粒,细胞膜不完整或出现破裂,细胞的折光性和立体感减弱,呈现凋亡状态;而不加抗体组和同型对照组Jurkat细胞没有出现凋亡状态(图2)。MTT法分析结果显示,与同型对照组相比,抗CD28单抗对Jurkat细胞的增殖具有明显的抑制作用(图3)。
2.3 Jurkat细胞荷瘤裸鼠的成瘤率及荷瘤情况 裸鼠接种第30天时,有24只长出清晰可见的肿瘤,成瘤率可达到70%。裸鼠在肿瘤成长期生长良好,健康,活跃。图4为荷瘤裸鼠。
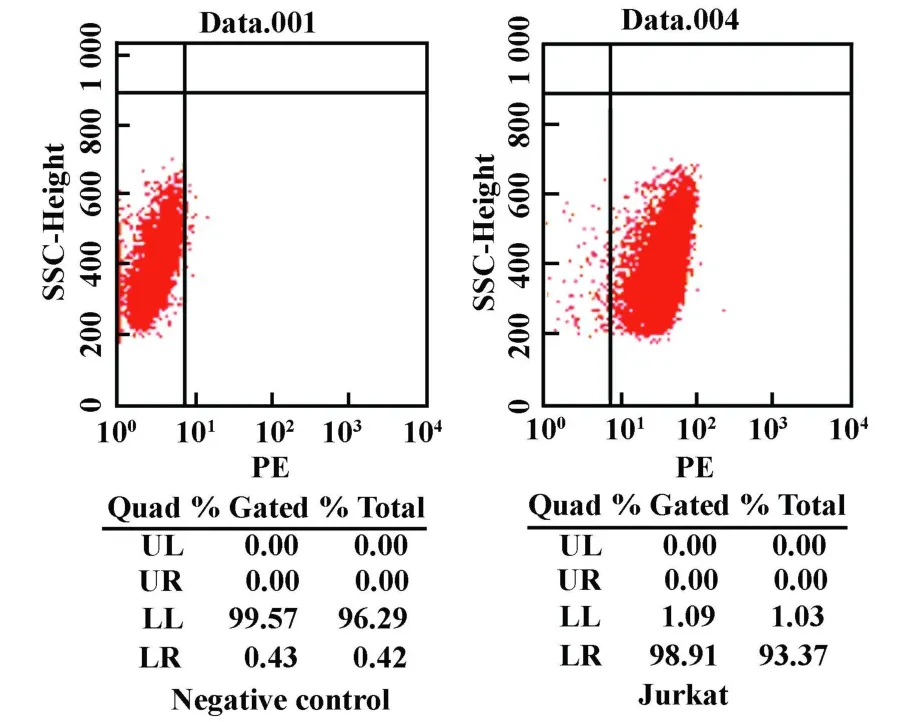
图1 抗CD28单抗对Jurkat细胞表面CD28分子的识别Fig.1 Recognition of CD28 Mab with surface molecule CD28 on Jurkat cell

图2 Jurkat细胞与小鼠2F5、小鼠IgG共培养以及空白对照组图(×400)Fig.2 Jurkat cells cultured with 2F5,mouse IgG,and blank control(×400)
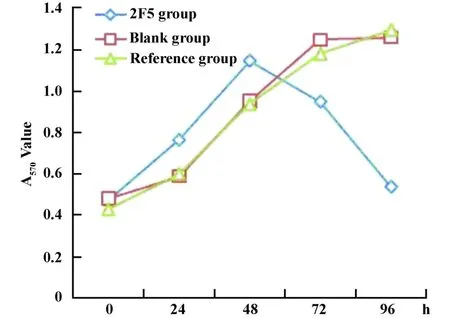
图3 2F5对Jurkat细胞体外增殖的抑制作用Fig.3 Inhibition effect of 2F5 on proliferation of Jurkat cell in vitro
图4 Jurkat细胞荷瘤裸鼠Fig.4 Naked mousebearing Jurkat tumor
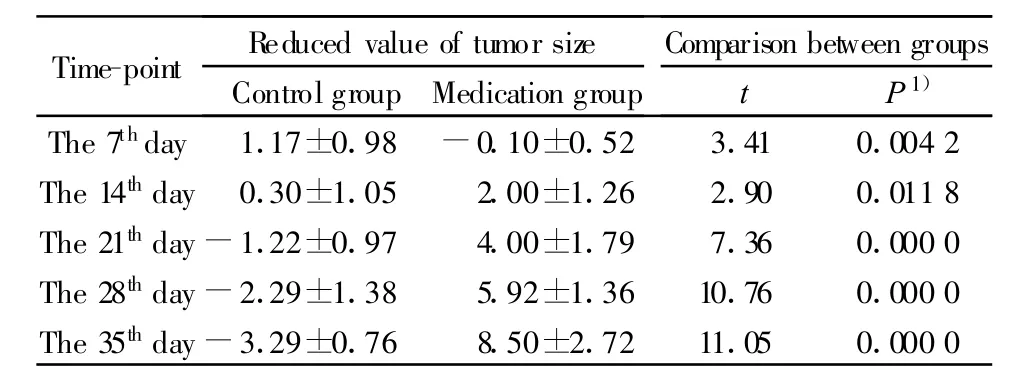
表1 各时间点的组间肿瘤大小变化比较Tab.1 Comparison of change on tumor sizes between groups at each time-point
2.4 鼠抗人CD28单抗对Jurkat细胞荷瘤裸鼠的治疗作用 CD28单抗经瘤内多点注射荷瘤裸鼠后,通过逐日观察荷瘤裸鼠肿瘤的生长状况,发现用药组荷瘤裸鼠肿瘤直至第35天都没有出现明显的增殖现象,而同型对照组和阴性组却出现了明显的增殖状况。采用多水平模型分析肿瘤大小的组间差异结果显示,组间基线肿瘤大小差异有统计学意义(z=19.89,P=0.000 0),调整基线肿瘤大小后,组间差异仍然有统计学意义(z=4.89,P=0.000 0)。对照组自第21天起肿瘤明显增大,而试验组自第14天起明显下降。对各时间点的肿瘤体积下降值进行组间比较,采用Bonferroni法调整检验效能的结果显示,自21天起,组间差异有统计学意义(P值皆为0.000 0)。见表1。
3 讨论
T细胞瘤表面高表达CD28分子,本研究在自主研制了抗CD28激发性单抗2F5的基础上,探讨单抗2F5与T淋巴瘤表面的CD28分子结合后,对T细胞瘤增殖的抑制作用。把T淋巴瘤细胞株Jurkat与单抗2F5共培养48小时可见细胞有增殖现象,培养至96小时,显微镜下可见胞质中出现黑色颗粒,胞膜破裂,细胞的折光性和立体感减弱。表明Jurkat细胞在与单抗2F5共培养的初期,可能由于单抗对细胞的激发作用,促进细胞的增殖,但随着培养时间的延长,对Jurkat细胞增殖具有明显的抑制作用。
将Jurkat细胞接种于裸鼠腋下,建立Jurkat细胞荷瘤裸鼠模型。共接种35只裸鼠,其中24只长出清晰可见的肿瘤,成瘤率可达到70%。部分裸鼠未成瘤的原因可能为肿瘤细胞注射完成时细胞在针眼口溢出,致使注射的细胞数目减少而没有生长肿瘤,还有一个原因可能为裸鼠具有一定的免疫能力。裸鼠在肿瘤成长期生长良好、健康、活跃。裸鼠长出了较大的肿瘤后,挑选10只经瘤内多点注射抗体,逐日观察肿瘤的大小和裸鼠的生存状态,并每间隔7天进行记录。选取6只裸鼠注射生理盐水作为阴性对照。经抗体注射后的裸鼠,与对照组相比,肿瘤并未出现明显的大小变化,因此认为,裸鼠瘤内局部注射单抗2F5,抑制了肿瘤的生长。另外,在刚刚注射抗体后对肿瘤有一定刺激作用,肿瘤略增大,随后肿瘤则被抗体抑制出现减小。这与体外实验结果相一致。而对照组老鼠肿瘤则出现较为明显的增长。我们推测,荷瘤裸鼠经CD28单抗2F5注射后,由于抗体对肿瘤细胞的抑制作用,因此肿瘤未出现明显的增长。另假设荷瘤小鼠无免疫缺陷,由于单抗2F5可促进T细胞活化、增殖与分化,从而激发机体对肿瘤的免疫应答,对肿瘤的生长应具有进一步的抑制作用。国外也有报道,通过使用干扰素刺激机体对T细胞瘤进行免疫应答,从而治疗皮肤T细胞淋巴瘤的案例[8]。
综上所述,我们认为鼠抗人CD28单克隆抗体2F5对Jurkat细胞的体内外增殖具有明显的抑制作用,可作为治疗T细胞淋巴瘤的一个潜在新型生物药物,为抗体介导的肿瘤靶向治疗提供新的方法和思路。我们将对抗CD28单克隆抗体2F5抑制T细胞淋巴瘤增殖的机制进行研究,为抗CD28单克隆抗体2F5进一步的临床应用提供理论依据。
1 Andaloussi A,Lesniak M S.CD4+CD25+Foxp3+T-cell infiltration and home oxygenase-1 expression correlate with tumor grade in human gliomas[J].J Neurooncol,2007;83(2):145-152.
2 邱玉华,於葛华,陈永井 et al.激发型CD28单抗直接激发的细胞及其表型[J].上海免疫学杂志,2003;23(5):324-326.
3 Michael T,Gabriele H,ThomasH et al.CD28-induction of proliferation in resting T cells in vitro and vivowithout engagement of the T cell receptor:evidence for function distinct forms of CD28[J].Eur J Immunol,1997;27(1):239-247.
4 Chang A E,Aruga A,Cameron M J et al.Adoptive immunotherapy with vaccine-primed lymph node cells secondarily activation with anti-CD3 and interleukin-2[J].JClin Oncol,1997;15(2):796-807.
5 Li Q,Fueman SA,Bradford C R et al.Expanded tumor-reactive CD4+T cell responses to human cancers induced by secondarary anti-CD3/anti-CD28 activation[J].Clin Cancer Res,1999;5(2):461-469.
6 杜阳阳,沈丽琴,王艳茹 et al.激发性CD28单抗对肿瘤患者外周血FOXP3+Treg细胞的下调作用及意义[J].实用肿瘤学杂志,2009;23(2):113-117.
7 Otz T,Groe-Hovest L,Hofmann M et al.A bispecific single-chain antibody that mediates target cell-restricted,supra-agonistic CD28 stimulation and killing of lymphoma cell[J].Leukemia,2009;23(1):71-77.
8 Lansigan F,Foss F M.Current and emerging treatment strategies for cutaneous t-cell lymphoma[J].Drugs,2010;70(3):273-286.

