干扰STAT3的siRNA真核表达载体对人卵巢癌的侵袭转移性的相关研究
孙 静,邵淑丽
1.山西医科大学第二临床医学院,山西 太原 030001;2.山西省肿瘤医院妇科,山西 太原 030013
卵巢癌是妇科常见的恶性肿瘤之一,由于其早期症状不典型且较隐匿,较早就可发生转移和广泛播散,且目前仍缺乏早期有效的诊断技术,患者就诊时75%~85%皆已属临床晚期[1],因而死亡率极高。近年来研究发现,信号传导和转录激 活 因 子3(signal transducer and activater of transcription,STAT3)信号转导通路在肿瘤的发生和发展中起重要作用[2],特别是在促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、促进侵袭转移及免疫逃逸方面的作用尤为重要[3-4]。正常的卵巢细胞里无STAT3活化,而在多种卵巢癌细胞株中发现STAT3呈过度激活表达,本研究利用RNA干扰技术,构建siRNA(Small interference RNA)-STAT3来沉默STAT3癌基因的表达,从而了解STAT3对卵巢癌细胞体外侵袭与转移影响,为卵巢癌的基因治疗探索一条新的途径。
1 材料与方法
1.1 材料
pSilencer2.1-U6-neo质粒购自Ambion公司,各种酶为大连Takara生物公司产品,STAT3单克隆抗体购自北京中杉金桥生物技术有限公司,LipofectamineTM2000脂质体购自Invitrogen公司,Transwell小室购自美国Corning公司,Matrigel基质胶购自美国BD公司。
1.2 方法
1.2.1 细胞培养 人卵巢癌细胞株SKOV3细胞和人正常卵巢细胞均采用含10%FBS的RPMI1640细胞培养基,常规培养于5%CO2的37℃温箱中,每隔2 d更换细胞培养液,当细胞养至80%~90%融合时,用0.25%胰酶消化传代。
1.2.2 STAT3、siRNA转录模板的设计及合成[5]从GenBank中查找人STAT3基因的全长序列,根据siRNA的设计原则,设计STAT3特异寡核苷酸序列,在设计的寡核苷酸序列两端分别引入两个酶切位点,加入9个碱基对的茎环结构,3′末端加有转录终止序列TTTTT,以形成发夹状siRNA寡核苷酸链序列 :STAT3 正 义 链 5′-GATCCATCCAGAGTCACTGGAAGTT TCAAGAGAAGTTCCAGTGA CTCTGGATTTTTTTGTCGACA-3′, 反义链 5′-AGCTTGTCGACAAAAAAATCCAGAGTCCACTGG AAC TTCTCTTGAAAGTTCCAGTGACTCTGGATG-3′。同时建立无同源性序列的non-target siRNA为阴性对照,正义链5′-GATCCTTCTCCGAACGTCTCACGTTTCAAGAGAACGTGCACGT TCGGAGAATTTTTTGTCGACA-3′, 反义链 5′-AGCTTGTCGA CAAAAAATTCTCCGAACGTGTCACGTTCTCTTGAAACGTGA CACGTTCGGAGAAG-3′(由上海博亚公司合成)。
1.2.3 siRNA-STAT3表达载体的构建 将合成的引物退火缓冲液作用下退火,与经过BglⅡ、HindⅢ双酶切的质粒pSilencer2.1-U6-neo连接,热转化至大肠杆菌DH5α中,37℃过夜培养,碱裂解法快速抽提质粒。
1.2.4 细胞转染 将处于对数生长期的SKOV3细胞和人正常卵巢细胞经0.25%胰蛋白酶消化后制成细胞悬液,接种于24孔培养板,于37℃、5%CO2培养箱内培养,保证转染时细胞汇合达70%~80%;将LipofectamineTM2000用无血清培养液稀释,然后将稀释的siRNA-STAT3、空质粒与稀释的LipofectamineTM2000,轻轻混合均匀后放于 37℃、5%CO2培养箱内培养24 h后,吸去无血清培养液,加入含10%FBS的细胞培养基继续培养。
1.2.5 Western blot检测STAT3蛋白的表达 实验分成五组:正常卵巢细胞对照组、正常卵巢细胞siRNA-STAT3组、SKOV3细胞对照组、SKOV3细胞空质粒转染组及SKOV3细胞siRNA-STAT3组。提取各组细胞总蛋白,定量后用蛋白上样缓冲液调整浓度,取25 μg上样,进行SDS-PAGE电泳,将蛋白转移至硝酸纤维素膜上,常规封闭后,加入一抗4℃过夜,再加入用辣根过氧化物酶标记过的二抗37℃下孵育2 h,ECL显色。
1.2.6 Transwell侵袭小室及侵袭相关蛋白MMP-2的检测将SKOV3细胞对照组、SKOV3细胞空质粒转染组及SKOV3细胞siRNA-STAT3组细胞用含1%FBS的培养基配制成细胞悬液,调整细胞浓度为5×108个/L,取稀释好的Matrigel 25 μl加入Transwell小室底部膜的上室面,覆盖整个聚碳酯膜,放入37℃培养箱中孵育30 min,使Matrigel聚合成凝胶,取配制好的细胞悬液100 μl加入小室上室面,然后将24孔板下室加入600 μl含20%FBS的培养基于37℃、5%CO2培养箱内常规培养24 h后,取出小室上室,用PBS洗两遍,然后用湿棉签轻轻擦去凝胶和聚碳酯膜上的细胞,小心取出上室,用冰预冷的甲醇固定30 min后,行Giemsa染色。在高倍镜下(×200)随机选取10个不同视野的肿瘤细胞进行计数,取平均数。将三组细胞蛋白提取出后,按Western blot检测STAT3蛋白的表达的步骤检测侵袭相关蛋白MMP-2的表达水平。
1.3 统计学方法
采用SPSS 11.3统计软件进行分析,数据以均数±标准差()表示,两样本均数比较采用 t检验,以 P<0.05 为差异有统计学意义。
2 结果
2.1 Western blot检测转染细胞STAT3蛋白的表达
正常卵巢细胞对照组、正常卵巢细胞siRNA-STAT3组、SKOV3细胞对照组、SKOV3细胞空质粒转染组和SKOV3细胞siRNA-STAT3组的STAT3蛋白相对表达量分别为(0.33±0.19)、(0.33±0.06)、(0.83±0.14)、(0.82±0.18)、(0.35±0.18)。SKOV3细胞siRNA-STAT3组STAT3蛋白表达水平降低,差异有统计学意义(P<0.05)。见图 1。
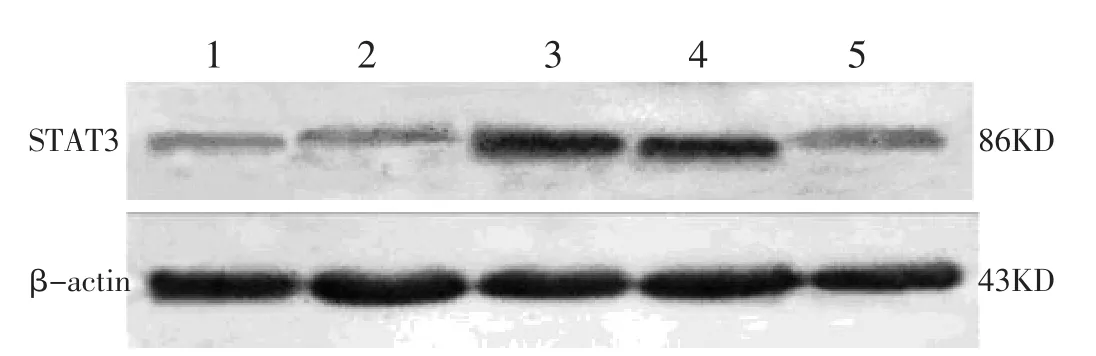
图1 siRNA-STAT3对各组细胞中STAT3蛋白表达水平的影响
2.2 siRNA-STAT3对卵巢癌细胞侵袭能力的影响
与SKOV3细胞对照组和SKOV3细胞空质粒转染组相比,SKOV3细胞siRNA-STAT3组穿过基底膜的细胞数显著减少(P<0.05)。而SKOV3细胞阴性对照组和SKOV3细胞阴性对照组穿过基底膜的细胞数无明显差别。见表1。
2.3 siRNA-STAT3对卵巢癌细胞中侵袭转移相关蛋白表达水平的影响
SKOV3细胞siRNA-STAT3组中MMP-2蛋白的表达水平降低,差异有高度统计学意义(P<0.01);而SKOV3细胞阴性对照组与SKOV3细胞对照组中MMP-2蛋白的表达无明显差异,差异无统计学意义(P>0.05)。见图2、表2。
表1 不同组穿过基底膜的卵巢癌细胞数()

表1 不同组穿过基底膜的卵巢癌细胞数()
SKOV3细胞对照组SKOV3细胞空质粒转染组SKOV3细胞siRNA-STAT3组组别 穿膜细胞数(个/200倍视野)67.2±5.71 68.9±4.27 32.5±6.10
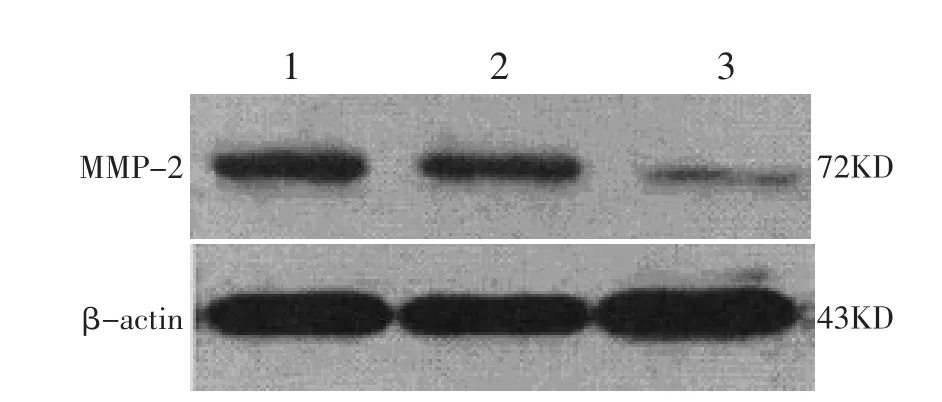
图2 siRNA-STAT3对卵巢癌细胞中MMP-2表达水平的影响
表2 不同组中MMP-2的表达量()
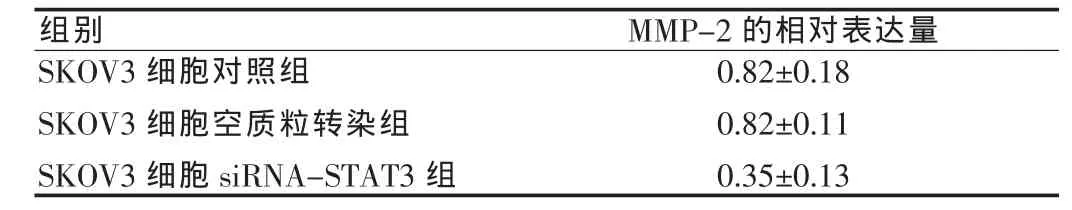
表2 不同组中MMP-2的表达量()
SKOV3细胞对照组SKOV3细胞空质粒转染组SKOV3细胞siRNA-STAT3组组别 MMP-2的相对表达量0.82±0.18 0.82±0.11 0.35±0.13
3 讨论
STAT3是近些年来发现的一种重要的核转录因子,是JAKs激酶-信号转导和转录活化因子(JAKs-STATs)转导途径中的一员,对肿瘤的发生发展起着重要作用。STAT3在人体正常组织中很少或没有活化,而在乳腺癌、头颈部鳞状细胞癌(SCCHN)、卵巢癌、前列腺癌、恶性黑色素瘤、宫颈癌、淋巴瘤、多发性骨髓癌和各种白血病等中存在持续激活的STAT3蛋白[6],已被归为癌基因。Briggs等[7]发现,STAT3可在血管内皮生长因子(VEGF)基因启动子区域由结合位点持续激活,诱导VEGF表达,导致肿瘤新生血管形成,进而参与肿瘤的发生和发展。此外,基质金属蛋白酶类(MMps)中MMP-2的基因启动子内部也存在有STAT3的高亲和力结合位点,STAT3活化后能直接调节MMP-2表达,MMP-2参与对细胞外基质和基底膜的降解,促使卵巢癌细胞发生浸润与转移[8]。
RNA干扰(RNAi)是近些年来发现、逐渐发展起来的一种新兴基因阻断技术,它是将靶基因所对应的小分子双链RNA(double-stranded RNA, dsRNA)导入有机体,通过降解细胞内同源mRNA来产生特异的基因沉默作用,进而阻断细胞中特定基因的表达[9]。Kunigal等人研究发现,应用RNAi技术沉默STAT3基因表达,能够抑制某些癌细胞增殖功能和诱导癌细胞发生凋亡[10-11]。
本实验利用RNA干扰技术,构建STAT3目的基因的发夹状siRNA表达载体,通过脂质体介导将siRNA-STAT3转染到卵巢癌SKOV3细胞中,使siRNA发挥沉默作用,抑制卵巢癌细胞中STAT3 mRNA的表达,阻断STAT3通路。同时,利用Transwell侵袭实验及对侵袭相关蛋白MMP-2表达水平的检测来判断其对卵巢癌细胞侵袭性与转移性的影响。实验结果表明:siRNA-STAT3组中STAT3蛋白表达水平降低、穿过人工基底膜的细胞数显著减少、侵袭相关蛋白MMP-2表达水平降低,表明干扰STAT3的表达能明显抑制卵巢癌SKOV3细胞的侵袭转移能力。在卵巢癌的治疗过程中,最关键的因素是控制肿瘤侵袭和转移。Vermeij等[12]在对52例浸润上皮性卵巢癌患者的检测发现,如果抑制STAT3的表达,可减少卵巢癌细胞的生长与侵袭转移发生。因此,STAT3有可能成为判断卵巢癌侵袭转移的一项重要指标,同时也为卵巢癌的基因治疗提供了新的途径。
[1]Puiffe ML,Le Page C,Filali Mouhlm A,et al.Characterization of ovarian cancer ascites on cell invasion,proliferation,spheroid formation,and gene expression in an in vitro model of epithelial ovarian cancer[J].Neoplasia,2007,9:820-829.
[2]Ren W,Duan Y,Yang Y,et al.Down-regulation of STAT3 induces apoptosis of human glioma cell:a potential method to treat brain cancer[J].Neurol Res,2008,30(3):297-301.
[3]张真发,马建群,孙楠,等.非小细胞肺癌中STAT3与MAPK的表达及临床意义[J].中国肿瘤临床,2004,31(20):1167-1170.
[4]Ma XT,Wang S,Ye YJ,et al.Constitutive activation of STAT3 signaling pathway in human colorectal carcinoma [J].World J Gastroenterol,2004,10(11):1569-1573.
[5]韩建秋,吴维光,葛红雨,等.RNAi沉默STAT3基因对人卵巢癌SKOV3细胞增殖和凋亡的影响[J].重庆医科大学学报,2010,35(10):1506-1509.
[6]Leong PL,Andrews GA,Johnson DE,et al.Targeted inhibition of STAT3 with a decoyoligonucleotide abrogates head and neck cancer cell growth[J].Proc Natl Acad Sci USA,2003,100:4138-4143.
[7]Xu Q,Briggs J,Park S,et al.Targeting STAT3 blocks both HIF-1 and VEGF expression induced by multiple oncogenic growth signaling pathways[J].Oncogene,2005,24(36):5552-5560.
[8]Huang W,Yu LF,Zhong J,et al.Stat3 is involved in angiotensin II-induced expression of MMP2 in gastric cancer cells [J].Dig Dis Sci,2009,54(10):2056-2062.
[9]Huang C,Li M,Chen C,et al.Small interfering RNA therapy in cancer:mechanism,potential targets,and clinical applications[J].Expert Opin Ther Targets,2008,12(5):637.
[10]Klosek SK,Nakashiro K,Hara S,et al.Stat3 as a molecular target in RNA interference-based treatment of oral squamous cell carcinoma[J].Oncol Rep,2008,20(4):873-878.
[11]Kunigal S,Lakka SS,Sodadasu PK,et al.Stat3-siRNA induces Fasmediated apoptosis in vitro and in vivo in breast cancer[J].Int J Oncol,2009,34(5):1209-1220.
[12]Vermeij J,Teugels E,Bourgain C,et al.Genomic activation of the EGFR and HER2-neu genes in a significant proportion of invasive epithelial ovarian cancers[J].BMC Cancer,2008,8:3.

