血管内皮生长因子受体表达水平与胃癌临床病理学特征的关系
杨 静 ,景在平
1.上海市第七人民医院外科,上海 200137;2.上海第二军医大学附属长征医院,上海 200003
胃癌在导致死亡的恶性肿瘤中目前位居第二位[1],在我国其发病率居常见恶性肿瘤的第四位[2]。众所周知,中晚期胃癌患者预后较差,所以如何提高胃癌的早期诊断率并寻找出新的治疗靶点,是当前胃癌研究的重要课题之一。
胃癌的发生与发展是多个步骤、不同阶段和复杂基因的一个改变过程。其中肿瘤血管是肿瘤生长、转移的重要环节之一。因为肿瘤的生长和转移依赖于肿瘤血管的生成,任何实体瘤生长超过2 mm3都必须有新生肿瘤血管支持[3]。到目前为止,血管内皮生长因子(Vascular Epidermal Growth Factor,VEGF)是已知的最强有力的血管生成因子,既能促进内皮细胞的增殖、促进血管渗漏,还可特异性诱导淋巴管的形成,在肿瘤的生长和转移中起着至关重要的作用。然而VEGF的作用需要其与受体(Vascular Epidermal Growth Factor Receptor,VEGFR)结合才能发挥生物学效应。其受体在肿瘤细胞的病理生理机制中起着重要的作用[4]。目前已知的VEGF受体主要有以下 3种:VEGFR1(fms-liketyrosinekinase1,Flt-1),VEGFR2含有激酶插入区的受体KDR(在鼠中的同源序列被称为 Flk-1,fetal liverkinase 1),VEGFR3 (F1t-4 和低分子量VEGFR)。那么VEGFR在胃癌分期和转移中起着什么样的作用呢?目前国内外关于这三种受体与胃癌的分期和转移的关系报道较少,而且研究结果也不尽一致。本研究采用免疫组织化学(Immunohistochemistry,IHC)技术,检测胃癌组织的VEGFR1、VEGFR2、VEGFR3 的表达,进一步探讨 VEGFR 与胃癌临床病理学特征关系,为胃癌的早期识别及新治疗靶点的研究提供理论依据。
1 资料与方法
1.1 研究对象
2008年9月~2010年9月在上海市第七人民医院普外科住院,临床病理资料完整的胃癌根治术后切除标本共53例。其中男38例,女15例,年龄50~75岁,病例无近期手术、创伤及其他恶性肿瘤等病史,无妊娠及严重心、肺、脑、肾、肝、血液系统等重大疾病。所有胃癌患者术前均未经过任何放疗、化疗及生物治疗。
根椐国际抗癌联盟 (UICC)制定的国际TNM分期法(2002年UICC第6版)标准进行临床分期,具体如下:
T:原发肿瘤。TX:原发肿瘤无法评估(包括资料不全、没有记录等);T0:无原发肿瘤的证据;Tis:原位癌,上皮内癌未浸润固有膜;T1:肿瘤浸润至固有膜或粘膜下层;T2:肿瘤浸润至肌层或浆膜下层;T2a:肿瘤侵及肌层;T2b:肿瘤侵及浆膜下层;T3:肿瘤穿透浆膜层,未侵及邻近结构,当肿瘤可能已经穿透肌层,并有胃结肠韧带、肝胃韧带或大小网膜侵犯,但没有穿透这些组织的脏层腹膜时,仍分在T2中,如肿瘤穿透这些脏器覆盖的脏层腹膜,则为T3;T4:肿瘤直接侵及邻近结构。胃的邻近结构包括:脾、横结肠、肝、膈肌、胰腺、腹壁、肾上腺、肾、小肠和后腹膜。肿瘤由胃壁延伸到十二指肠或食管,由包括胃在内的浸润最严重处的深度决定T。
N:局部区域淋巴结。NX:区域淋巴结无法评估;N0:无区域淋巴结转移;不论切除及检查的淋巴结总数,若所有的淋巴结都没有转移,定位pN0;N1:有1~6个区域淋巴结转移;N2:有7~15个区域淋巴结转移;N3:大于15个区域淋巴结转移。
M:远处转移。MX:无法评估远处转移;M0:未发现远处转移;M1:有远处转移(包括肝十二指肠韧带、胰腺后、肠系膜根部及腹主动脉旁的淋巴结受累)。
1.2 方法
免疫组织化学法测定肿瘤组织VEGFRs表达水平:术中切除原发灶后即刻取胃癌组织标本,以10%福尔马林固定36~48 h,常规石蜡包埋,4 pm厚连续切片,依次经二甲苯脱蜡、100%、95%、80%、70%梯度酒精复水。抗原修复采用玻片浸入柠檬酸缓冲液加热至99℃保持30 min,再室温自然冷却。3%过氧化氢浸泡5 min以去除内源性过氧化物酶活性。一抗(I型胶原,1∶40, 购自上海长岛),均以 1∶100 配成工作浓度,4℃孵育过夜。磷酸盐缓冲液 (phosphate-buffered saline,PBS)洗涤2次后用生物素标记的二抗(上海长岛)室温孵育30 min,再用链酶素辣根过氧化物酶孵育30 min,DAB(上海长岛)试剂盒显色。苏木精复染后封片。PBS代替一抗作为阴性对照,根据抗体说明书以大肠癌标本作为阳性对照。每张切片选取5个完整而不重叠的200倍视野,用Olympus BX51显微镜拍摄(日本),测定每个视野下阳性反应的平均光密度。图像分析采用Image-Pro Plus 6.0软件计算每张图片中阳性表达部分的平均光密度 (mean optical density,mean OD)。以每例5个视野的平均光密度的平均值作为该例的测量值(图1)。
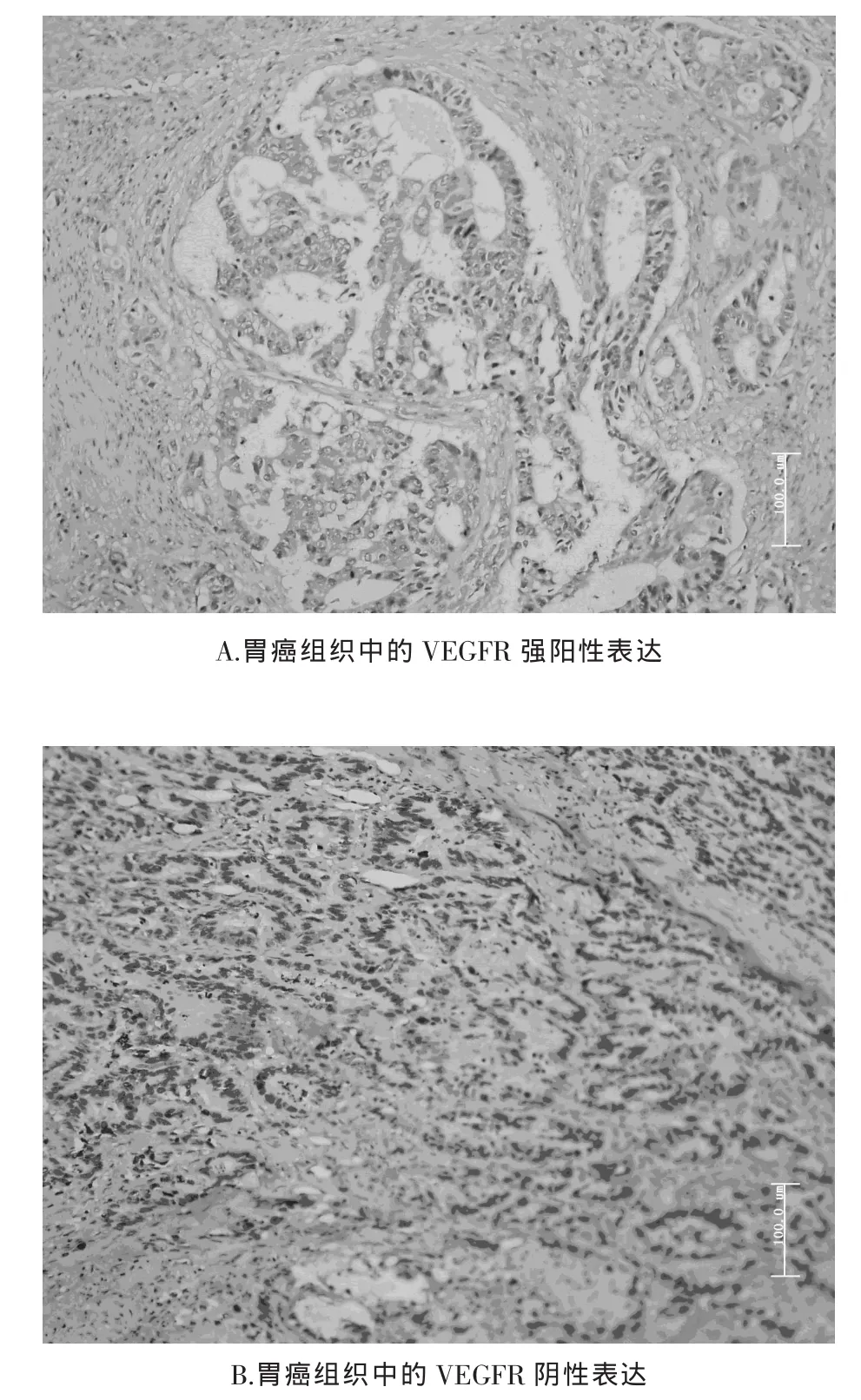
图1 胃癌组织中的血管内皮生长因子受体的表达(原始放大倍数×200倍)
1.3 统计学方法
所有数据均采用SPSS 17.0统计软件处理。统计方法包括描述性分析、独立样本t检验、χ2检验、方差分析。以α=0.05为检验水准。
2 结果
2.1 一般情况
共入组53例术后病理检查证实为腺癌的胃癌患者,所有病例术前均未行放疗或者化疗,其中男38例,女15例,年龄50~75岁,平均年龄65.3岁。按UICC(2002)TNM分期:Ⅰ期3例,Ⅱ期6例,Ⅲ期34例(其中ⅢA 16例,ⅢB 18例),Ⅳ期10例。根据常规HE染色病理检查结果显示,有淋巴结转移47例,无淋巴结转移6例。常规HE检查无淋巴结转移病例中重新检查出存在淋巴结微转移9例,无淋巴结微转移26例。
2.2 VEGFRs在不同胃癌组织中的表达
2.2.1 VEGFR1在胃癌组织中的表达 免疫组化结果发现VEGFR1在胃癌组织中平均光密度(OD值)为0.013。肿瘤浸润深度(T)不同分期依次为:T1 0.009、T2 0.016、T3 0.014、T4 0.013,差异无统计学意义(P>0.05)。局部区域淋巴结转移(N)不同分期依次为:N0 0.014、N1 0.016、N2 0.012、N3 0.013,差异无统计学意义(P>0.05)。见表 1。
2.2.2 VEGFR2在胃癌组织中的表达 免疫组化结果发现VEGFR2在胃癌组织中平均光密度(OD值)为0.025。肿瘤浸润深度(T)不同分期依次为:T1 0.013、T2 0.022、T3 0.026、T4 0.026,差异存在统计学意义(P<0.05)。局部区域淋巴结转移(N) 不 同 分 期 依 次 为 :N0 0.020、N1 0.023、N2 0.028、N3 0.027,差异存在统计学意义(P<0.05)。对于VEGFR2分别在不同肿瘤浸润深度(T)、局部区域淋巴结转移(N)之间方差分析两两比较结果发现:T1与T2、T3、T4差异均有统计学意义(P<0.05);而 T2、T3、T4 之间两两比较差异均无统计学意义(P>0.05)。N1 与 N2、N3、N4 差异均有统计学意义(P<0.05);N2与N3、N4差异均有统计学意义(P<0.05);N3与 N4差异无统计学意义(P>0.05)。见表 1。
2.2.3 VEGFR3在胃癌组织中的表达 免疫组化结果发现VEGFR3在胃癌组织中平均光密度(OD值)为0.018。肿瘤浸润深度(T)不同分期依次为:T1 0.004、T2,0.012、T3 0.019、T4 0.021,差异存在统计学意义(P<0.05)。局部区域淋巴结转移(N) 不 同 分 期 依 次 为 :N0 0.011、N1 0.015、N2 0.021、N3 0.025,差异存在统计学意义(P<0.05)。对于VEGFR3分别在不同肿瘤浸润深度(T)、局部区域淋巴结转移(N)之间方差分析两两比较结果发现:T1与T2、T3、T4差异均有统计学意义(P<0.05); T2 与 T3、T4 差异均有统计学意义(P<0.05);T3与T4差异有统计学意义(P<0.05);且OD值逐渐递增。N1与N2、N3、N4 差异均有统计学意义 (P<0.05);N2 与 N3、N4 差异均有统计学意义 (P<0.05);N3与N4差异有统计学意义(P<0.05);且 OD 值逐渐递增。见表 1。
表1 血管内皮生长因子受体在不同分期胃癌组织中平均光密度值的表达()
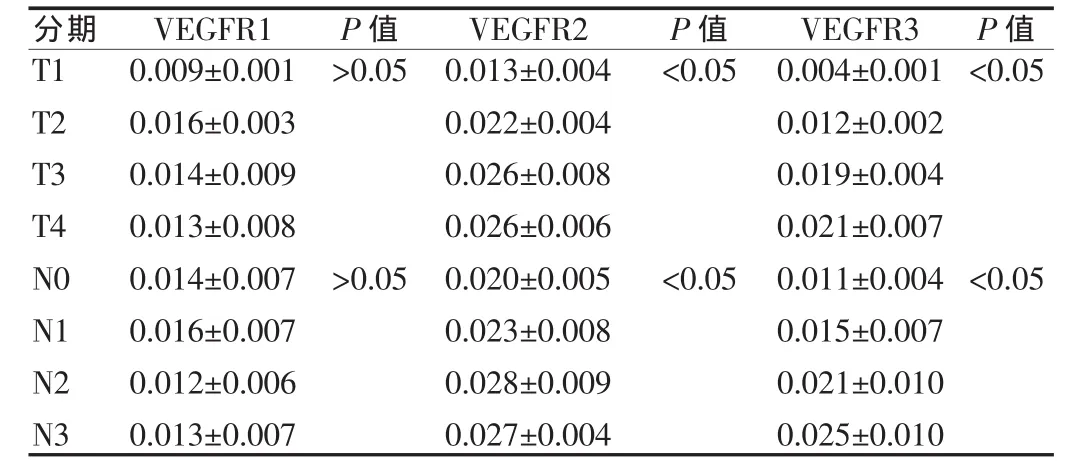
表1 血管内皮生长因子受体在不同分期胃癌组织中平均光密度值的表达()
注:T:原发肿瘤。T1:肿瘤浸润至固有膜或粘膜下层;T2:肿瘤浸润至肌层或浆膜下层;T3:肿瘤穿透浆膜层,未侵及邻近结构;T4:肿瘤直接侵及邻近结构。N:局部区域淋巴结。N0:无区域淋巴结转移;N1:有1~6个区域淋巴结转移;N2:有7~15个区域淋巴结转移;N3:大于15个区域淋巴结转移
P值P值T1 T2 T3 T4 N0 N1 N2 N3分期 VEGFR1 P值0.009±0.001 0.016±0.003 0.014±0.009 0.013±0.008 0.014±0.007 0.016±0.007 0.012±0.006 0.013±0.007>0.05<0.05<0.05>0.05 VEGFR2 0.013±0.004 0.022±0.004 0.026±0.008 0.026±0.006 0.020±0.005 0.023±0.008 0.028±0.009 0.027±0.004<0.05 VEGFR3 0.004±0.001 0.012±0.002 0.019±0.004 0.021±0.007 0.011±0.004 0.015±0.007 0.021±0.010 0.025±0.010<0.05
3 讨论
VEGFR属于酪氨酸激酶Ⅰ型受体家族,具有酪氨酸激酶活性,它的表达不仅仅局限在血管内皮细胞上,在肿瘤细胞表面也可以检测到VEGF受体。它与配基VEGF结合后可促进肿瘤细胞生长、诱导淋巴管的形成,在肿瘤的生长和转移中起着极为重要的作用。本研究通过免疫组化技术对胃癌组织中的VEGF的三种受体VEGFR1、VEGFR2及VEGFR3的表达进行测定,以期分析这三种受体与胃癌分期及病理的关系。
目前已经有VEGFR1在胃癌组织与正常组织之间差异表达的研究,而就其与胃癌的分期关系研究则鲜有报道。最近Mimori等[5]对810例胃癌患者骨髓和外周血采用实时相对定量PCR发现,胃癌的血行转移需要VEGFR1的表达参与,其在胃癌组织中的高表达有利于胃癌的血行转移;而通过本研究发现,VEGFR1在胃癌组织中的表达与肿瘤浸润深度及淋巴结转移不同之间均无相关性。本研究结果与Ding等[6]的研究结果在一定程度上吻合:研究显示VEGFR1的激动表达更倾向于血行转移,而与淋巴转移关系可能不大。
VEGFR2在血管内皮细胞及部分肿瘤细胞上特异性表达,对于肿瘤发生、发展更是起着重要的调节作用。VEGFR2基因敲除的小鼠不能产生分化良好的内皮细胞和血管。已经有不少研究表明VEGFR2在VEGF的信号转导及血管内皮生成上起主导作用。Brekken等[7]研究发现,用VEGF的单克隆抗体可以阻断VEGF诱发的血管通透性增加和VEGF与VEGFR2的相互作用,却不能阻断VEGF与VEGFR1的相互作用,因此明确了VEGFR2在调节VEGF诱发的血管通透性增加和肿瘤血管生成中起主要作用。其后,Zeng等[8]也得到了同样结论。这些研究提示VEGFR1和VEGFR2所引起的信号转导级联反应有所不同,VEGFR2有明显促有丝分裂和化学趋化活性,在血管遇透性升高和血管生成过程中起主要作用。所以有些学者认为VEGFR2在肿瘤组织中的表达水平与肿瘤患者预后关系更为密切,但对于这一点目前仍然存在较大的争议。如Deeaussin等[9]研究表明:VEGFR2的表达水平与癌组织中的血管生成水平呈正相关,与患者的生存期呈负相关。Harada等[10]认为VEGFR2可以作为结直肠癌患者的预测指标;而Delmotte等[11]进行的荟萃分析发现,VEGF可以作为预测患者的预后指标,但VEGFR2作为患者预后指标的证据不足。本研究结果显示VEGFR2在胃癌组织中的表达与肿瘤浸润深度及淋巴结转移有关。
已有研究显示,肿瘤新生淋巴管的生长主要是通过位于淋巴管内皮细胞上的VEGFR3调节来实现,肿瘤细胞分泌的VEGFC特异性地与其受体VEGFR3结合,从而使肿瘤周围的淋巴管胚芽向肿瘤组织内部生长[12]。对于VEGFR3和胃癌淋巴结转移的关系已有报道。如Choi等[13]研究显示VEGFR3与胃癌淋巴结转移密切相关,提示VEGFR3是胃癌淋巴结转移的潜在分子标志。Yonemura等[14]研究也发现胃癌中VEGFR3水平与阳性淋巴管数存在显著相关性[15]。另外,Juttner等[16]研究还发现VEGFR3不仅与胃癌的淋巴转移有关,而且还能预测胃癌患者的预后,是预后的一个生物学标记物。之前提到的Ding等[6]研究发现VEGFC高表达与淋巴结转移有关,而VEGFC的高表达又进一步结合和激动VEGFR3。本研究对于VEGFR3的研究结果与国内外研究基本一致,进一步证实了VEGFR3对于胃癌的演进和转移起着重要的作用。另外本研究除了发现VEGFR3在胃癌组织中的表达与患者的浸润深度、局部区域淋巴结转移相关外,还发现在胃癌组织中的表达量随着浸润深度、局部区域淋巴结转移数的增加而逐渐递增。提示VEGFR3在胃癌组织中的表达量可以作为疾病严重程度的一个量化指标,VEGFR3可以反映不同的浸润深度和淋巴结转移情况。
本研究通过使用免疫组化技术对VEGFR1、VEGFR2、VEGFR3在胃癌组织细胞中的表达与分期关系的研究发现:在不同肿瘤浸润深度及淋巴转移程度的胃癌组织中VEGFR1的表达差异无统计学意义(P>0.05),而VEGFR2的表达差异有统计学意义(P均<0.05),VEGFR3的表达差异也有统计学意义(P均<0.05),并且在胃癌组织中VEGFR3的表达量随着浸润深度、局部区域淋巴结转移数的增加而逐渐递增,这提示VEGFR3在胃癌组织中的表达量可以作为疾病严重程度的一个量化指标,VEGFR3可以反映不同的浸润深度和淋巴结转移情况。
总之,通过本研究发现,在不同肿瘤浸润深度及淋巴转移程度的胃癌组织中,VEGFR2的表达有差异性,VEGFR3的表达亦有差异性,且VEGFR3的表达随着浸润深度、局部区域淋巴结转移数的增加而递增,提示VEGFR3在胃癌组织中的表达量可以作为疾病严重程度的一个量化指标,为研究胃癌的治疗新靶点提供了进一步的理论依据。
[1]Shah MA,Schwartz GK.Treatment of metastatic esophagus and gastric cancer[J].Sere in Oncol,2004,31(4):574-587.
[2]Jemal A,Siegel R,Ward E,et al.Cancer statistics[J].CA Cancer J Clin 2006,56:106-130.
[3]Ounningham SP,Currie MJ,Han C,et al.The Short Form of the Alternatively.Spliced fit-4 but not Its Ligand Vascular Endothelial growth Factor C is Related to Lymph Node Metastasis in Human Breast Cancers[J].Clin Cancer Res,2000,60(6):4278-4286.
[4]McMahon G.VEGF receptor signaling in tumor angiogenesis[J].Oncologist,2000,5(Supp 11):3-10.
[5]Mimori K,Fukagawa T,Kosaka Y,et al.Hematogenous metastasis in gastric cancer requires isolated tumor cells and expression of vascular endothelial growth factor receptor-1[J].Clinical Cancer Research,2008,(14):2609-2616.
[6]Ding S,Li C,Lin S,et al.Distinct roles of VEGF-A and VEGF-C in tumour metastasis of gastric carcinoma[J].Oncol Rep,2007,17(2):369-375.
[7]Brekken RA,Overholser JP,Smstny VA,et al.Selective inhibition of vascular endothelial growth factor(VEGF)receptor-2(KDR/Flk-1)activity by a monoclonal anti-VEGF antibody blocks tumor growth in mice[J].Cancer Res,2000,60(18):5117-5124.
[8]Zeng H,Dvorak HF,Mukhopadhyay D.Vascular permeability factor(VPF)/vascular endothelial growth factor(VEGF)receptor-1 down-modulates VPF/VEGF receptor2 mediated endothelial cell proliferation,but not migration,through phosphatidylinositol 3-kinase-dependent pathways[J].J Biol Chem,2001,276(29):969-979.
[9]Decaussin M,Sartelet H,Robert C,et al.Expression of vascular endothelial growth factor(VEGF)and its two receptor(VEGFR-1/Fit-l and VEGFR-2 /Flk-1 /KDR)in non-small cell lung carcinomas(NSCLCs):correlation with angiogenesis and survival[J].J Pathol,1999,188:369-377.
[10]Harada Y,Ogata Y,Shirouzu K.Expression of vascular endothelial growth factor and its receptor KDR(kinase domain-containing receptor)/Flk-1(fetal liver kinase-1)as prognostic factors in human colorectal cancer[J].Int J Clin Oncol,2001,6(5):221-228.
[11]Delmotte P,Martin B,Paesmans M,et al.VEGF and survival of patients with lung cancer:a systematic literature review and meta-analysis[J].Rev Mal Respir,2002,(19):577-584.
[12]Achen MG,Roufail S,DomagalaT,et al.Monoclonal antibodies to vascular endothelial growth factor-D block its interactions with both VEGF receptor-2 and VEGF receptor-3[J].Eur J Biocbem,2000,267:2505-2515.
[13]Choi JH.Oh-Young H.Park YW.Correlation of Vascular Endothelial Growth Factor-D Expression and VEGFR-3-Positive Vessel Density with Lymph Node Metastasis in Gastric Carcinoma[J].J Korean Med Sci,2008,23(4):592-597.
[14]Yonemura Y,Endo Y,Fujita H,et al.Role of vascular endothelial growth factor C expression in the development of lymph node metastasis in gastric cancer[J].Clin Cancer Res,1999,(5):1823-1829.
[15]Yonemura Y,Fushida S,Bando E,et al.Lymph angiogenesis and the vascular endothelial growth factor receptor(VEGFR)-3 in gastric cancer[J].Eur J Cancer,2001,(37):918-923.
[16]Juttner S,Weismann C,Jons T,et al.Vascular endothelial growth factor-D and its receptor VEGF-3:two novel independent prognostic markers in gastric adenocarcinoma[J].Clin Oncol,2006,24:228-239.

