全肠外营养液临床配制稳定性的评价
郑 越
(中国人民解放军第309医院医务部,北京 100091)
全肠外营养制剂(total parenteral nutrition,TPN)是将机体所需的营养素按一定的比例和速度以静脉滴注方式直接输入体内的注射剂,临床上主要用于不能通过胃肠道摄取营养物质的危重患者。肠外营养制剂在为患者补充所需营养、促进伤口愈合、增加机体抵抗力等方面的临床治疗中都取得了显著效果,已成为医疗工作中不可缺少的治疗方法之一[1]。近几年来,临床配制的肠外营养液中大多使用混合糖电解质注射液替代葡萄糖注射液作为能量补充剂,以更好满足患者的营养需求。但TPN的组成成分复杂,混合糖电解质注射液除含有葡萄糖和果糖外还含有氯化钠、硫酸锌、柠檬酸等多种成分,这些药物成分的混合很可能会对TPN的稳定性造成影响。为了更加安全、有效、合理地使用TPN,本试验探讨了混合糖电解质注射液对全肠外营养液稳定性的影响,以供临床拟订TPN处方作参考。
1 仪器与试药
HS-1800-u型洁净工作台;静脉营养输液袋(山东威高集团医用高分子制品股份有限公司);PB-10型pH酸度计(赛多利斯科学仪器有限公司);SMC-30B型渗透压摩尔浓度测定仪(天河医疗仪器有限公司);IX51型倒置光学显微镜(OLYMPUS公司);DP71图像分析仪(OLYMPUS公司);7600型全自动生化分析仪(HITACHI公司)。8.5%复方氨基酸注射液18AA-Ⅱ(批号为80DA010),20% 中 /长链 (C8~24)脂肪乳注射液(批号为80DA062),注射用水溶性维生素(批号为80CK53302),脂溶性维生素注射液Ⅱ(批号为80CI55401),多种微量元素注射液Ⅱ(批号为80CM547),丙氨酰谷氨酰注射液(批号为80DA109),均为华瑞制药有限公司产品;混合糖电解质注射液(江苏正大丰海有限公司,批号为1001102);15%氯化钾注射液(北京益民药业有限公司,批号为20100130);10%葡萄糖注射液(批号为09120591),0.9%氯化钠注射液(批号为09061594),为浙江济民制药有限公司产品。
2 方法与结果
2.1 处方
参考日常配制的TPN液拟订两种处方,作为试验组和对照组,详见表1和表2。
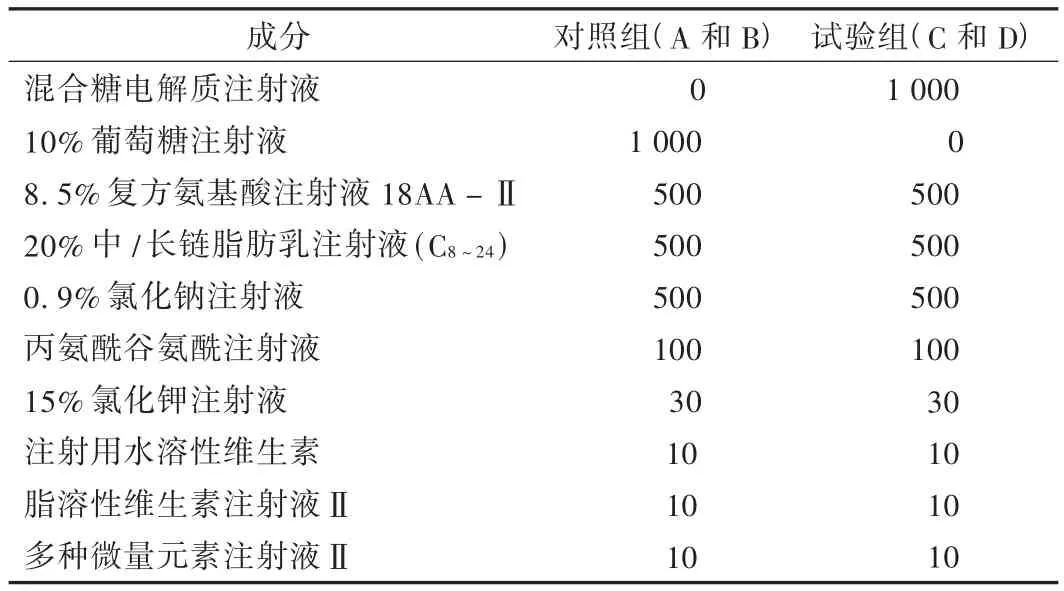
表1 全肠外营养液的组成(mL)
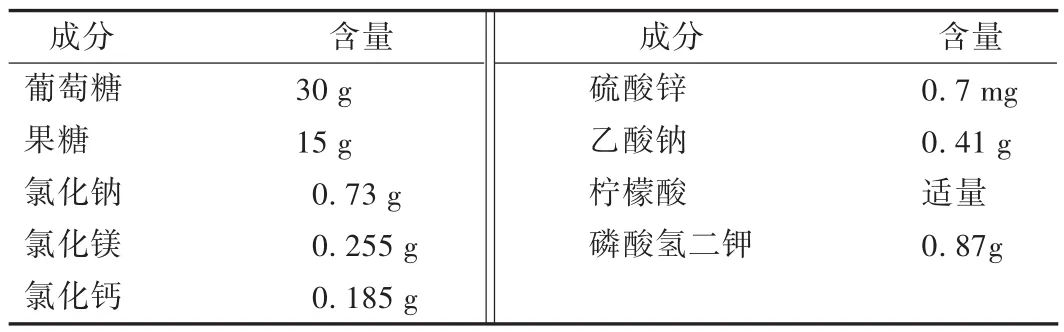
表2 混合糖电解质注射液的组成成分及其含量
2.2 配制方法
TPN由专业人员按照严格的无菌操作规程配制,各成分混合顺序如下[2]:将多种微量元素注射液Ⅱ加入8.5%复方氨基酸注射液18AA-Ⅱ中;将丙氨酰谷氨酰注射液与上述溶液混合;对照组将氯化钾注射液加入10%葡萄糖注射液中,试验组将氯化钾注射液加入到混合糖电解质注射液中;将8.5%复方氨基酸注射液18AA-Ⅱ分别与混合糖电解质注射液和葡萄糖注射液转入3 L静脉营养液输液袋中;用脂溶性维生素注射液Ⅱ溶解注射用水溶性维生素粉针后加入20%中/长链脂肪乳注射液(C8~24)中;用肉眼检查脂肪乳和维生素的混合液无沉淀和变色情况后再将其移入静脉营养液输液袋中;排气,轻轻摇动静脉营养液输液袋中的混合物,备用。
2.3 稳定性考察
2.3.1 外观性状
肉眼观察4组TPN液48 h内的外观,结果均为乳白色液体,无变色、分层、浑浊或沉淀产生。
2.3.2 pH
使用pH酸度计测定每组TPN液在0~48 h内的pH;结果见表3。可见对照组和试验组的pH在48 h内并没有发生明显变化,试验组的pH平均值为5.64,对照组为5.98。
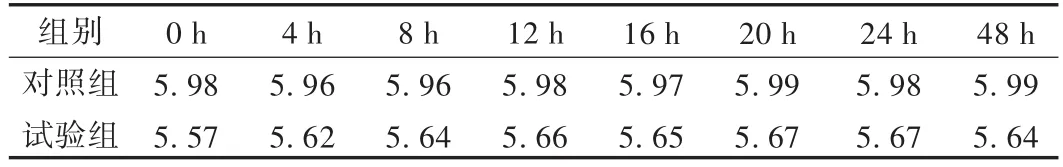
表3 两组pH变化情况
2.3.3 不溶性微粒数
按2005年版《中国药典(二部)》附录不溶性微粒检查法中的显微计数法[3],对配制的TPN液中不溶性微粒数进行测定,结果见表4。2005年版《中国药典(二部)》规定,采用显微计数法测定标示装量为100 mL或100 mL以上的静脉用注射液,每1 mL中含有10 μm以上的微粒不得过12粒,含25 μm以上的微粒不得过2粒。试验组10 μm 以上的微粒在4 h后达到24粒,已超出了规定,而且观察到的不溶性微粒呈不规则的黑色块体(图 1)。

图1 光学显微镜(10×10)下试验组4 h时观察到的不溶性微粒(μm)
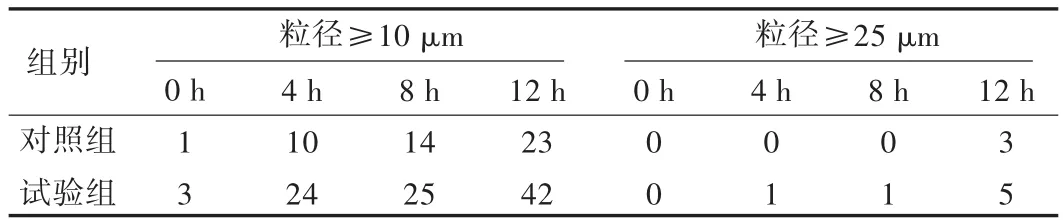
表4 两组TPN液不溶性微粒数平均值经时变化(粒/mL)
2.3.4 脂肪乳剂颗粒
用显微镜观察4组TPN液中脂肪乳颗粒的变化,并拍照记录,结果见图2。光学显微镜(10×60)下脂肪乳颗粒经时变化情况显示,试验组脂肪颗粒变化比对照组更明显。刚配制的试验组和对照组的TPN中脂肪乳颗粒大小均匀且粒径较小,其直径随放置时间的延长明显增大。对照组TPN中的脂肪颗粒在24 h内相对稳定,经时变化不明显,12 h后绝大部分粒径在5 μm以下。试验组在4 h以后脂肪颗粒明显增大且不均匀,其中8 h则观察到脂肪颗粒聚集增大的现象;12 h后可见大量粒径10 μm以上的脂肪颗粒甚至有粒径20 μm以上脂肪颗粒出现;24 h可见脂肪粒破裂成小粒径颗粒。

图2 两组脂肪乳剂颗粒经时变化显微图(10×60)
2.3.5 渗透压
使用渗透压摩尔浓度测定仪测定样品溶液的渗透压值,结果见图3。成人TPN液中心静脉输注总渗透压应小于1200 mOsm/L(3096kPa),外周静脉输注总渗透压应小于900mOsm/L(2322kPa)[4]。试验组的渗透压值高出对照组约100 mOsm/L,平均渗透压为637.1 mOsm/L,而对照组平均渗透压为 549.6 mOsm/L。
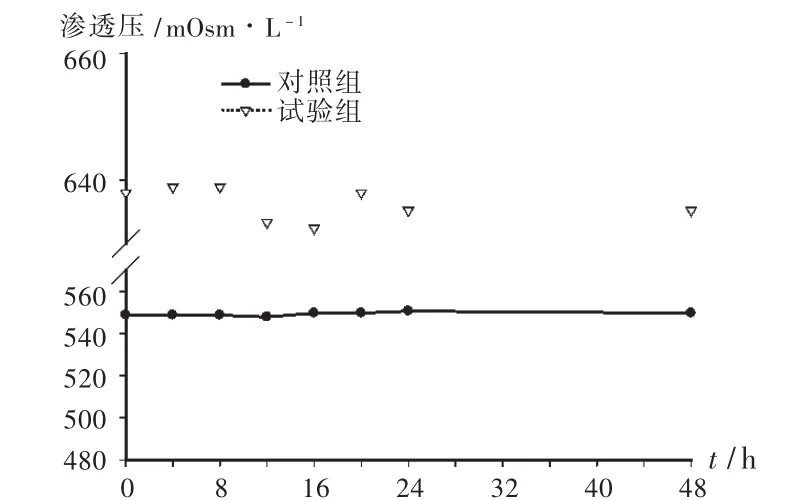
图3 两组TPN液渗透压经时变化曲线
2.3.6 电解质含量
使用全自动生化分析仪测定TPN液中的电解质,结果见表5。试验组TPN液的各种电解质含量明显高于对照组,尤其是Mg2+,Ca2+,P3+含量均相差4倍以上。
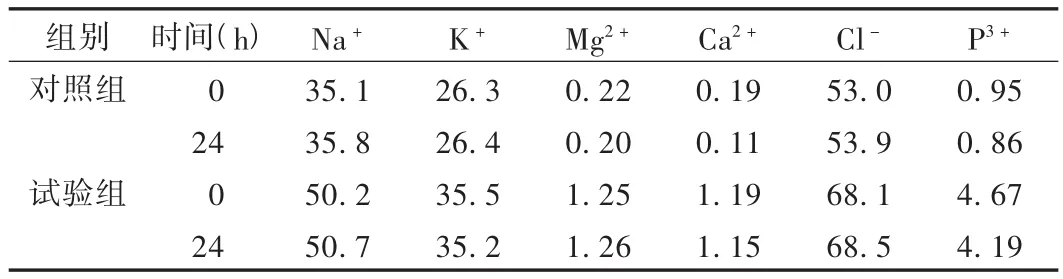
表5 两组TPN液放置24 h前后的电解质含量(mmol/L)
3 讨论
不溶性微粒对人体的危害已成共识。2005年版《中国药典(二部)》记录的不溶性微粒检查法包括光阻法和显微计数法。与显微计数法相比,光阻法具有速度快、灵敏度高、人为因素小的特点,但干扰因素多且测定的小微粒数值准确度不高。有人将肠外营养液稀释后用微粒分析仪(采用光阻法)测定其不溶微粒[5-6]。但本试验过程中,经方法比较后发现光阻法不适合于乳液的测量,故采用显微计数法。TPN液的不溶性微粒随放置时间延长而增多[7],本试验结果与此一致,特别是粒径10 μm以上的微粒试验组在4 h已达24粒/mL,已超过药典规定值。
渗透压也是考察肠外营养液稳定性的指标之一。机体如果输入过低渗透压的溶液,水分子会进入细胞内,严重时可发生溶血;如果输入过高渗透压的溶液,细胞内的水分子将会逸出导致细胞皱缩。由于混合糖电解质中有较多的电解质成分,试验组的渗透压略大于对照组,但仍符合对静脉营养液渗透压的安全要求。
脂肪乳剂是影响肠外营养液稳定性的关键因素。乳剂属于热力学不稳定的非均相分散体系,容易发生分层、絮凝、转相、合并、破裂等变化。脂肪乳剂的配制以磷脂作乳化剂,其稳定性由机械力和静电排斥力共同维持。由于同一磷脂分子具有亲水和疏水两极,能够在脂肪颗粒周围形成保护膜,构成机械屏障。同时,磷脂能使脂肪颗粒表面带负电荷,产生-35 mV电位,构成能量屏障,使脂肪颗粒之间互相排斥,维持脂肪乳剂的相对稳定[7]。从24 h脂肪乳剂颗粒的观察中可以看出:对照组和试验组的脂肪颗粒区别较显著,对照组脂肪颗粒随放置时间的延长变化不明显,而试验组则观察到脂肪颗粒增大、聚集、破裂的过程。本试验采用显微镜法检测脂肪颗粒,具有直观可辨的优点,但人为因素影响较大,测得的数据仅代表局部范围。应用光散射法的原理,使用激光衍射粒度仪检测脂肪乳类注射液,可对脂肪微粒的分布提供可靠、客观的数据[8]。
脂肪乳剂的稳定性易受pH、储存温度、电解质、葡萄糖最终浓度等多种因素影响,其中pH和电解质影响最大。pH低于5时脂肪乳丧失稳定性,pH高于6.6时则产生磷酸钙沉淀[9]。本试验中两组的pH均在TPN要求的pH范围(5~6)内。混合糖电解质注射液中电解质的存在,也可能是破坏TPN稳定性的重要原因。表5显示,由混合糖电解质注射液配制的试验组的 Na+,K+,Mg2+,Ca2+,Cl-,P3+均高出对照组,特别是二价和三价离子浓度差别更明显,Mg2+,Ca2+,P3+含量均相差4倍以上。鲁秀玲[10]报道,当溶液中的一价阳离子Na+浓度达到100 mmol/L,K+浓度达到50 mmol/L时,脂肪乳剂的稳定性丧失;当二价阳离子Ca2+浓度达到1.7 mmol/L,Mg2+浓度达到3.4 mmol/L时,可立即产生沉淀[10]。TPN液中如果加入过量的电解质不仅会影响脂肪乳剂的稳定性,还有可能通过使复合氨基酸产生盐析,使中性或弱碱性下的钙,镁,铁等离子发生沉淀,以及增加营养液渗透压的作用而对人体产生不良反应[11-12]。因此,不建议选用混合糖电解质替代葡萄糖作为能量补充剂。如果确有需要使用时,应严格控制其含量以及额外加入电解质的含量,特别是二价离子含量,而且配制后最好在4 h内输注。
[1]陈新谦,金有豫,汤 光.新编药物学[M].第15版.北京:人民卫生出版,2003:652-653.
[2]徐孝麟.TPN的配制与稳定性[J].中国药房,2000,11(1):45.
[3]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:附录62-附录63.
[4]段虞珍,钱康年,尹 桃,等.全静脉营养液的合理配方设计和调整[J].中国药房,1997,8(1):34-37.
[5]杨晓军,钟 智,陈赛红,等.葡萄糖和电解质对全肠外营养液中pH值和微粒稳定性影响的观察[J].广东医学院学报,2006,24(2):127-128.
[6]陈爱芬,李 强,戴福仁,等.混合糖电解质在肠外营养应用中的稳定性评价[J].浙江医学,2009,31(1):33-34.
[7]蔡卫民,袁克俭.静脉药物配置中心实用手册[M].北京:中国医药科技出版社,2005:113.
[8]尹明兰,史海雯,董玉勇.肠外营养液配制技术及稳定性考察[J].天津药学,2003,15(5):17.
[9]周 欣,王秀荣,翟所迪.“全合一”静脉营养液与胶体溶液配伍的稳定性研究[J].中南药学,2008,6(6):712-714.
[10]鲁秀玲.肠道外营养的配置[J].现代诊断与治疗,2009,12(3):187.
[11]段 辉,吴锦秋.影响全肠外营养液稳定性的因素分析[J].医药导报,2004,23(9):691.
[12]Ribeiro Dde O,Lobo BW,Volpato NM,et al.Influence of the calcium concentration in the presence of organic phosphorus on the physicochemical compatibility and stability of all-in-one admixtures for neonatal use[J].Nutr J,2009,8:51.

