不同浓度淫羊藿苷对大鼠成骨细胞增殖、分化的影响
钱卫庆,尹 宏,孙海涛
1.南京中医药大学第三附属医院(南京市中医院)骨伤科,江苏 南京 210001;2.南京中医药大学,江苏 南京 210029
中药淫羊藿很早即被应用于治疗抗骨质疏松症的复方中[1-2],但其抗骨质疏松作用机制直到近年才引起人们的高度重视,其中淫羊藿对成骨细胞的作用更是成为此领域的一大研究热点[3-6]。近年,学者对淫羊藿苷作用于成骨细胞的研究较多,但淫羊藿苷对成骨细胞增殖、分化作用的具体浓度尚存在异议[7-9],本实验通过建立大鼠离体成骨细胞培养体系,检测不同浓度淫羊藿苷对成骨细胞增殖和功能的影响,为进一步探讨淫羊藿苷防治骨质疏松的机制奠定实验基础。
1 试药与方法
1.1 药品及试剂
淫羊藿苷:南京泽朗医药科技有限公司;胰蛋白酶:美国Amresco公司;Ⅱ型胶原酶:南京生兴生物技术有限公司;碱性磷酸酶染液及碱性磷酸酶活性测定试剂盒:南京建成生物工程研究所。
1.2 方法
1.2.1 大鼠成骨细胞的分离和培养
将6只出生后24 h内的SD大鼠(南京军参照区总院动物试验中心提供)脱颈处死,取颅骨,具体培养方法见参考文献[10]。
1.2.2 成骨细胞鉴定
1.2.2.1 碱性磷酸酶定性染色 (偶氮偶联法)原代培养的成骨细胞生长约85%汇合,0.25%胰酶消化后,接种于铺有盖玻片的培养皿。按照碱性磷酸酶染液试剂盒的说明书进行操作。
1.2.2.2 钙化结节染色 (茜素红法)原代培养的成骨细胞生长约85%汇合,0.25%胰酶消化后,接种于培养瓶。染色步骤:在培养瓶中用PBS冲洗2次,95%乙醇固定10 min,三蒸水冲洗 3 次,加入 0.1%茜素红-Tris-HCl(pH 8.3)37℃,30 min,三蒸水冲洗,干燥,镜下观察。
1.2.3 MTT法检测淫羊藿苷大鼠成骨细胞增殖的影响
以每孔5000个细胞接种于96孔培养板,置于含5%CO2的37℃细胞培养箱中培养24 h后成骨细胞贴壁,按实验设计,分别加入浓度为 100.0、40.0、20.0、10.0、1.0、0.1 μg/L的淫羊藿苷和无淫羊藿苷的无血清DMEM培养液,在含5%CO2、37℃培养箱中培养24 h。吸弃上清液,每孔加入DMSO液 150 μl,振荡 10 min,使结晶物溶解,490 nm 波长下测定各孔的光吸收值。
1.2.4 碱性磷酸酶活性检测
取第2代成骨细胞,以5×104/ml细胞浓度接种于24孔培养板,培养至第5天吸去培养液,各孔分别加入含100.0、40.0、20.0、10.0、1.0、0.1 μg/L 和无淫羊藿苷的无血清 DMEM培养液,放入含5%CO2、37℃培养箱中培养24 h,收集上清液,测定碱性磷酸酶。按照碱性磷酸酶活性测定试剂盒的说明书进行操作。
1.3 统计学方法
采用统计软件SPSS 11.5对实验数据进行分析,计量资料数据以均数±标准差()表示,采用方差分析,多组间两两比较采用LSD-t检验。计数资料以率表示,采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 成骨细胞的鉴定
第3天时,细胞爬片达85%,爬片细胞经碱性磷酸酶染液后,绝大部分细胞染色阳性,细胞核呈紫色,胞膜和胞质出现明显的红棕色颗粒(图1)。培养21 d左右,成骨细胞密集区有不透明黑色颗粒(图2),经茜素红染色后,结节区反应阳性,中央染色深,呈深褐色,向周围逐渐变浅呈橘红色(图3)。

图1 成骨细胞碱性磷酸酶染色(×100)
图2 成骨细胞的矿化节结(×100)

图3 成骨细胞的矿化节结茜素红染色后(×100)
2.2 淫羊藿苷对成骨细胞增殖的影响
100.0 、40.0、1.0、0.1 μg/L 浓度组的淫羊藿苷在第 1、3、5天均能促进成骨细胞增殖,但与对照组比较,差异无统计学意义(P>0.05);在第 1、3 天 20、10 μg/L 与对照组比较,差异有统计学意义(P<0.05),而在第 5天只有 10 μg/L浓度组差异有统计学意义(P<0.05)。见表 1。
2.3 对细胞分化的影响
不同浓度淫羊藿苷均能促进成骨细胞碱性磷酸酶的分泌,其中在第1、2天只有20.0、10.0 μg/L两组差异有统计学意义(P<0.05),在第3天只有10 μg/L组差异有统计学意义(P<0.05),而到了第 5 天各组均无差异(P>0.05)。 见表 2。
表1 不同浓度淫羊藿苷对成骨细胞增殖的影响()

表1 不同浓度淫羊藿苷对成骨细胞增殖的影响()
注:与对照组比较,▲P<0.05
100.0 μg/L 组40.0 μg/L 组20.0 μg/L 组10.0 μg/L 组1.0 μg/L 组0.1 μg/L 组对照组组别 第1天0.307±0.0330.331±0.0340.358±0.037▲0.366±0.034▲0.333±0.0310.333±0.0370.291±0.033第3天0.366±0.0390.371±0.0320.389±0.021▲0.392±0.023▲0.368±0.0320.384±0.0270.351±0.032第5天0.306±0.0250.320±0.0290.321±0.0380.331±0.022▲0.318±0.0250.311±0.0290.299±0.011
表2 不同浓度淫羊藿苷对成骨细胞分泌碱性磷酸酶的影响(,U/100ml)
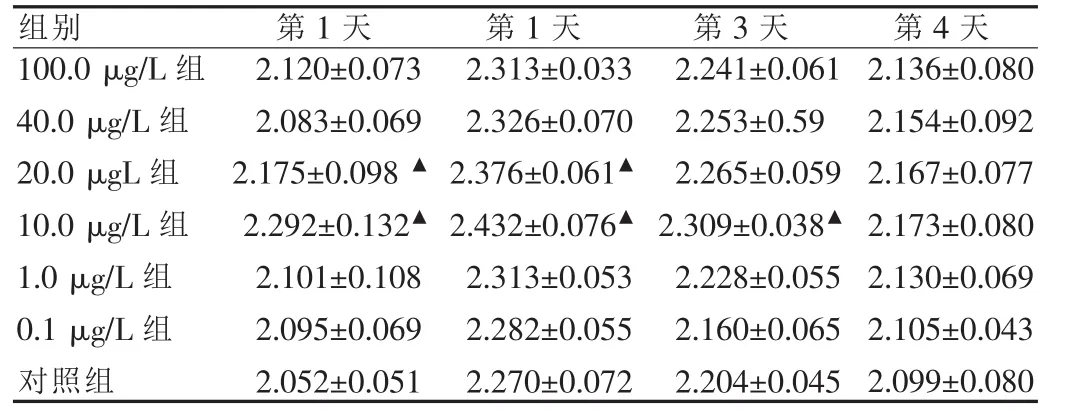
表2 不同浓度淫羊藿苷对成骨细胞分泌碱性磷酸酶的影响(,U/100ml)
注:与对照组比较,▲P<0.05
100.0 μg/L 组40.0 μg/L 组20.0 μgL 组10.0 μg/L 组1.0 μg/L 组0.1 μg/L 组对照组组别 第1天2.120±0.0732.083±0.0692.175±0.098 ▲2.292±0.132▲2.101±0.1082.095±0.0692.052±0.051第1天2.313±0.0332.326±0.0702.376±0.061▲2.432±0.076▲2.313±0.0532.282±0.0552.270±0.072第3天2.241±0.0612.253±0.592.265±0.0592.309±0.038▲2.228±0.0552.160±0.0652.204±0.045第4天2.136±0.0802.154±0.0922.167±0.0772.173±0.0802.130±0.0692.105±0.0432.099±0.080
3 讨论
3.1 淫羊藿在骨质疏松症中的运用
淫羊藿作为中药历史悠久,现代中药药理研究发现,淫羊藿的主要有效成分是淫羊藿总黄酮和淫羊藿多糖[11]。淫羊藿总黄酮是从小檗科淫羊藿属植物的茎叶中提取的总黄酮类成分,主要含有淫羊藿苷和淫羊藿次苷等,在许多体外细胞培养及体内试验研究中均发现淫羊藿苷可以有效促进成骨细胞增殖、分化、矿化及增强成骨细胞成骨活性,是一类很有应用前景的中药单体。
3.2 成骨细胞的发育
细胞增殖是成骨细胞成骨作用的最初阶段,其数量不断增加,并可形成多层细胞,因为成骨细胞能分化合成并分泌大量Ⅰ型胶原蛋白。在成骨细胞分化过程中,碱性磷酸酶大量表达,其表达量的多少,反映出细胞的分化程度和功能状态。当成骨细胞活动增强时,碱性磷酸酶活性升高,反之则降低。碱性磷酸酶是成骨细胞分化的早期指标。因此,在成骨细胞骨形成过程,其数量和功能直接影响骨形成能力,故本研究主要以成骨细胞的增殖与分化来考量淫羊藿苷对成骨细胞代谢的影响。
3.3 淫羊藿苷对成骨细胞发育的影响
成骨细胞在接种后24 h增殖迅速,此时细胞活力最为旺盛,因此指数生长阶段的细胞适用于加入样品,而在培养72 h进入平台期后,细胞数趋于稳定,此时测定可以减少实验误差。本实验结果提示淫羊藿苷可促进体外培养大鼠的成骨细胞增殖,促进作用与浓度有关,到了第5天开始时作用较弱,一方面可能是由于药物浓度及药效减弱,另一方面由于培养液营养的消耗不能维持细胞生长,培养中也观察到有较多细胞漂浮死亡,部分贴壁细胞形态皱缩,可能是发生了凋亡,具体明确的原因还有待于进一步的探讨。
碱性磷酸酶是参与骨代谢的重要蛋白质,被认为是细胞外基质成熟的早期标志,碱性磷酸酶的活性可以代表成骨细胞的早期分化水平[12]。成骨细胞在接种入培养板的前几天处于增殖期,碱性磷酸酶分泌低。而细胞长满培养板底后,细胞进入成熟期,各项功能性产物包括碱性磷酸酶开始分泌,培养液中碱性磷酸酶浓度较高,因此选用此时段收集上清液,检测碱性磷酸酶。实验结果提示淫羊藿苷能促进外培养大鼠的成骨细胞的分化成熟,并有一定的浓度依赖性。
综上所述,本实验在细胞水平观察了淫羊藿苷对成骨细胞代谢调控的影响,发现了浓度在10 μg/L时可显著促进成骨细胞的增殖、分化。实验结果与有些学者的研究存在差异[1-2],分析原因,可能由于这方面研究大都基于体外的细胞培养,组织细胞的生存环境在很大程度上有异于体内,另外还存在实验设计的差异等,这可能是造成实验结果存在差异的原因。下一步实验除了加强模拟类人体内微环境等新策略,还应从蛋白、基因等层次去研究淫羊藿苷具体是通过什么途径促进大鼠成骨细胞的增殖和分化,其深入的研究将为开发抗骨质疏松症新药物提供新途径。
[1]Hui P M,Lei G M,Bao F G,et al.Icariin is more potent than genistein in fromoting osteoblast differentiation and mineralization in vitro [J].A Journal of Cellular Biochemistry,2011,112(3):916-923.
[2]刘洪江,刘海全,秦佳佳,等.不同浓度淫羊藿含药血清干预骨髓基质干细胞的成脂分化[J].中国组织工程研究与临床康复,2011,15(14):2583-2586.
[3]Tsai P H,Sh Y S,Jui S S,et al.Icariin inhibits osteoclast differentiation and bone resorption by suppression of MAPKs/NF-KB regulated HIF-1α and PGE2 synthesis[J].Phytomedicine,2011,18(2):176-185.
[4]Hsieh TP,Sheu SY,Sun JS,et al.Icariin isolated from Epimedium pubescens regulates osteoblasts anabolism through BMP-2,SMAD4,and Cbfa1 expression[J].Phytomedicine international journal of phytotherapy and phytopharmacology,2010,17(6):414-423.
[5]Zhao J,Ohba S,Shinkai M,et al.Icariin induces osteogenic differentiation in vitro in a BMP-and Runx2-dependent manner[J].Biochem Biophys Res Commun,2008,369(2):444-448.
[6]陈柏龄,谢登辉,王宗伟,等.淫羊藿总黄酮对去卵巢大鼠骨组织OPG、OPGLmRNA表达的影响[J].中国骨伤,2009,22(4):271-273.
[7]李东晓,吴瑕,张磊,等.淫羊藿对骨骼系统的药理作用研究进展[J].中药药理与临床,2009,25(1):74-79.
[8]柯勇,张功礼,禹志宏.淫羊藿苷对体外培养的成骨细胞骨形态发生蛋白-2表达的影响[J].郧阳医学院学报,2008,27(3):202-210.
[9]吴涛,徐俊昌,南开辉,等.淫羊藿苷促进羊骨髓间充质干细胞的增殖和成骨分化[J].中国组织工程研究与临床康复,2009,13(19):3725-3729.
[10]王洪复.骨细胞图谱与骨细胞体外培养技术[M].上海:上海科学技术出版社,2001:53-54.
[11]Pei LK,Sun SQ,Guo BL,et al.Fast quality control of Herba Epimediiby using Fourier transform infrared spectroscopy [J].Spectrochim Acta Part A,2008,70(2):258-264.
[12]何伟,李自力,崔元璐,等.淫羊藿苷对大鼠成骨细胞核结合因子α1、骨形成蛋白-2、骨形成蛋白-4mRNA表达的影响[J].北京大学学报:医学版,2009,41(6):669-673.

