空心莲子草入侵对土壤细菌群落结构及其多样性的影响
王志勇,江雪飞,郑 慧,方治伟,郑世学
(1.华中农业大学 农业微生物学国家重点实验室 微生物农药国家工程研究中心,湖北 武汉 430070;2.咸宁职业技术学院,湖北 咸宁 437100)
空心莲子草(Alternantheraphiloxeroides),又名喜旱莲子草、水花生、空心苋、水蕹菜、革命草,属苋科,莲子草属,原产南美洲,多年生宿根、草本、水生植物,广泛分布于温带及亚热带地区。1892年在我国首次发现,后来迅速蔓延。目前中国除甘肃东南部、宁夏、陕西、山西、内蒙古南部以及辽宁南部尚未遭到入侵外,其它地区均有分布,2003年被中国科学院、中国环保总局确定为我国第一批外来入侵物种之一[1]。
空心莲子草在其入侵过程中和本地植物及土壤微生物之间是一个动态的相互作用过程,但从土壤微生物的角度分析空心莲子草入侵的研究甚少。
变性梯度凝胶电泳(DGGE)技术因可以分辨出长度相同但序列不同的DNA片断,直接从样品中扩增出16S rDNA片断,进而分析群落结构和多样性[2],在微生物生态学中得到了广泛的应用。作者在此拟通过对空心莲子草入侵后土壤16S rDNA的DGGE分析,结合土壤理化性质的分析、土壤酶活及可培养细菌数量的变化来探讨空心莲子草入侵对土壤细菌群落结构及其多样性的影响。
1 实验
1.1 样品的采集与处理
采样时间为2009年5月。所选采样区分别为咸宁职业技术学院、仙桃职业学院、华中农业大学,见表1。
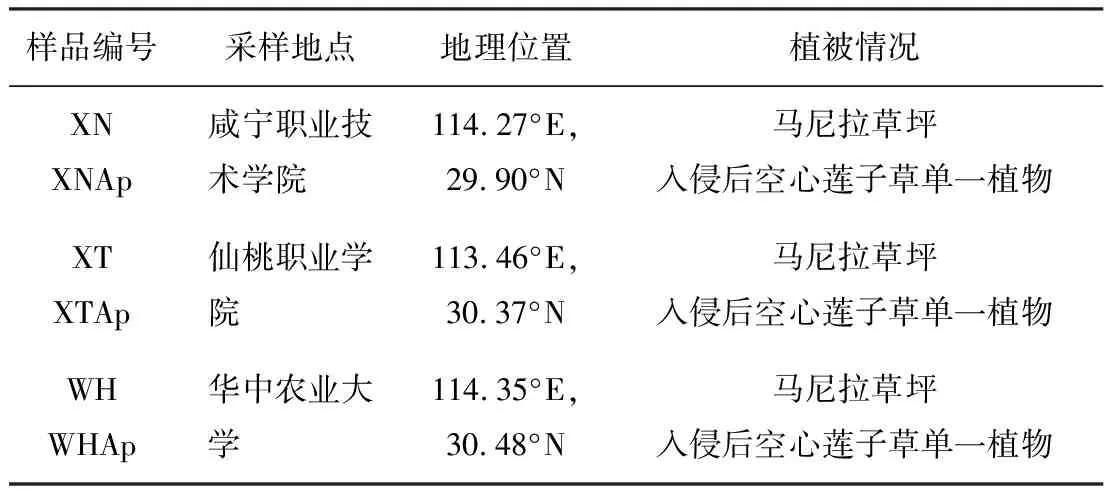
表1 采样地点的地理位置
3个采样区同属亚热带季风性(湿润)气候,四季分明;年均气温为15.8~17.5 ℃,年均降雨量为1150~1450 mm,且较为集中。分别在空心莲子草单一群落区和马尼拉草坪区按五点采样法采样,采样深度为0~15 cm,土样充分混合后马上风干至湿度20%~30%,过2 mm筛子,一部分土样立即用于土壤理化性质和土壤酶活的测定,其余土样-80 ℃保存,备用。
1.2 土壤理化性质的分析
土壤pH值的测定采用电极法;土壤有机质的测定采用重铬酸钾外加热法;土壤全氮的测定采用半微量凯氏定氮法;土壤硝态氮的测定采用硝酸试粉法;土壤有效磷的测定采用钼锑抗比色法;土壤速效钾的测定采用四苯硼钠比浊法;土壤含水量的测定采用常规的烘干称重和风干称重的方法[3]。
1.3 土壤酶活的测定
脲酶活性测定采用靛酚兰比色法[4];脱氢酶活性测定采用2,3,5-氯化三苯基四氮(TTC)法[5];酸性磷酸酶活性测定采用改进后的Hoffman法[6]。
1.4 活菌计数
对各采样点的混合土样参照《微生物学实验指导》,分别采用稀释平板计数法,用牛肉膏蛋白胨培养基测定土壤中可培养细菌的数量[7]。
1.5 土壤总DNA的提取与纯化
DNA提取方法参考纯培养细菌总DNA提取方法,并根据实际情况加以调整:称取0.5 g土样于2 mL离心管,每管各加1 mL 2×Buffer A、10 μL 10 mg·mL-1蛋白酶K、20 μL 100 mg·mL-1溶菌酶,置于摇床上37 ℃、200 r·min-1振摇45 min(每隔15 min颠倒混匀);每管加入125 μL 20% SDS溶液、60 μL CTAB、180 μL 5 mol·L-1NaCl,置于水浴锅(65 ℃)水浴1 h(每隔15 min颠倒混匀);室温下8000 r·min-1离心10 min,将上清液平均转入两个新的1.5 mL离心管中;上清液中加入等体积苯酚∶氯仿∶异戊醇(25∶24∶1,体积比),颠倒混匀,10 000 r·min-1离心5 min;将上清液转入新的1.5 mL离心管中,加入等体积氯仿∶异戊醇(24∶1,体积比),10 000 r·min-1离心5 min;将上清液转入新的1.5 mL离心管中,加入0.6 BV异丙醇、0.1 BV pH值5.2的3 mol·L-1NaAc溶液,于4 ℃沉淀1 h;10 000 r·min-1离心20 min,倒去液体,倒扣于纸巾上晾干10 min,得到粗核酸;加入500 μL 70%乙醇溶液润洗粗核酸,用微量移液器吹吸,10 000 r·min-1离心10 min;倒掉乙醇,在超净台上吹干乙醇,每管中加入10 μL ddH2O溶解沉淀,合并两管土壤DNA,得到20 μL DNA溶液[8]。
用DNA纯化试剂盒(DNA Fragment Purification Kit Mag Extractor,code:NPK-600)纯化提取的总DNA,操作步骤按照说明书进行。
1.6 16S rDNA的nested-PCR扩增
第一次PCR:所用引物为27F/1492R(表2)。PCR扩增体系:10×Buffer 2.5 μL,dNTPs 1 μL,27F 0.2 μL,1492R 0.2 μL,Taq酶0.2 μL,2.5 μL DNA(10 ng·μL-1)作为模板,以ddH2O补充至25 μL。扩增反应条件:94 ℃预变性 5 min,94 ℃变性45 s,54 ℃退火45 s,72 ℃延伸1.5 min,进行30个循环,最后72 ℃延伸10 min。
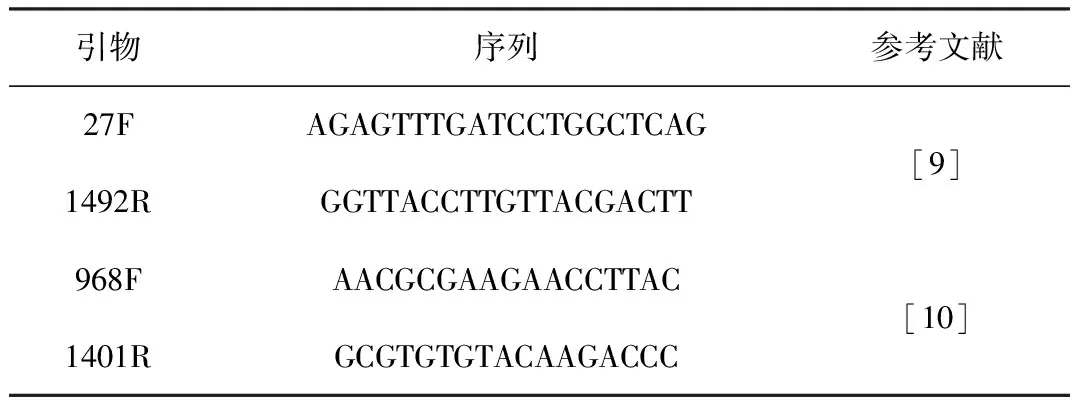
表2 16S rDNA nested-PCR引物
第二次PCR:所用引物为GC-968F/1401R(表2),扩增16S rDNA V6~V8可变区。GC-968F为968F的5′端接GC夹子(5′-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGG-3′)。将第一次PCR产物按1∶100稀释后作为扩增模板。PCR扩增体系:10×Buffer 2.5 μL,dNTPs 1 μL,GC-968F 0.2 μL,1401R 0.2 μL,Easy酶0.2 μL,Template 0.5 μL,以ddH2O 补充至25 μL。扩增反应条件:95 ℃预变性5 min,94 ℃变性45 s,66 ℃退火1 min,72 ℃延伸1.5 min,进行35个循环,最后72 ℃延伸10 min,使所有片段完全延伸[9~11]。产物约为430 bp。
1.7 16S rDNA nested-PCR扩增产物的DGGE
将纯化后的nested-PCR产物用BIO-RAD公司DCodeTMSystem梯度凝胶电泳仪进行DGGE。丙烯酰胺/双丙烯酰胺凝胶(37.5∶1)为40%,电泳缓冲溶液为1×TAE,胶浓度为8%,变性梯度为50%~60%。点样量为第二次PCR产物20 μL,电泳电压60 V、温度60 ℃、时间16 h,然后固定、银染、照胶[10,11]。
1.8 数据的统计分析
DGGE图谱的分析用Quantity One软件进行,各数据的方差分析、单因素分析、数据差异性分析用SPSS 16.0统计软件、Excel软件进行,用OriginPro 7.5和Excel软件作图。
2 结果与讨论
2.1 空心莲子草入侵对土壤理化性质的影响(表3)
从表3可以看出,采自咸宁、武汉酸性土样的pH值下降显著(P<0.05)。廖全斌等[12]在研究空心莲子草吸收钴离子前后溶液pH 值的变化时指出:在碱性条件下pH值增大,表明有生物碱溶于水中; pH值减小可能与该植物对重金属离子的吸收机制有关。正常情况下空心莲子草既会向土壤中释放生物碱,也要从土壤中吸收金属离子,其吸收机制也应该是生物吸附,因此多种因素之和可以引起酸性土壤pH值的下降。本实验的研究结果与其一致。
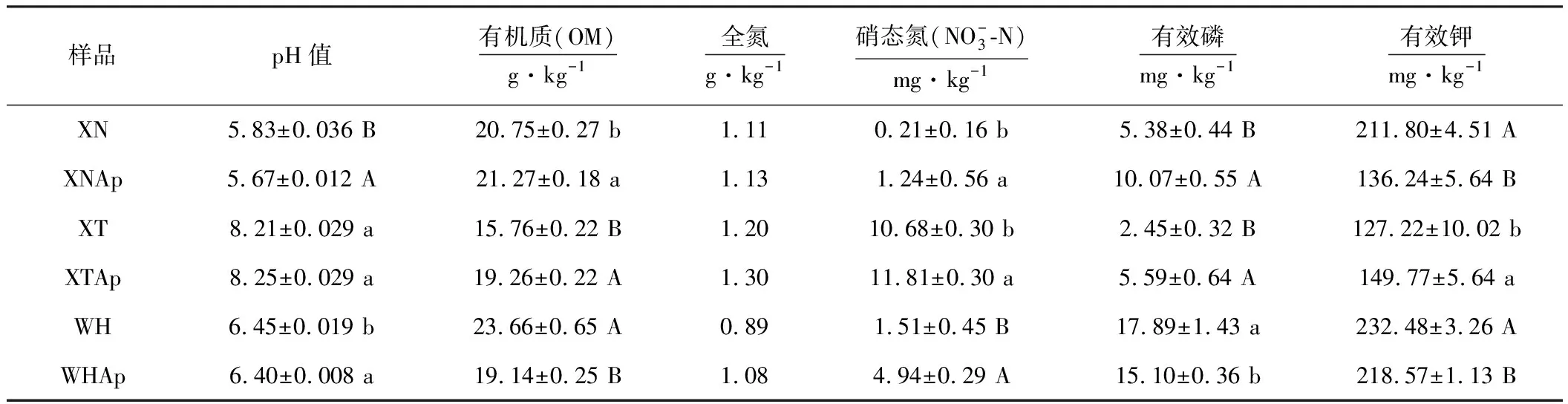
表3 空心莲子草入侵对土壤理化性质的影响
从表3还可以看出,空心莲子草入侵后3个采样区土壤的全氮含量均增加,硝态氮含量显著或极显著增加;采自咸宁、仙桃土样的有效磷和有机质的含量均显著或极显著增加,而采自武汉土样的有机质和有效磷含量显著或极显著下降;采自咸宁、武汉土样的有效钾含量下降极显著,而采自仙桃土样的有效钾含量则显著增加。
2.2 空心莲子草入侵对土壤酶活性和可培养细菌数量的影响(表4)
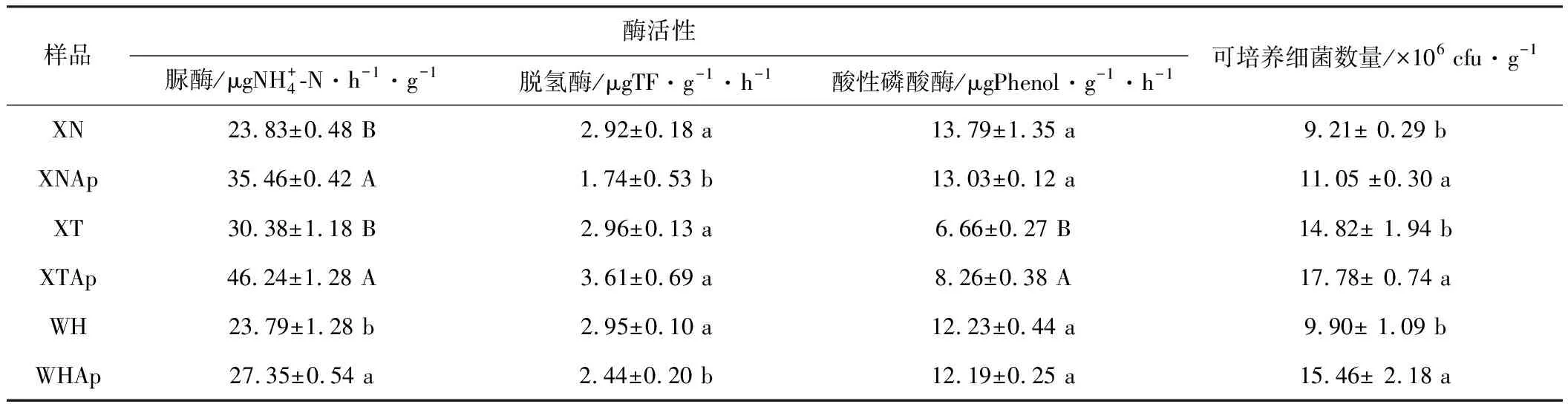
表4 空心莲子草入侵对土壤酶活性和可培养细菌数量的影响
从表4可以看出,空心莲子草入侵后,土壤脲酶的活性均显著增大,其中采自咸宁、仙桃土样的脲酶活性极显著增大;采自咸宁、武汉的这两组偏酸性土样的脱氢酶活性和酸性磷酸酶活性下降显著,而采自仙桃的偏碱性土样的脱氢酶活性显著增大、酸性磷酸酶活性极显著增大。
从表4还可以看出,空心莲子草入侵后,3个采样区土壤的可培养细菌数量均显著增加。
2.3 空心莲子草入侵对土壤细菌群落结构和细菌多样性的影响
用细菌16S rDNA第二次PCR产物进行DGGE,结果见图1。

图中上方1~6为:XN、XNAp、XT、XTAp、WH、WHAp,下方的数字代表相应泳道的Shannon-Weaner Index H′
从图1可以看出,各泳道的条带数目、条带位置和亮度存在一定程度的差异。如图1中左向的箭头1、2、3、4、6是入侵后减少或减弱的条带,右向的箭头5是入侵后加强的条带。而所有入侵地区土壤细菌的Shanon-Wiener Index均下降。这表明空心莲子草入侵后引起了土壤细菌群落结构的改变,细菌多样性因土壤的差异呈不同的下降趋势。
2.4 讨论
养分的获得对入侵植物的生长、扩张有决定的作用。牛红榜[13]在对紫茎泽兰入侵的研究中发现:紫茎泽兰的入侵提高了土壤中植物可直接吸收的硝态氮、铵态氮等速效养分的含量,紫茎泽兰和当地植物的繁殖特性与利用速度不同,因此土壤速效养分的提高可能对紫茎泽兰的生长和竞争有利。本研究中空心莲子草入侵后土壤全氮和硝态氮的含量显著增加。土壤中氮素的来源主要有施肥、灌溉、降水、生物固定等几种方式。由于本研究采样区各区域内的自然条件相同,管理人员对所在区域草坪的施肥、灌溉等操作基本一致,由此可以认为土壤氮素的增加主要来自生物固定。作为植物而言,空心莲子草本身不具备固氮的能力,因此可以认为空心莲子草入侵后可能引起了土壤固氮微生物数量的增加或者活性的提高,从而提高了土壤的氮素含量。土壤中氮素循环的一般过程是土壤有机质首先经过微生物的水解然后氨化形成铵态氮,在旱地中由于通气条件较好,这些铵态氮会很快被氧化成硝态氮,即经土壤微生物的硝化作用转变成硝态氮[14]。本研究中空心莲子草入侵后土壤硝态氮含量均显著增加,可能是参与土壤硝化作用的微生物数量增加所致。
土壤酶活性是土壤的本质属性之一。土壤中的酶主要来源于微生物、动物、植物活体的分泌及这些生物残体的分解和释放(其中微生物的作用更大)。实验结果表明,空心莲子草入侵后,土壤胞外酶脲酶[15]的活性显著增强,可能是产生脲酶的微生物数量增加所致。因此,空心莲子草入侵后,可能促进了与土壤氮素循环有关的微生物数量的增加,这些微生物包括与氮素固定的相关微生物、与氮素转化有关的微生物如参与硝化作用(主要是硝化细菌)、分泌脲酶的微生物的数量增加,使得土壤中氮素的代谢变得更加活跃,进而使得土壤中空心莲子草可利用的氮素含量增加,从而更利于空心莲子草的生长。活菌计数的结果表明,空心莲子草入侵后土壤可培养细菌的数量均显著增加,也间接说明空心莲子草入侵引起了土壤酶活性的变化。
同紫茎泽兰的入侵类似,空心莲子草的生长速度也非常快。据观察,空心莲子草在适宜自然条件下,旱地每15 d内枝条平均长度可增加6.76 cm,覆盖面积增加54.9 m2[16]。该植物的快速生长需要大量的营养元素特别是氮素的支持,因此土壤全氮含量增加、硝态氮含量显著增加可能是空心莲子草成功入侵的重要因子。相关性分析表明,可培养细菌的数量与硝态氮含量之间的相关系数为0.90,为极显著正相关(P<0.01),可能是空心莲子草的入侵引起了土壤中可培养细菌特别是硝化细菌数量的增加,从而导致土壤硝态氮含量显著增加;土壤全氮含量与土壤脲酶活性之间的相关系数为0.78,为显著正相关(P<0.05),这可能是由于土壤全氮含量的增加促进了能分泌脲酶的微生物的活性。
3 结论
通过比较空心莲子草入侵前后土壤理化性质、土壤酶活、可培养细菌数量及16S rDNA的PCR-变性梯度凝胶电泳(DGGE)发现,空心莲子草入侵后,硝态氮含量、土壤脲酶活性和可培养细菌数量显著增加,可培养细菌的数量与硝态氮含量呈极显著正相关(P<0.01);土壤细菌群落结构发生了一定程度的改变,细菌的多样性指数因土壤不同而呈现不同的下降趋势。
参考文献:
[1] 陈立立,余岩,何兴金.喜旱莲子草在中国的入侵和扩散动态及其潜在分布区预测[J].生物多样性,2008,16(6):578-585.
[2] Muyzer G,Wall D E,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction amplified genes coding for 16S rRNA[J].Appl Environ Microbiol,1993,59(3):695-700.
[3] 南京农业大学.土壤农化分析(第二版)[M].北京:中国农业出版社,2005:27-90.
[4] 丰骁,段建平,蒲小鹏,等.土壤脲酶活性两种测定方法的比较[J].草原与草坪,2008,(2):70-72.
[5] 解军,祁峰,裴海燕,等.脱氢酶活性检测方法及其在环境监测中的应用[J].中国环境监测,2006,22(5):13-18.
[6] 赵兰坡,姜岩.土壤磷酸酶活性测定方法的探讨[J].土壤通报,1986,16(3):138-141.
[7] 沈萍,范秀宽,李广武,等.微生物学实验[M].北京:高等教育出版社,2004:92.
[8] Sun H Y,Deng S P,Ruan W R.Bacterial community structure and diversity in a century-old manure-treated agroecosystem[J].Appl Environ Microbiol,2004,70(10):5868-5874.
[9] DeLong E F.Archaea in coastal marine environments[J].Proc Natl Acad Sci USA,1992,89(12):5685-5689.
[10] Nübel U,Engelen B,Felske A,et al.Sequence heterogeneities of genes encoding 16S rRNAs inPaenibacilluspolymyxadetected by temperature gradient gel electrophoresis[J].Bacteriology,1996,178(19):5636-5643.
[11] Muyzer G,Smalla K.Application of denaturing gradient gel electrophoresis(DGGE)and temperature gradient gel electrophoresis(TGGE) for studying soil microbial communities[J].Antonie van Leeuwenhoek,1998,73(1):127-141.
[12] 廖全斌,罗光富,童开发,等.空心莲子草吸附钴离子前后溶液pH值的变化及其红外光谱研究[J].三峡大学学报(自然科学版),2002,24(3):286-288.
[13] 牛红榜.外来植物紫茎泽兰入侵的土壤微生物学机制[D].北京:中国农业科学院,2007.
[14] 范业宽,叶坤合.土壤肥料学[M].武汉:武汉大学出版社,2002:61-62.
[15] 吴金水,林启美,黄巧云,等.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006:117-120.
[16] 周志华,曹茂华,王成,等.旱地空心莲子草自然消长规律及在农田中的分布和侵染扩展速度调查[J].现代农业科技,2008,37(22):112-113.

