Ce掺杂纳米NiO超声降解甲基橙的性能研究
张金涛,肖 波,刘宝亮,曹桂萍,壮亚峰
(常州工学院化工系,江苏 常州 213022)
纺织印染废水含有染料、浆料、助剂、油剂、酸碱、纤维杂质、砂类物质、无机盐等,具有水量大、有机污染物含量高、碱性大、水质变化大等特点,属难处理的工业废水之一[1]。其可生化性差,而染料结构稳定性的提高,也给脱色处理增加了难度[2,3]。印染废水的处理方法主要包括物化法、高级氧化法和生物法等[4]。在高级氧化法中,采用光敏化半导体材料来催化降解印染废水成为近来国内外研究的热点。其中,对TiO2及其复合氧化物的光催化性能研究较多[1,5~7]。在紫外光的照射下,TiO2与H2O产生具有极强氧化能力的·OH,最终可使有机污染物完全降解为CO2、H2O等小分子[8]。由于紫外光对不透明的废水溶液的穿透能力较低,严重影响了TiO2的光催化性能。因此,出现了超声波辅助纳米TiO2对印染废水进行降解处理的新技术[8~12]。研究结果表明,超声波产生的空化作用有效提高了TiO2对有机污染物的催化降解作用。
NiO作为重要的p型半导体材料,广泛应用于催化剂、气敏传感材料、电池电极、光电材料、电化学电容器等领域[13,14]。在纳米NiO催化性能的研究中,有研究者采用光照的方法来提高NiO的催化氧化能力[15~17];有研究者在无光照条件下以纳米NiO作为催化剂对有机物进行降解[18,19]。但采用超声波与纳米NiO协同催化降解印染废水中有机污染物的研究鲜有报道。本课题组对在超声辐射和紫外光照两种条件下,纳米NiO催化降解模拟印染废水甲基橙溶液的性能进行了初步的研究[20]。结果表明,纳米NiO在超声辐射下催化氧化降解甲基橙分子的效果显著优于紫外光催化氧化。
CeO2具有良好的储氧能力,能改善催化剂表面状态和性能,常被作为助剂或载体应用于多相催化剂中[21~24],也有将其作为主催化剂的报道[25]。
作者在上述研究基础上,采用共沉淀法制备了Ce掺杂纳米NiO催化剂,研究了在超声条件下催化剂用量、pH值、温度和超声辐射时间对其催化降解模拟印染废水甲基橙溶液性能的影响。
1 实验
1.1 试剂与仪器
可溶性淀粉,上海化学试剂厂;Ni(OAc)2·4H2O,国药集团化学试剂有限公司;甲基橙,上海试剂三厂;氨水,丹阳市永丰化学试剂厂;Ce(NO3)3·6H2O,上海润捷化学试剂有限公司;以上试剂均为分析纯。
D/max 2500 PC 型X-射线衍射仪(XRD),日本;78-1型磁力加热搅拌器、723型紫外可见分光光度计,上海;KH-500B型超声波发生器,昆山;SX-4-10型马弗炉、TGL-16A型高速离心机,金坛。
1.2 纳米材料的制备
参照文献[26]进行纳米NiO的制备。将2.0 g淀粉加入40 mL蒸馏水中,磁力搅拌2 h得到乳白色的悬浊液。将该悬浊液与20 mL 0.2 mol·L-1的醋酸镍溶液混合,强烈磁力搅拌5 h。滴加5%(质量分数)氨水,将混合溶液的pH值调至9,此时混合物中生成浅绿色的Ni(OH)2。加热混合物至糊状,然后置于100 ℃的干燥箱内烘干。充分研磨后,于450 ℃马弗炉中煅烧6 h,即得纳米NiO。
同法在制备过程中加入一定量的Ce(NO3)3·6H2O,制得Ce掺杂纳米NiO,其中Ce和Ni的摩尔比为0.125∶1。
1.3 XRD分析
采用XRD技术对合成的纳米NiO和Ce掺杂纳米NiO的晶体结构进行表征。
XRD测量条件:Cu靶,石墨片滤波,管压40 kV,电流100 mA,波长0.154056 nm。
纳米NiO的平均晶粒尺寸根据XRD谱图中相应的峰宽,利用Scherrer 公式计算:
d=Kλ/(βcosθ)
式中:d为平均晶粒尺寸;λ为X-射线波长;K为宽化常数,通常取0.9;β为衍射峰的半高宽;θ为Bragg衍射角。
1.4 甲基橙溶液的催化氧化
准确量取一定量、一定浓度的甲基橙溶液,调节溶液pH值后向其中加入一定量的纳米催化剂,置于超声波发生器中,间隔一定时间取样,高速离心分离催化剂后,取上层清液测量吸光度,计算脱色率。在超声反应过程中,采用水循环方式保持甲基橙溶液温度基本恒定。
1.5 甲基橙降解率的计算
研究表明[10],甲基橙分子经半导体氧化物催化氧化后,其溶液的色度去除率与其COD去除率保持一致。因此,可采用溶液脱色率D来评价甲基橙分子的降解效果。脱色率D由降解前后溶液吸光度计算:
式中:A0为溶液降解前的吸光度;At为降解时间t时的吸光度。
2 结果与讨论
2.1 Ce掺杂前后的纳米NiO的XRD分析(图1)
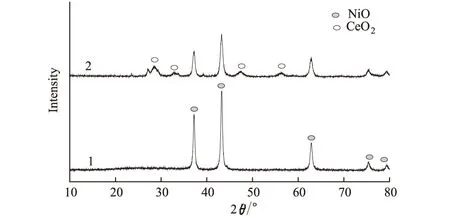
图1 纳米NiO(1)和Ce掺杂纳米NiO(2)的XRD谱图
通过与JCPDS卡对比,确认图1中曲线1的2θ分别为37.20°、43.25°、62.87°、75.41°和79.41°处出现的尖锐衍射峰源于纳米NiO相结构。NiO衍射峰主峰强度较大,说明NiO结晶性好。此外,各衍射峰峰形完整,没有其它杂质峰出现。利用Scherrer公式,计算得到纯NiO晶粒的平均尺寸约为19.95 nm。
曲线2在与曲线1相同的2θ位置处也出现衍射峰,说明仍为纳米NiO,其基本结构没有发生变化。但在2θ值分别为28.42°、32.82°、47.54°和56.26°处出现了新的衍射峰,应为纳米NiO中掺杂的CeO2形成的[21~24]。由于Ni2+半径(0.069 nm)与Ce4+半径(0.102 nm)存在很大差异,煅烧中Ce4+无法进入NiO晶格代替Ni2+,而是以CeO2的形式存在于NiO纳米粒子中或覆盖在其表面[27]。同时,由图1还可知,Ce元素加入后,NiO衍射峰强度减弱,而宽度略增。利用Scherrer公式,计算得到Ce掺杂纳米NiO晶粒的平均尺寸约为14.72 nm,与文献[24]的结果一致。因此,在制备纳米NiO的过程中掺杂Ce元素可减小NiO晶粒的尺寸、增大其比表面积,从而改善催化剂的性能。
2.2 甲基橙最大吸收波长
为确定甲基橙溶液的最大吸收波长及甲基橙浓度对最大吸收波长是否存在影响,分别配制浓度为6 mg·L-1、12 mg·L-1和18 mg·L-1的甲基橙溶液,在400~500 nm的波长范围内进行紫外可见吸收光谱扫描,结果见图2。
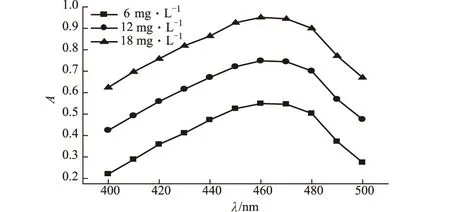
图2 不同浓度甲基橙溶液的紫外可见吸收光谱
由图2可知,三种浓度的甲基橙溶液的最大吸收波长均约为460 nm,浓度变化对甲基橙溶液的最大吸收峰位置无影响,仅仅导致溶液吸光度存在差异,表明在甲基橙溶液的催化降解过程中,甲基橙分子的减少不会对其最大吸收波长产生影响。后续实验中,确定检测波长为460 nm,采用浓度为12 mg·L-1的甲基橙溶液作为印染废水的模拟溶液。
2.3 Ce掺杂对催化剂性能的影响
准确量取50 mL pH值为3[10]的12 mg·L-1甲基橙溶液,分别加入Ce掺杂前后的纳米NiO各约0.2 g,置于超声波发生器中,溶液温度保持在18~20 ℃,每隔30 min取样,计算甲基橙溶液的脱色率,考察Ce掺杂前后纳米NiO在超声辐射条件下对甲基橙的催化降解效果,结果如图3所示。
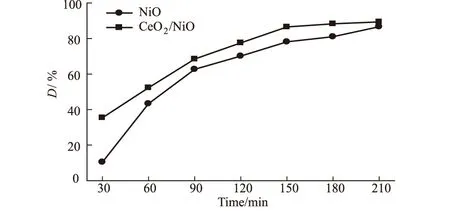
图3 不同催化剂对甲基橙降解效果的影响
由图3可知,在超声条件下、降解反应时间180 min内,Ce掺杂纳米NiO的催化氧化效果均好于纳米NiO;而反应时间达到210 min时,催化氧化效果则趋于一致,脱色率接近90%。研究表明[27],Ce4+易捕获光生电子生成Ce3+,导致催化剂产生的光生电子与空穴的复合几率大为减小,从而有效促进二者分离,提高半导体催化剂的催化效率。由此可推测,在纳米NiO粒子的制备过程中添加稀土元素Ce,提高了催化剂表面氧空位含量,Ce4+与Ce3+之间的转变增强了催化剂的电子转移,有利于催化剂表面的吸附氧获得电子形成O2·自由基[24]。同时,结合Ce掺杂纳米NiO的XRD图计算所得的粒径尺寸数据,掺杂Ce元素使得最终产物的粒径减小、比表面积增大,亦有利于提高催化剂的催化效率。因此,在超声催化氧化的初期,Ce掺杂纳米NiO催化剂的降解效率较高,而催化降解时间延至210 min时,由于CeO2的催化性能较低[25]且在复合催化剂中含量较低,导致二者的催化效果趋于一致。
2.4 超声辐射时间对甲基橙降解效果的影响
准确量取50 mL pH值为3的12 mg·L-1甲基橙溶液,加入Ce掺杂纳米NiO催化剂约0.2 g,将其置于超声波发生器中,溶液温度保持在18~20 ℃,每隔15 min取样,计算甲基橙溶液的脱色率,考察超声辐射时间对甲基橙催化降解效果的影响,结果如图4所示。
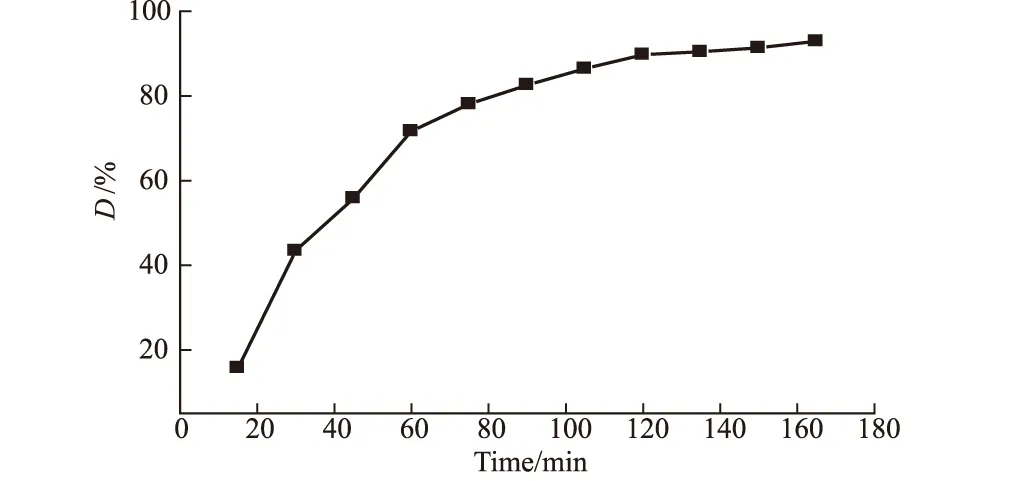
图4 超声辐射时间对甲基橙降解效果的影响
由图4可知,在超声催化氧化过程中,随着甲基橙分子不断在Ce掺杂纳米NiO催化剂表面发生氧化反应,被矿化生成CO2、H2O等无机小分子,甲基橙溶液脱色率在120 min内显著升高,达到90%左右,降解效果明显;超过120 min后,脱色率升幅缓慢。因此,确定超声辐射时间以2 h左右为宜。
2.5 pH值对甲基橙降解效果的影响
由甲基橙分子的性质可知,pH值对其在溶液中的存在形态具有显著影响。同时,pH值的大小还能影响催化剂表面所带电荷的性质和有机物分子在催化剂表面的吸附行为[24]。因此,改变甲基橙溶液的pH值,将对催化剂的性能产生影响。准确量取50 mL 12 mg·L-1甲基橙溶液,调节pH值分别为3、7和11,各加入约0.2 g Ce掺杂纳米NiO催化剂,置于超声波发生器中,溶液温度保持在18~20 ℃,每隔15 min取样,计算甲基橙溶液的脱色率,考察pH值对甲基橙降解效果的影响,结果如图5所示。
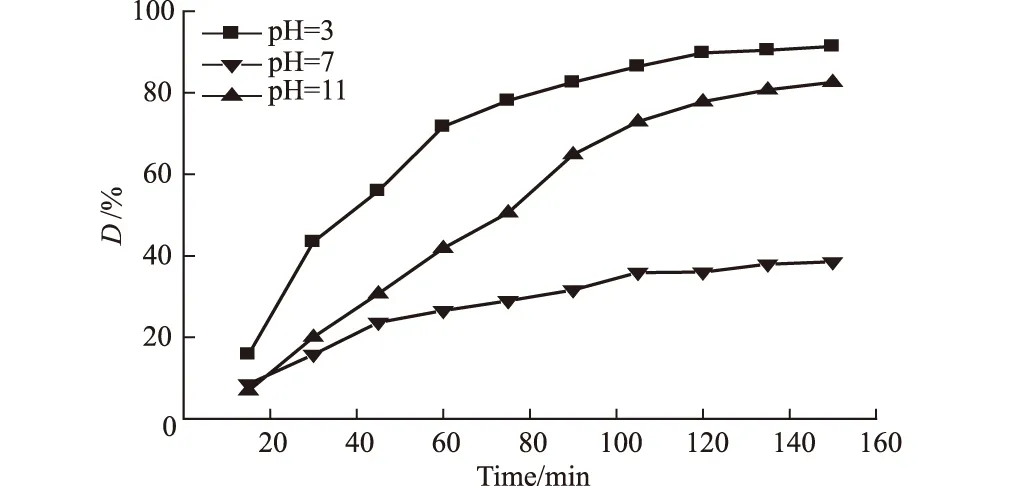
图5 pH值对甲基橙降解效果的影响
由图5可知,超声催化反应时间相同时,甲基橙溶液的脱色率随溶液pH值的增大先显著降低而后又明显升高。对于三种溶液,酸性甲基橙溶液的色度去除最快,且在全部反应时间内脱色率高于中性和碱性溶液。说明酸性条件利于甲基橙分子的分解。而碱性甲基橙溶液的脱色率又显著高于中性溶液。这是因为[10,28],在甲基橙分子降解过程中,主要依靠催化剂表面产生的·OH的强氧化性,该活性物种的生成与溶液pH值有关。在酸性条件下,·OH可通过H+被吸附在NiO表面上的氧俘获,相继发生一系列反应,在生成双氧水的基础上进一步生成;在碱性条件下,NiO表面的OH-逐渐增多,活性物质·OH由NiO表面吸附的OH-通过电子转移给超声反应生成的空穴来提供,可认为OH-在NiO表面吸附的位置即是生成·OH的活性部位,若OH-的量增多,则·OH的生成量增多。因此,甲基橙分子在酸性和碱性溶液中均可被分解,导致溶液颜色去除,但酸性条件下更为有利。
2.6 温度对甲基橙降解效果的影响
准确量取50 mL pH值为3的12 mg·L-1甲基橙溶液,加入0.2 g Ce掺杂纳米NiO催化剂,置于超声波发生器中,控制温度分别为18 ℃、35 ℃和45 ℃,每隔30 min取样,计算甲基橙溶液的脱色率,考察温度对甲基橙降解效果的影响,结果如图6所示。

图6 温度对甲基橙降解效果的影响
由图6可知,温度为18 ℃时的甲基橙脱色率均显著高于35 ℃和45 ℃时的脱色率,而后二者的脱色率非常接近。一般而言,温度升高,溶液的粘滞系数和表面张力下降,蒸汽压升高,空化泡容易产生。同时温度升高时压力也升高,空化气泡崩溃瞬间所产生最高温度和压力均降低,空化强度减弱,从而导致水中有机污染物的降解效率降低[9,12]。因此,在超声辐射条件下通过循环甲基橙溶液或超声介质使其温度<20 ℃来进行催化降解更为有利。
2.7 催化剂用量对甲基橙降解效果的影响
准确称取Ce掺杂纳米NiO催化剂0.2080 g、0.1013 g和0.0501 g,分别加入50 mL pH值为3的12 mg·L-1甲基橙溶液,置于超声波发生器中,溶液温度保持在18~20 ℃,每隔15 min取样,计算甲基橙溶液的脱色率,考察催化剂用量对甲基橙降解效果的影响,结果如图7所示。

图7 催化剂用量对甲基橙降解效果的影响
由图7可知,在催化氧化反应的前90 min内,甲基橙溶液的脱色率随催化剂用量的增加而显著增大;90 min后,催化剂用量为0.0501 g时的甲基橙脱色率虽由63%升高至79%,但仍较低,要达到较好降解率需要更长的时间;100 min后催化剂用量为0.2080 g与0.1013 g时的甲基橙溶液脱色率十分相近,分别为94%和92%。因此,选用2 g·L-1左右Ce掺杂纳米NiO催化剂更加合理,可节省处理费用。
2.8 讨论
关于超声波与半导体光催化剂协同降解去除有机污染物的作用机制,目前存在两种观点[10~12]:一种是声致发光机理,另一种是高热激发机理。当超声波作用于水分子时,发生如下反应:
·OH+·OH→ H2O2
·H+O2→·HO2
·HO2+·H→ H2O2
·HO2+·HO2→ H2O2+O2
反应产生的高活性·OH、·H及强氧化性的H2O2等粒子将有机物氧化降解为CO2和H2O等无机小分子,而半导体材料NiO的存在可增加这些物种的产生,从而有效提高有机污染物的降解效率。
3 结论
采用共沉淀法制备了Ce掺杂纳米NiO。XRD分析表明,Ce元素以CeO2形式存在于复合催化剂中,Ce掺杂导致纳米NiO粒径减小。考察其在超声辐射条件下催化氧化甲基橙溶液的性能,结果表明,在相同条件下,Ce掺杂纳米NiO催化氧化性能优于纳米NiO;在超声辐射时间约为2 h、pH值为3、温度为18 ℃、催化剂用量为2 g·L-1的条件下,Ce掺杂纳米NiO超声降解甲基橙溶液的效果较好。
参考文献:
[1] 罗洁,陈建山,程凯英.TiO2光催化氧化降解印染废水的研究[J].应用化工,2004,33(5):24-26.
[2] 王振东,张志祥.印染废水的污染与控制[J].环境科学与技术2001,93(1):19-23.
[3] 单国华,贾丽霞.印染废水处理方法及其研究进展[J].广西轻工业,2007,(4):75-77.
[4] 严永红,任洪强,王晓蓉,等.印染废水深度处理及回用技术的研究进展[J].工业水处理,2004,24(11):16-19.
[5] 王成国,邓兵.纳米TiO2光催化氧化处理直接耐晒翠蓝染色废液[J].印染,2004,30(7):10-12.
[6] Linsebiger A L.Photocatalysis on TiO2surfaces:Principle,mechanisms,and selected results[J].Chem Rev,1995,95(3):735-758.
[7] 王九思,赵红花.负载型纳米TiO2光催化降解活性艳红x-3B染料[J].应用化学,2002,19(8):792-794.
[8] 李凡修,陆晓华,梅平.TiO2催化超声波降解钻井污水中CODCr技术研究[J].工业水处理,2007,27(4):35-37,40.
[9] 刘振荣,李红,王君,等.TiO2催化超声降解亚甲基蓝溶液[J].化学研究,2005,16(1):69-71.
[10] 王君,张向东,李绮,等.SiO2掺杂TiO2催化超声降解甲基橙溶液[J].化学研究,2004,15(1):12-15.
[11] 程欣,吴胜举,张宁宁.超声催化二氧化钛深度处理染料废水[J].工业安全与环保,2006,32(11):1-3.
[12] 任百祥,孙淑波.Fe2O3掺杂TiO2催化超声降解染料工业废水的研究[J].工业水处理,2010,30(8):36-39.
[13] 赵晓华,安娜,王晓兵,等.纳米氧化镍研究进展[J].无机盐工业,2007,39(7):1-4.
[14] 张煜,邱运仁.纳米氧化镍的制备与应用[J].化学工业与工程技术,2009,30(2):51-54.
[15] 娄向东,楚文飞,韩珺,等.水热法制备片状纳米氧化镍及其光催化性能[J].水处理技术,2007,33(11):23-27.
[16] 郭丽华,丁士华,杨晓静,等.锂掺杂氧化镍光催化剂的制备与性能研究[J].材料导报,2010,24(15):141-143.
[17] 张建英,杨合情,杨瑞丽,等.金属镍基质上直立六边形NiO纳米片的制备与光催化性能[J].科学通报,2007,52(17):2015-2020.
[18] 周幸福,韩爱杰,褚道葆,等.非水体系中电解镍中间产物制备纳米NiO[J].物理化学学报,2002,18(7):613-616.
[19] 高建峰,徐春彦,白婷婷.NiO/活性炭催化氧化降解水中LAS研究[J].河南化工,2008,25(4):20-23.
[20] 张金涛,曹桂萍,刘宝亮,等.甲基橙的催化氧化降解工艺研究[J].化学与生物工程,2011,28(2):36-39.
[21] 李娟,塔娜,李勇,等.纳米尺度CeO2在多相催化反应中的形貌效应[J].催化学报,2008,29(9):823-830.
[22] 朱跃辉,吴锋,吴川.焙烧温度对乙醇重整催化剂NiO-CeO2-ZnO性能的影响[J].北京理工大学学报,2010,30(5):594-598.
[23] 蔡黎,陈山虎,赵明,等.负载型Pd三效催化剂:载体CeO2-ZrO2-BaO的制备及催化性能[J].无机化学学报,2009,25(3):474-479.
[24] 杨少霞,祝万鹏,陈正雄,等.CeO2-TiO2催化剂的表面结构及其湿式氧化活性[J].催化学报,2006,27(4):329-334.
[25] 颜志鹏,崇明本,程党国,等.纯与掺杂CeO2的氧化还原性质及其催化领域的应用[J].化学进展,2008,20(7):1037-1043.
[26] 陈勇平.利用多糖制备无机纳米材料及其性能研究[D].南京:南京航空航天大学,2007.
[27] 奚丽荷,江海军,朱忠其,等.CeO2掺杂TiO2光催化剂的性能研究[J].功能材料,2007,38(7):1146-1148.
[28] 阳霞.纳米氧化镍的制备及其光催化降解水中有机染料的性能研究[D].武汉:武汉理工大学,2004.

