Eu3+对槲皮素与BSA相互作用的影响
张怀斌,张晓帆,李怀祥
(1.滨州医学院(烟台校区)药学院,山东 烟台 264003;2.山东师范大学化学化工与材料科学学院,山东 济南 250014)
血清白蛋白(Serum albumin,SA)是血浆中含量最丰富的载体蛋白[1]。牛血清白蛋白(BSA)因与人血清白蛋白(HSA)具有相似的结构,常被作为体外模型进行研究[2]。蛋白质分子中因含有色氨酸、酪氨酸和苯丙氨酸而产生内源性荧光,因此可为药物与血清白蛋白的结合作用研究提供有用的信息,为研究药物在体内的分布、药效的发挥等提供重要的依据[3,4]。
槲皮素(Quercetin,Que)是自然界广泛分布的一种黄酮类化合物,生物活性显著,具有抗氧化、抗癌、消炎及清除自由基等功效[5]。槲皮素与生物大分子的结合作用已成为研究者关注的焦点,其中针对Que与BSA的结合作用已有相关研究[3~9]。Que 结构中存在3-羟基-4-酮、3′,4′-二羟基、5-羟基-4-酮三个配位点,可与金属离子形成稳定的配位结构[3,4]。研究发现,Zn2+存在下Que与BSA的结合作用减弱;而吕鉴泉等[9]发现Ca2+能够使Que与BSA的结合作用增强。可见,不同金属离子对Que与BSA的结合作用会产生不同的影响。近年来稀土在农业、材料及生物医学等领域的应用日益广泛,稀土在应用过程中对生命体健康的影响成为人们关注的重点[10,11]。
荧光光谱是研究蛋白质与小分子作用的重要手段。当血清白蛋白与某些小分子结合后会导致荧光猝灭,其猝灭机制常根据Stern-Volmer方程[8,9,12]确定:
F0/F=1+KSVcq=1+Kqτ0cq
(1)
式中:F和F0分别为有、无猝灭剂时体系的荧光强度;KSV为Stern-Volmer猝灭常数;cq为猝灭剂的浓度;Kq为荧光猝灭速率常数;τ0为无猝灭剂时生物大分子的平均寿命(约为10-8s)。
在静态猝灭作用中,存在:
lg[(F0-F)/F]=lgKA+nlgcq
(2)
以lg[(F0-F)/F]对lgcq作图可求得蛋白质与小分子的结合常数KA及结合位点数n,当温度变化不大时,结合反应的焓变△H可看成一个常数,根据热力学公式(3)、(4)可求得结合作用的热力学参数[2,8]。
ln(K2/K1)=△H(1/T1-1/T2)/R
(3)
△G=△H-T△S=-RTlnK
(4)
鉴于此,作者以Que为药物小分子、BSA为药物作用的底物,采用荧光光谱、紫外吸收光谱、红外光谱研究稀土离子Eu3+对Que与BSA结合作用的影响,分析了Eu3+存在下结合作用减弱的原因,拟为其在生物医学领域的研究与应用提供有价值的信息。
1 实验
1.1 试剂与仪器
牛血清白蛋白(纯度>98%)、槲皮素(生化试剂),上海生物工程有限公司;Tris试剂、氯化钠、盐酸、氧化铕,均为分析纯;溶剂为二次去离子水。将氧化铕按化学反应剂量溶于盐酸中,配制成1.0×10-2mol·L-1的EuCl3溶液;用pH值为7.4的0.1 mol·L-1Tris-HCl缓冲溶液(内含0.05 mol·L-1NaCl维持离子强度)配制浓度为1.01×10-6mol·L-1的BSA溶液;配制浓度为1.1×10-4mol·L-1的甲醇水溶液(1∶1,体积比)。
LS-55型荧光分光光度计,美国Perkin Elmer公司;WQF-510 FTIR型傅立叶红外光谱仪,北京瑞利分析仪器公司;756PC型紫外可见分光光度计,上海光谱仪器有限公司;XW-80A型旋涡混合器,上海医大仪器厂;PHS-3C型酸度计,上海精密仪器有限公司;DK-S型两孔四列恒温水浴锅,烟台龙口先科仪器公司。
1.2 方法
1.2.1 荧光光谱测定
取3 mL BSA于石英比色皿中,分别加入不同量的Que(每次加入10 μL,加入总体积<100 μL,忽略体积对浓度的影响),固定激发波长为285 nm、荧光发射与激发狭缝宽度比为6∶8、扫描速率为500 nm·min-1,分别于温度为299 K、311 K时测定BSA 300~450 nm的发射光谱,记录350 nm处的荧光强度。
在上述溶液中维持Eu3+的浓度分别为1.0×10-6mol·L-1、1.0×10-5mol·L-1、1.0×10-4mol·L-1,重复上述步骤。
1.2.2 紫外光谱、红外光谱测定
在pH值为7.4的Tris-HCl介质中,测定Eu3+与Que摩尔比为0、1∶3、2∶3、3∶3时的紫外光谱。
Eu3+与Que以摩尔比2∶1混合,静置18 h,用去离子水反复洗涤、离心,干燥后测定红外光谱。
2 结果与讨论
2.1 Eu3+存在下,Que对BSA荧光猝灭的影响
图1A~D分别为Eu3+浓度为0 mol·L-1、1.0×10-6mol·L-1、1.0×10-5mol·L-1、1.0×10-4mol·L-1条件下,Que对BSA荧光光谱猝灭的影响。

cq(×10-8 mol·L-1),1~6:3.7,7.4,11.1,15.1,18.5,22.2
由图1A可知,BSA的最大发射峰位于350 nm处,随着Que浓度的增大,BSA的荧光强度有规律地降低,最大发射峰从350 nm蓝移至347 nm,BSA的峰形没有发生变化。表明Que与BSA之间发生了结合作用,但没有破坏BSA的发色团。BSA溶液中加入Eu3+后,随着Eu3+浓度的增大,BSA荧光光谱略有蓝移,当Eu3+浓度为1.0×10-4mol·L-1时蓝移0.9 nm(图1D)。Eu3+存在下Que对BSA的荧光猝灭程度减小,发射峰蓝移程度也减小,但峰形没有发生明显变化。说明Eu3+对Que与BSA的结合作用具有一定的影响。
根据Stern-Volmer方程作出Que对BSA荧光猝灭的Stern-Volmer曲线,如图2所示。
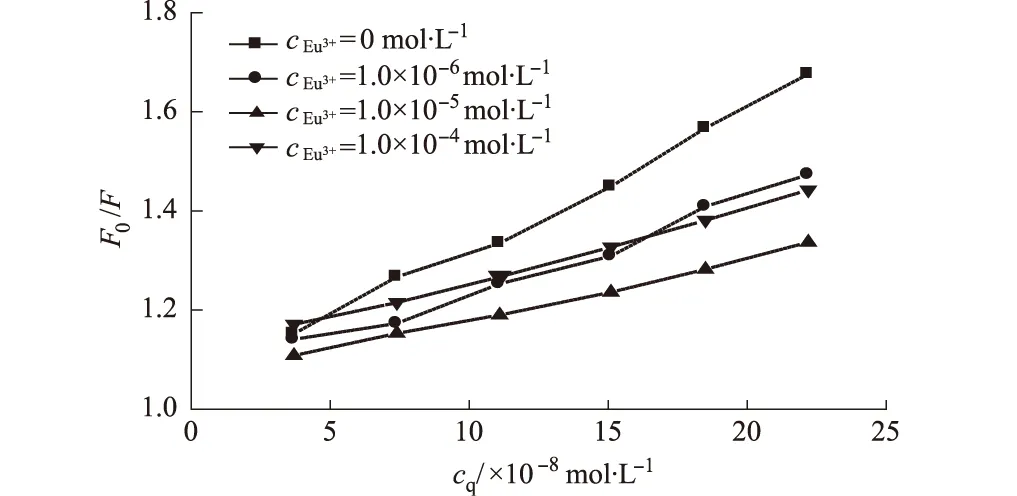
图2 Eu3+存在下,Que与BSA结合作用的Stern-Volmer曲线
由直线的斜率求出299 K时不同Eu3+浓度下Que对BSA的猝灭常数KSV和猝灭速率常数Kq,结果见表1。

表1 不同Eu3+浓度下,Que对BSA的猝灭常数及猝灭速率常数
由表1可以看出,Kq值均远大于动态扩散控制的猝灭速率常数1010L·mol-1·s-1[13],初步推测静态猝灭在整个猝灭过程中起主导作用;Eu3+的存在,使Que对BSA的猝灭作用减弱,但没有改变Que与BSA的作用机制。
动态猝灭随温度的升高,有效碰撞加剧,猝灭常数增大;静态猝灭则相反[13]。图3为299 K、311 K时Que与BSA结合作用的Stern-Volmer曲线。
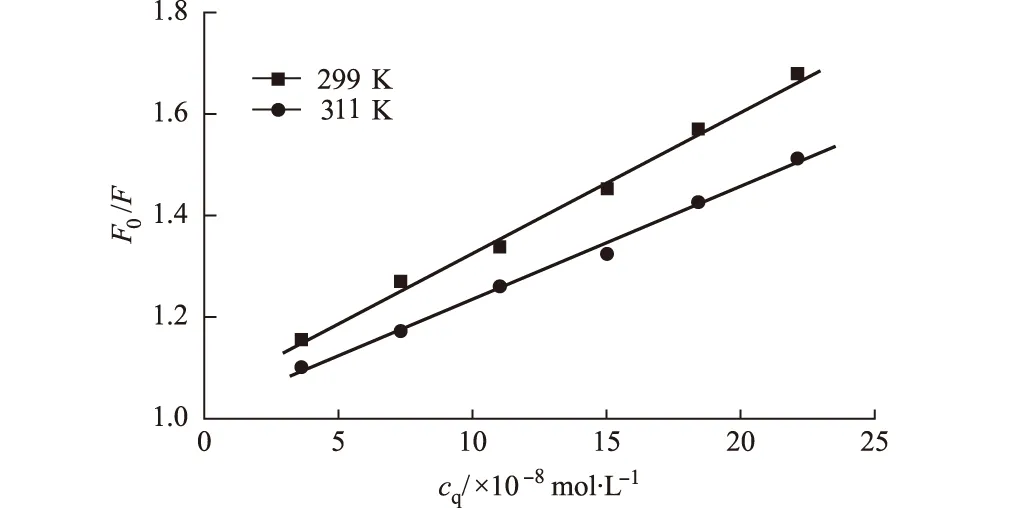
图3 不同温度下,Que与BSA结合作用的Stern-Volmer曲线
由图3可以看出,猝灭常数随温度升高而减小,进一步证明静态猝灭在整个过程中占主导作用。
2.2 Eu3+对Que与BSA结合作用及热力学参数的影响
以lg[(F0-F)/F]对lgcq作图,结果见图4;回归方程及299 K时Que与BSA的结合常数KA、结合位点数n、相关系数见表2;不同温度下的热力学参数见表3。
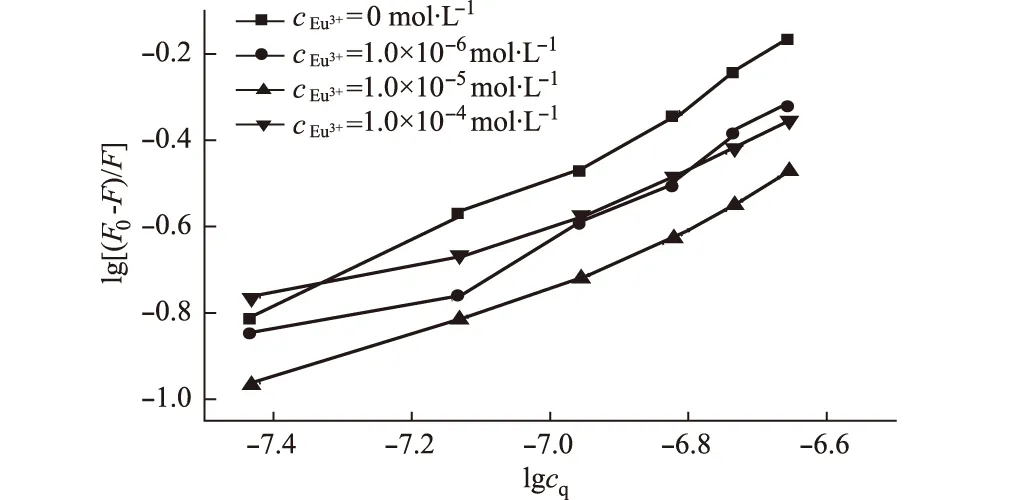
图4 lg[(F0-F)/F]与lgcq的关系
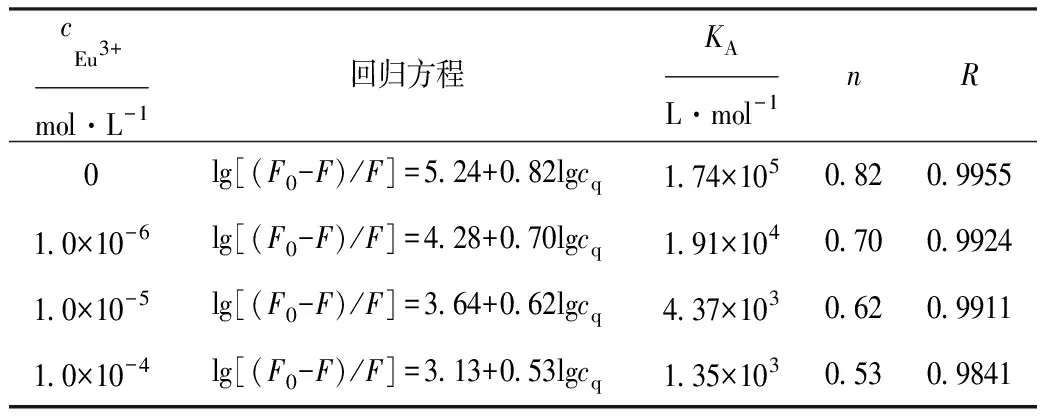
表2 不同Eu3+浓度下,Que与BSA结合的回归方程、结合常数、结合位点数及相关系数(T=299 K)
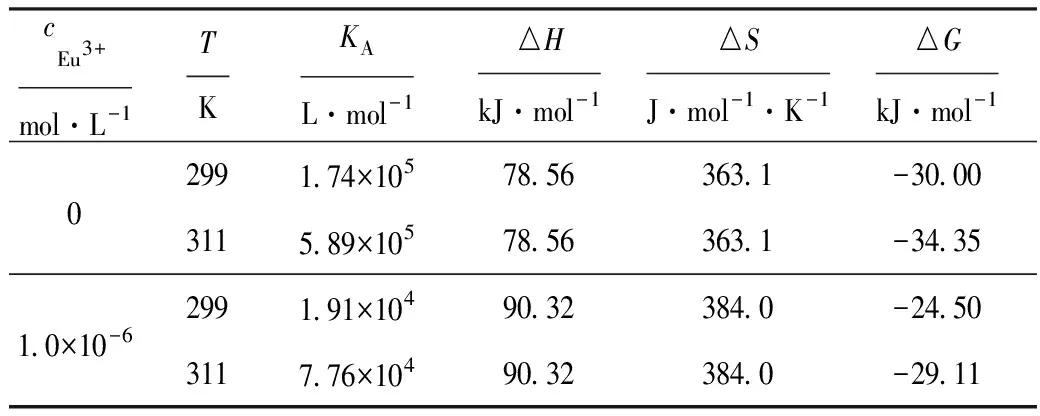
表3 不同温度下的热力学参数
由表2可以看出,随着Eu3+浓度的增大,Que与BSA的KA及n均逐渐减小,其相关系数也相应减小。说明Eu3+影响了Que与BSA的结合作用。
由表3可以看出,随着温度的升高,不管Eu3+是否存在,Que与BSA的结合常数KA均增大。
2.3 Eu3+存在下Que与BSA结合作用减弱的因素分析
Chen在研究Zn2+对Que与BSA结合作用的影响时指出[3,4]:Zn2+能够使BSA的发射峰显著蓝移及BSA与Que结合作用的猝灭速率常数增大、结合常数减小;Zn2+存在下Que与BSA的结合在很大程度上是Zn2+-Que与BSA的结合作用。而在本实验中,将Eu3+加入到BSA中,BSA的发射峰位置并未发生明显蓝移,当其浓度达到1.0×10-4mol·L-1时,仅蓝移0.9 nm,且Eu3+的存在使得Que对BSA作用时蓝移程度降低(图1)。Eu3+的存在,虽未改变Que对BSA的猝灭机制,但其猝灭常数、猝灭速率常数及结合常数均减小,这说明,Eu3+阻碍了Que与BSA的结合,并未参与协同猝灭。此外,从表2可知,体系中Eu3+浓度的增大,lg[(F0-F)/F]与lgcq之间的相关系数R减小;当Eu3+浓度为1.0×10-4mol·L-1时,R值较大地偏离1.000,这也进一步说明Eu3+的存在影响了Que与BSA的结合作用,当Eu3+浓度增大到一定程度时,有可能改变Que与BSA的作用机制。这些表明Eu3+对Que与BSA结合作用的影响与Zn2+相比有所差别。
Eu3+存在时Que与BSA的结合作用减弱,可能有如下几点原因:
(1)在pH=7.4时,BSA(等电点约为4.6)带有较多负电荷,Eu3+带有3个正电荷,Eu3+与BSA有较强的静电引力,在作用过程中有竞争作用,很大程度上限制了Que与BSA的结合。文献[11]中Eu3+与人血清白蛋白的结合常数为1012L·mol-1,而本实验中Que与BSA的结合常数为105L·mol-1,Eu3+与牛血清白蛋白的结合常数远远大于Que与BSA的结合常数,因此,在Eu3+、Que同时与BSA作用时产生竞争作用,使得Que与BSA的结合常数减小。
(2)Eu3+与BSA的结合及大量的Eu3+分散在BSA外侧,增大了Que与BSA之间的阻力,使二者的结合作用变得困难,要发生同样的作用需要更多的能量。从表3可知:△S>0,分子之间的相互作用力主要为疏水作用力;△G<0,反应可自发进行;△H>0,反应是吸热过程,温度升高有利于反应向正反应进行,因此结合常数随温度升高而增大[14]。Eu3+存在下改变了BSA的结构及微环境,△G虽然仍小于零,但与不存在时相比有所增大,自发进行反应的趋势降低,同时△H、△S有所增大,说明Que与BSA发生相同的变化需要吸收的热量更多,Eu3+存在时,反应熵驱动过程更明显。这进一步证实Eu3+的存在不利于Que与BSA的结合。
(3)有可能生成Eu3+-Que配合物,抑制Que与BSA的结合。Que在紫外区有2个吸收带,分别位于256 nm和375 nm[4]。从pH值为7.4的Tris-HCl介质中不同Eu3+与Que摩尔比的紫外光谱(图5)可以看出,256 nm和375 nm两吸收带分别红移到了290 nm和392 nm,并且在320 nm处出现一弱的吸收峰,这可能与介质溶液及Que的存在形式有关。随着Eu3+浓度的增大,290 nm和392 nm处吸收强度明显减弱,320 nm吸收带增强,290 nm和320 nm吸收带分别红移了4 nm和10 nm,460 nm处出现一新的吸收峰且吸收强度不断增大,在278 nm、352 nm、430 nm处出现3个等吸收点。上述结果显示,在pH值为7.4的Tris-HCl介质溶液中Eu3+与Que极易形成配位结构。
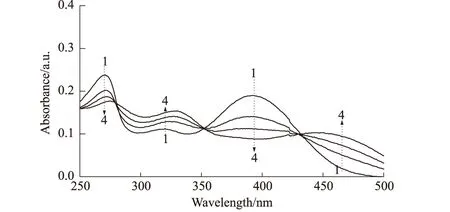
Eu3+ 与Que摩尔比,1~4:0、1∶3、2∶3、3∶3
Eu3+存在下Que的红外光谱(图6)中C=O振动峰、C-OH振动峰的消失均显示有配位结构的形成,进一步证实了Eu3+-Que配合物的生成。Eu3+与Que的结合降低了溶液中Que的浓度,同时Eu3+-Que配合物有可能抑制Que与BSA的作用,从而使得Que与BSA的结合作用减弱。

图6 Eu3+存在下Que的红外光谱
3 结论
在模拟动物体生理条件下,运用荧光光谱、紫外吸收光谱、红外光谱研究了Que与BSA的结合作用。结果表明,Que对BSA的荧光光谱具有猝灭作用,其猝灭机制为静态猝灭,Eu3+的存在使得BSA发射峰蓝移程度降低,猝灭常数、结合常数、结合位点数均减小,但没有改变Que与BSA的作用机制。在较大浓度Eu3+存在下,Que与BSA结合作用的相关系数减小。分析认为,Eu3+与Que在与BSA结合上存在竞争作用,Eu3+与BSA有较强的静电引力,过量的Eu3+分散在BSA外侧,增大了Que与BSA之间的阻力,要发生同样的反应吸收的热量更多;另外,在Que结构中存在配位点,可与金属离子形成稳定的配位结构,可能生成的Eu3+-Que配合物抑制了Que与BSA的结合。因此,Que与BSA的结合作用减弱是多种因素作用导致的。为研究Eu3+的生物医学效应及Eu3+存在下Que的药理、毒理作用提供了重要信息。
[1] Ercelen S,Klymchenko A S,Mely Y,et al.The binding of novel two-color fluorescence probe FA to serum albumins of different species[J].Int J Biol Macromol,2005,35(2):231-242.
[2] 吴刚珂,颜承农.荧光光谱法研究吲哚美辛与牛血清白蛋白结合作用的热力学特征[J].化学与生物工程,2009,26(9):36-40.
[3] CAO Shu-hong,JIANG Xin-yu,CHEN Jing-wen.Effect of zinc(Ⅱ) on the interactions of bovine serum albumin with flavonols bearing different number of hydroxyl substituent on B-ring[J].Journal of Inorganic Biochemistry,2010,104(2):146-152.
[4] 蒋新宇,李文秀,陈景文.锌离子存在下槲皮素、杨梅素与牛血清白蛋白的结合[J].无机化学学报,2008,24(9):1588-1595.
[5] 吕蔡,张杰.槲皮素的药理作用[J].国外医药·植物药分册,2005,20(3):108-112.
[6] Rawel H M,Meidtner K,Kroll J.Binding of selected phenolic compounds to proteins[J].J Agric Food Chem,2005,53(10):4228-4235.
[7] 陈代武,谢青季,蒋雪琴,等.槲皮素与酪蛋白和牛血清白蛋白的相互作用及共存碳纳米管的影响[J].物理化学学报,2008,24(3):379-387.
[8] 王春,吴秋华,王志,等.槲皮素与牛血清白蛋白相互作用的研究[J].光谱学与光谱分析,2006,26(9):1672-1675.
[9] 吕鉴泉,舒韵,周娟,等.荧光法研究钙离子存在下槲皮素与牛血清白蛋白的相互作用[J].化学与生物工程,2010,27(7):14-17.
[10] 倪嘉缵.稀土生物无机化学[M].北京:科学出版社,1995:172-197.
[11] 宋玉民,吴锦绣,郑秀荣,等.稀土金属离子与人血清白蛋白的相互作用[J].无机化学学报,2006,22(9):1615-1622.
[12] Kandagal P B,Seetharamappa J,Shaikh S M T,et al.Binding of trazodone hydrochloride with human serum albumin:A spectroscopic study[J].Journal of Photochemistry and Photobiology A:Chemistry,2007,185(2/3):239-244.
[13] 许金钩,王尊本.荧光分析法[M].北京:科学出版社,2006:64-85.
[14] Ross P D,Subramanian S.Thermodynamics of protein association reactions:Forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.

