耐热石油降解混合菌群的降解性能研究
李 政,赵朝成,张云波,刘春爽,赵东风
(中国石油大学(华东)化学化工学院,山东 青岛 266555)
随着石油工业的发展,石油污染日益严重[1]。大量研究表明,生物修复技术是迄今为止处理石油污染比较好的一种方法,具有广阔的发展前景[2]。目前已发现多个属的耐温菌(28~40 ℃)可利用原油或原油的某一组分为唯一碳源生长,较为常见的有红球菌属(Rhodococcus)[3]、假单胞菌属(Pseudomona)[4]、不动杆菌属(Acinetobacter)[5]等。但这类耐温石油降解菌无法满足极端环境如沙漠土壤、半干旱的炎热地区和堆肥反应体系的石油污染生物修复,因此很多学者开始研究降解原油的耐热菌属(40~80 ℃)。目前已报道的有嗜热嗜油杆菌属(Thermoleophilum)[6]、热微菌属(Thermomicrobium)[7]、芽孢杆菌属(Bacillus)[8]、地芽孢杆菌属(Geobacillus)[8]和栖热菌属(Thermus)[9]。耐热石油降解菌的研究多集中在对原油单一组分或原油轻质组分的降解方面[10,11],而耐热菌降解高浓度原油的相关研究较少。因此,针对石油污染的极端环境筛选获得高效耐热石油降解菌十分重要。
石油是一种复杂的混合物[12],其生物降解必须由不同种类、不同分工的微生物协同作用才能完成[13]。国内外相关研究大多以纯化后的单一石油降解菌株重组的复合菌为研究对象[14~16],但各菌投加量的变化以及相互间可能存在的抑制作用都会对复合菌的降解产生负面影响[17]。在被石油污染的土壤中存在着一系列经自然选择优化过的混合菌群[18,19],其中不同菌株的功能通过长期的演化稳定下来。混合菌群不但有较好的原油降解效果,而且有更好的商业前景[20],但相关报道还很少见。
作者从新疆克拉玛依油田石油污染土壤中筛选获得一组高效耐热石油降解混合菌群,考察了混合菌群的组成并探讨了其降解特性,以期为进一步拓展其石油污染极端环境的生物修复功能奠定基础。
1 实验
1.1 材料
从新疆克拉玛依油田红山嘴油田区、车排子油区、风城油区及百口泉油区原油处理污泥池、事故池、钻井泥浆池及泄油池附近采集石油污染土壤。采用棋盘式五点采样法,取浅层(0~20 cm)土壤,每点取样量基本一致,将各点取来的样品等量混合,密封备用。油样取自克拉玛依油田采油二厂采油井原油。
1.2 仪器
OIL-510型全自动红外分光测油仪,北京华夏科创仪器技术有限公司;HZQ-HA型水浴振荡器,哈尔滨东联电子技术开发有限公司;气相色谱-模拟蒸馏仪,美国瓦里安;KQ-400KDB型高功率数控超声波清洗仪,昆山超声仪器有限公司。
1.3 培养基
无机盐培养基(MSM)(g·L-1):Na2HPO40.6,KH2PO40.2,NaNO34.0,MgSO40.3,CaCl20.01,FeSO40.01,酵母膏 0.5,pH值7.2~7.4。
LB培养基(g·L-1):蛋白胨10.0,酵母浸出汁5.0,NaCl 5.0,琼脂20.0(固体培养基用),pH值7.2~7.4。
1.4 石油降解混合菌群的富集、筛选及组成
将5 g土样和1 g油样加到100 mL MSM中,于45 ℃、160 r·min-1摇床恒温培养5~7 d后,按5%接种量转接至新鲜培养基中继续富集培养,直至连续3次降解率稳定。用20%甘油保种,于低温冰箱保存。选择石油降解率最高的混合菌群用于后续实验。
将混合菌群稀释涂布,在平板上选择不同形态特征的菌落,挑取单菌落划线分纯,于LB固体培养基斜面保存。使用TIANGEN细菌基因组DNA提取试剂盒(天根生化科技有限公司)对单菌株进行基因组DNA提取,以细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增,送至上海生工生物公司进行测序。测序结果在GenBank上与已知的16S rDNA进行BLAST比对,确定其菌属。
1.5 石油降解混合菌群的降解性能研究
将培养至对数期后期的混合菌群按5%接种量接种到原油浓度为10 g·L-1的100 mL MSM中,分别考察培养时间、氮磷比、初始pH值、原油浓度、表面活性剂浓度对原油降解率的影响。
1.6 降解原油组分分析
运用气相色谱-模拟蒸馏仪分析降解前后原油组分,操作条件:进样量1 μL;分流比(1∶2);毛细管柱为CP5960柱(5 m×0.53 mm,0.25 μm);柱温:初温35 ℃,保持2 min,10 ℃·min-1程序升温至350 ℃,保持10 min;载气为N2;程序升温:进样口温度20 ℃,保持0.1 min,以175 ℃·min-1程序升温,终止温度350 ℃;检测器温度350 ℃。
1.7 含油量的测定
对《水质、石油类和动植物油的测定-红外光度法》(GB/T 16488-1996)稍做改进,采用红外分光测油仪测定原油无机盐培养基中的含油量。培养基中的原油经混合菌群降解后变为微小絮体,萃取液通过铺有无水Na2SO4的玻璃砂芯漏斗脱水时极易堵塞,因此采用循环水式真空泵将萃取液抽入抽滤瓶中。同时,为了保证脱水效果,将无水Na2SO4的厚度加大,由标准中的10 mm改为15 mm。
2 结果与讨论
2.1 耐热石油降解混合菌群的筛选及其组成
从64个土样中筛选获得6组以原油为唯一碳源的耐热石油降解混合菌群,其对原油(10 g·L-1)的降解现象及降解率见表1。

表1 混合菌群对原油的降解现象及降解率
降解后菌群所在培养基溶液浑浊且颜色逐渐变淡者对应的原油降解率相对较高。由表1可知,KLO-8降解效果优于其它5组混合菌群,对浓度为10 g·L-1的原油的降解率达到55.6%。
采用稀释涂布法从培养至对数期后期的混合菌群KLO-8(5.0×1010个·mL-1)中分离获得4株菌落形态互异的单菌,分别编号为A、B、C、D。16S rDNA测序结果经BLAST软件与GenBank中已发表的16S rDNA序列进行同源性比较,结果见表2。
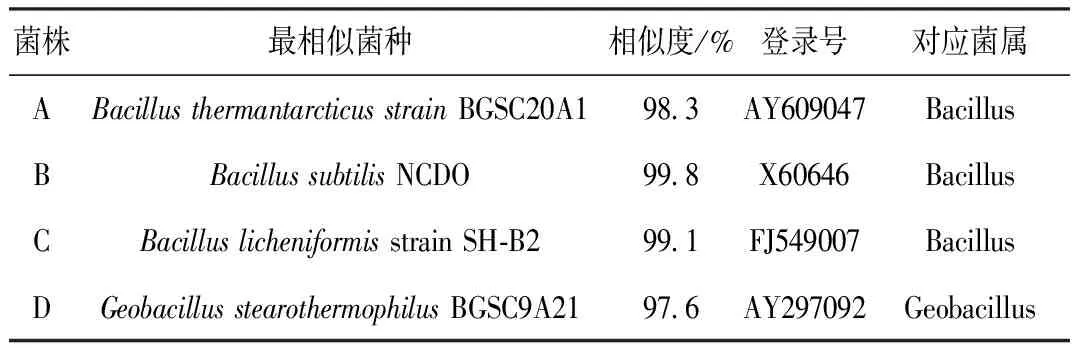
表2 16S rDNA片段序列比对信息
由表2可知,菌株A、B、C属于芽孢杆菌(Bacillussp.)、菌株D为地芽孢杆菌(Geobacillussp.),均为耐热菌[8]。
2.2 KLO-8最适生长温度和最高耐受温度的考察
温度对石油降解菌的生长影响显著。研究表明[21],温度较低时,原油粘度较大,有毒短链烷烃挥发性较差,微生物启动滞后;随着温度的升高,烃的代谢率上升;温度继续升高,烃的膜毒性增大,微生物活性降低。此外,微生物的酶活性在一定温度范围内才能发挥作用,不同微生物有不同的适宜生长温度。将KLO-8分别在30 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃条件下160 r·min-1培养7 d,测定其对原油的降解效果,结果如图1所示。
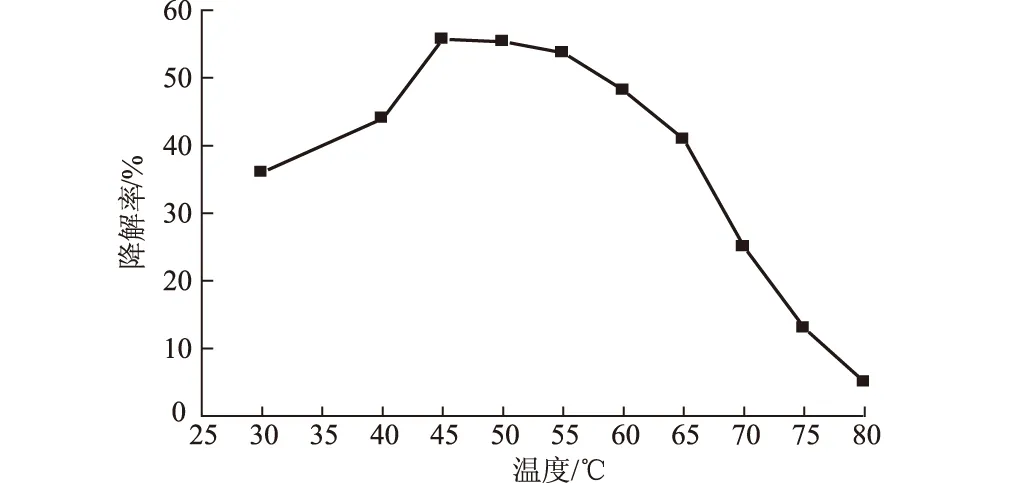
图1 温度对原油降解率的影响
由图1可知,KLO-8在45~55 ℃之间降解效果较好,原油降解率均在55%以上,其中45 ℃时原油降解率达到最高,为55.71%;在70 ℃时仍有一定的降解效果,降解率为25%;温度超过75 ℃,原油几乎未被降解,显微镜观察无游动菌体,推断KLO-8在此高温下基本丧失活性。因此,混合菌群KLO-8在原油中的最适生长温度为45~55 ℃、最高耐受温度为75 ℃。
2.3 KLO-8的降解性能研究
2.3.1 培养时间的影响
KLO-8在45 ℃、160 r·min-1条件下,分别培养3 d、5 d、7 d、9 d、11 d、13 d、15 d,测定其对原油的降解效果,结果如图2所示。

图2 培养时间对原油降解率的影响
由图2可知,KLO-8在培养3~7 d时对原油的降解速率最大,此时微生物已经适应周围的培养环境,原油中易被降解的组分含量较高,降解菌得以迅速生长繁殖;此后随着培养时间的延长,KLO-8对原油的降解速率逐渐降低,说明残油组分越来越难以被KLO-8利用,并有可能对其形成抑制。因此,混合菌群KLO-8的最佳培养时间为7 d。
2.3.2 氮磷比的影响
氮、磷是微生物生长的必需元素,也是影响石油降解菌降解效率的重要营养物质。将KLO-8接种于氮磷比分别为1∶1、2∶1、3∶1、5∶1、7∶1、9∶1的MSM中,在原油浓度为10 g·L-1、pH值为8、45 ℃、160 r·min-1条件下培养7 d,测定其对原油的降解效果,结果如图3所示。
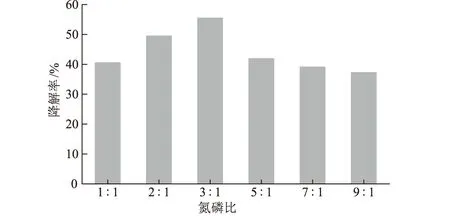
图3 氮磷比对原油降解率的影响
由图3可知,随着氮磷比的增大,原油降解率呈上升趋势;当氮磷比为3∶1时,降解效果较好,摇瓶中基本没有浮油,降解率达到最高;随着氮磷比的继续增大,降解率开始下降。这表明,微生物的生长与氮磷营养盐的量存在最佳的匹配值,混合菌群KLO-8的最佳氮磷比为3∶1。
2.3.3 初始pH值的影响
选取初始pH值分别为5、6、7、8、9、10的MSM,在原油浓度为10 g·L-1、45 ℃、160 r·min-1条件下培养7 d,测定混合菌群KLO-8对原油的降解效果,结果如图4所示。
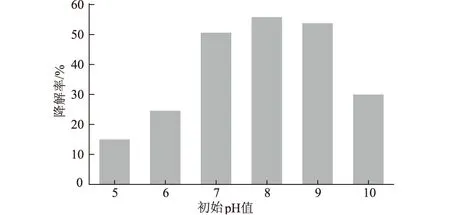
图4 初始pH值对原油降解率的影响
由图4可知,KLO-8在碱性条件下对原油的降解能力强于酸性条件下的降解能力,这与克拉玛依油田土壤偏碱性有关。KLO-8在pH值8附近降解率达到最大,为55.82%。这是因为,pH值过低时,氢离子浓度超过微生物酶的适应范围,使微生物原生质膜的电荷改变;而pH值过高又会对降解菌的生长和降解酶的分泌产生不利影响,最终影响微生物对营养物质的吸收和酶的活性。因此,混合菌群KLO-8生长的最佳初始pH值为8。
2.3.4 原油浓度的影响
在以上优化条件下,将KLO-8分别在原油浓度为2 g·L-1、4 g·L-1、6 g·L-1、8 g·L-1、10 g·L-1、12 g·L-1、14 g·L-1、16 g·L-1下培养7 d,以考察原油浓度对降解效果的影响,结果见图5。
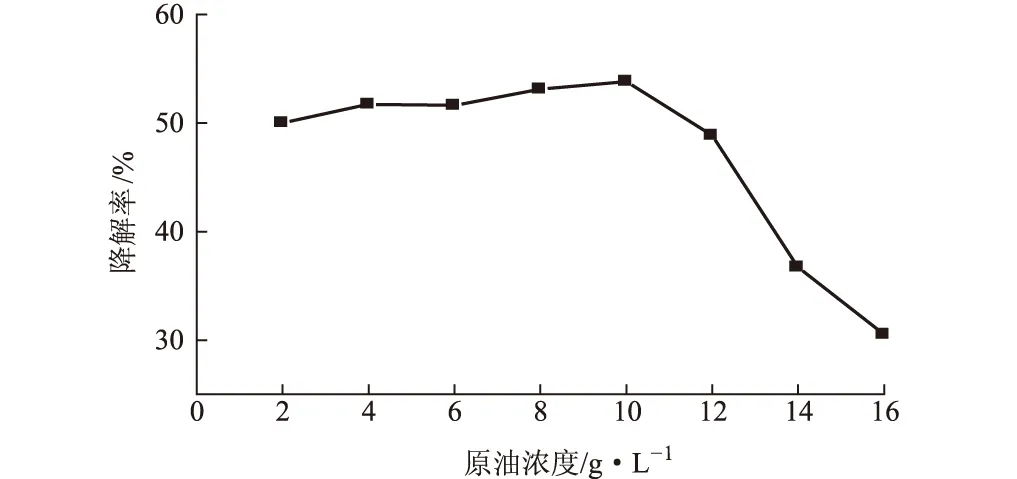
图5 原油浓度对原油降解率的影响
由图5可知,当原油浓度低于10 g·L-1时,KLO-8对原油有较好的降解效果,降解率均在50%以上;当原油浓度高于10 g·L-1时,培养基表层的油膜厚度增大,影响氧气的传递,使得KLO-8因缺氧而无法生长繁殖,并且原油浓度过高会对KLO-8产生毒害作用,还会导致碳氮磷比例失衡,氮磷浓度相对不足,不能满足微生物降解原油的需要,均使得原油降解率大幅降低。因此,混合菌群KLO-8的适宜原油浓度不高于10 g·L-1。
2.3.5 表面活性剂浓度的影响
表面活性剂具有亲水和亲油基团,可以促进石油乳化,防止油水之间的相互排斥,并具有使其相互作用的功能。阴离子表面活性剂的加入能够改进憎水性有机化合物的亲水性和生物可利用性,有利于微生物降解碳氢化合物。在MSM中加入十二烷基苯磺酸钠,浓度分别为0 mg·L-1、50 mg·L-1、100 mg·L-1、200 mg·L-1、300 mg·L-1、400 mg·L-1,在原油浓度为10 g·L-1、pH值为8、氮磷比为3∶1、45 ℃、160 r·min-1条件下培养7 d,测定混合菌群KLO-8对原油的降解效果,结果如图6所示。

图6 表面活性剂浓度对原油降解率的影响
由图6可知,添加一定浓度的阴离子表面活性剂十二烷基苯磺酸钠对原油降解有促进作用。当添加浓度为50 mg·L-1时,KLO-8对原油的降解率提高19.1%,但随着表面活性剂浓度的增加降解效果明显下降。这说明十二烷基苯磺酸钠的毒性作用虽然相对较小,但含量过高时仍会对混合菌群的生长和活性产生抑制作用,从而影响培养基中原油的降解。因此,十二烷基苯磺酸钠的最佳添加浓度为50 mg·L-1。
2.4 混合菌群降解原油组分分析
运用气相色谱-模拟蒸馏仪分析降解前后原油中的正构烷烃,结果如图7、图8所示。
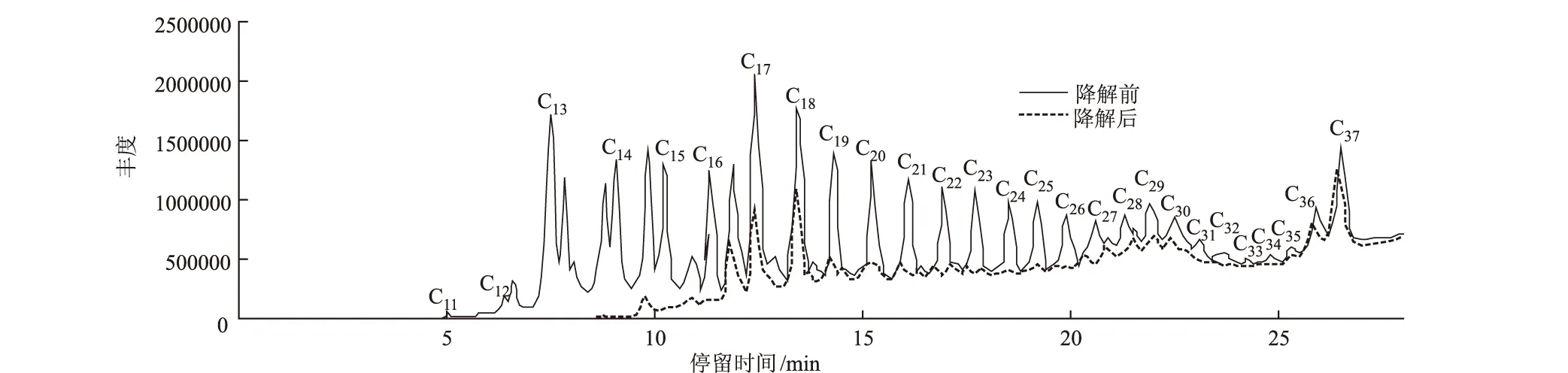
图7 降解前后原油组分气相色谱图
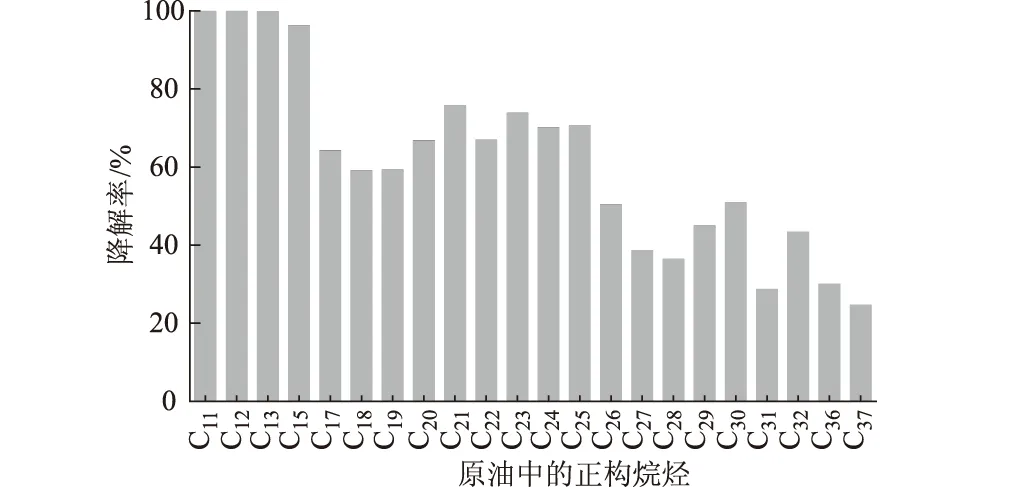
图8 原油中正构烷烃的降解
由图7、图8可知:(1)KLO-8能够利用原油中C11~C37的正构烷烃,并且随着碳原子数的增加对原油中正构烷烃的利用率降低;(2)高温灭菌及样品处理过程中轻组分丢失导致原油中C11之前的组分未显示;(3)短链烷烃C11~C15几乎全部被利用,降解率在95%以上;(4)C17~C19间组分的降解效果较差,原因在于其在降解前原油中含量相对较高,并且高分子量组分的降解可能会导致C17~C19的积累;(5)C20~C25的降解效果较好,降解率在65%以上;(6)KLO-8能够利用长链烷烃,C37降解率为24.75%;(7)降解后原油中C14、C16、C33、C34和C35没有显示,原因可能是这些组分异构化,仪器检测不出。
3 结论
(1)从克拉玛依油田石油污染土壤64个样品中筛选获得6组耐热石油降解混合菌群,其中KLO-8对原油的降解效果最佳,对浓度为10 g·L-1的原油的降解率达到55.6%。KLO-8包含4株耐热降油菌,16S rDNA序列分析鉴定表明其中3株为芽孢杆菌(Bacillussp.)、1株为地芽孢杆菌(Geobacillussp.)。KLO-8最适生长温度为45~55 ℃、最高耐受温度为75 ℃。
(2)通过单因子实验考察了培养时间、氮磷比、初始pH值、原油浓度和表面活性剂浓度对KLO-8降解特性的影响。结果表明:最佳培养时间为7 d;最佳氮磷比为3∶1;初始pH值偏碱性更利于原油的降解,最佳初始pH值为8;原油浓度不高于10 g·L-1时降解效果较好;添加表面活性剂(十二烷基苯磺酸钠)能够提高降解效果,最佳添加浓度为50 mg·L-1。
(3)运用气相色谱-模拟蒸馏仪分析KLO-8对原油中正构烷烃的降解,结果表明混合菌群对C11~C37之间的正构烷烃均有一定的降解效果,随着碳原子数的增加KLO-8对原油中正构烷烃的利用率逐渐降低。其中C11~C15的组分几乎全部降解,长链烷烃C37降解率为24.75%。
[1] 刘国良,苏幼明,顾书敏,等.石油污染土壤生物修复研究新进展[J].化学与生物工程,2008,25(8):1-4.
[2] 冯晋阳,吴小宁.共基质对优势菌降解原油的作用研究[J].环境科学与技术,2009,32(3):57-61.
[3] Kunihiro N,Haruki M,Takano K,et al.Isolation and characterization ofRhodococcussp.strains TMP2 and T12 that degrade 2,6,10,14-tetramethylpentadecane (pristane) at moderately low temperatures[J].Journal of Biotechnology,2005,115(2):129-136.
[4] 徐金兰,黄廷林,唐智新,等.石油污染土壤生物修复高效菌的降解特性[J].石油学报(石油加工),2009,25(4):570-576.
[5] Throne-Holst M,Wentzel A,Ellingsen T E,et al.Identification of novel genes involved in long-chainn-alkane degradation byAcinetobactersp.strain DSM17874[J].Applied and Environmental Microbiology,2007,73(10):3327-3332.
[6] Zarilla K A,Perry J J.Thermoleophilumalbumgen.nov.and sp.nov.,a bacterium obligate for thermophily andn-alkane substrates[J].Archives of Microbiology,1984,137(4):286-290.
[7] Phillips W E,Perry J J.Thermomicrobiumfosterisp.nov.,a hydrocarbon-utilizing obligate thermophile[J].International Journal of Systematic and Evolutionary Microbiology,1976,26(2):220-225.
[8] Meintanis C,Chalkou K I,Kormas K A,et al.Biodegradation of crude oil by thermophilic bacteria isolated from a volcano island[J].Biodegradation,2006,17(2):105-111.
[9] Hao R X,Lu A H,Wang G Y.Crude-oil-degrading thermophilic bacterium isolated from an oilfield[J].Canadian Journal Microbiology,2004,50(3):175-182.
[10] Kato T,Haruki M,Imanaka T,et al.Isolation and characterization of long-chain-alkane degradingBacillusthermoleovoransfrom deep subterranean petroleum reservoirs[J].Journal of Bioscience and Bioengineering,2001,91(1):64-70.
[11] Sorkhoh N A,Ibrahim A S,Ghannoum M A,et al.High-temperature hydrocarbon degradation byBacillusstearothermophilusfrom oil-polluted Kuwaiti desert[J].Applied Microbiology and Biotechnology,1993,39(1):123-126.
[12] 余素林,赵桂芳,刘芳,等.石油污染土壤微生物治理技术发展方向[J].中国农业科技导报,2007,9(4):55-60.
[13] Nakamura S,Sakamoto Y,Ishiyama M,et al.Characterization of two oil-degrading bacterial groups in the Nakhodka oil spill[J].International Biodeterioration & Biodegradation,2007,60(3):202-207.
[14] 梁生康,王修林,汪卫东,等.高效石油降解菌的筛选及其在油田废水深度处理中的应用[J].化工环保,2004,24(1):41-46.
[15] Díaz-Ramírez I J,Escalante-Espinosa E,Favela-Torres E,et al.Design of bacterial defined mixed cultures for biodegradation of specific crude oil fractions,using population dynamics analysis by DGGE[J].International Biodeterioration & Biodegradation,2008,62(1):21-30.
[16] 管亚军,梁凤来,张心平,等.混合菌群对原油的降解作用[J].南开大学学报(自然科学版),2001,34(4):82-85.
[17] 谢丹平,尹华,彭辉,等.混合菌对石油的降解[J].应用与环境生物学报,2004,10(2):210-214.
[18] 叶淑红,丁鸣,马达,等.微生物修复辽东湾油污染湿地研究[J].环境科学,2005,26(5):143-146.
[19] Sorkhoh N A,al-Hasan R H,Khanafer M,et al.Establishment of oil-degrading bacteria associated with cyanobacteria in oil-polluted soil[J].Journal of Applied Bacteriology,1995,78(2):194-199.
[20] Nadarajah N,Singh A,Ward O P.De-emulsification of petroleum oil emulsion by a mixed bacterial culture[J].Process Biochemistry,2002,37(10):1135-1141.
[21] 金文标,宋莉晖,董晓利.盐度对油污土壤生物治理的影响研究[J].钻采工艺,1998,21(4):71-72.

