人非小细胞肺癌细胞的原代培养及个体化药敏实验研究
刘 浩 洪志鹏 尹小川 唐睿珠 郝 萍
肺癌(lung cancer)是人类最常见的恶性肿瘤之一。其中,80%的肺癌是非小细胞肺癌(non-small cell lung cancer,NSCLC),而1/3的NSCLC病人就诊时已属晚期(Ⅲ、Ⅳ期),近年来NSCLC的发病率持续升高,尤其是非吸烟人群中的妇女,其肺腺癌的发病率及细支气管肺泡癌的发病率令人担忧,其分子流行病学的原因尚未清楚,因此目前更加令人关注的是对NSCLC的治疗。其中,化疗在晚期NSCLC治疗中起着重要作用。如何选择对NSCLC有效的化疗药物,提高术后化疗效果,并寻找用药规律,一直是临床肿瘤化疗关注的问题。个体化化疗是21世纪胸外科临床发展的方向和理想的治疗模式。我们采用MTT法对30例NSCLC进行体外原代细胞培养和药物持续作用观察,检测其对5种化疗药物(长春瑞滨、依托泊苷、长春新碱、吉西他滨、多西他赛)的敏感性,并进行比较,希望能通过本课题的研究为肺癌个体化化疗敏感药物的选择提供参考。
材料与方法
一、实验材料
1.肺癌细胞
30例手术标本来自昆明医学院附属第一医院胸外科,病理确诊为NSCLC。肺腺癌14例、肺鳞癌16例。其中,男性患者17例,女性患者13例,年龄36~68.岁,平均年龄51岁。
2.化疗药物
我们结合当前实际及常用化疗方案从中选用五种化疗药,四种一线药物长春瑞滨(NVP)、依托泊苷(VP-16)、长春新碱(VCR)、吉西他滨(GEM)以及一种二线药物多西他赛(TAX)。试验药物浓度即峰浓度(μg/mL)=(mg×平均体表面积/平均体重)×(100/60)其中mg为临床用药剂量(mg.kg-1.d-1),国内大多数教科书介绍体表面积的计算公式是:
SA=0.035W+0.1(W≤30)
1.05+(W-30)×0.02(W >30)
SA为人体表面积(m2);W为体重(kg);按照平均体重60 kg计算,平均体表面积为1.65。化疗药物配制浓度及产地,见表1。
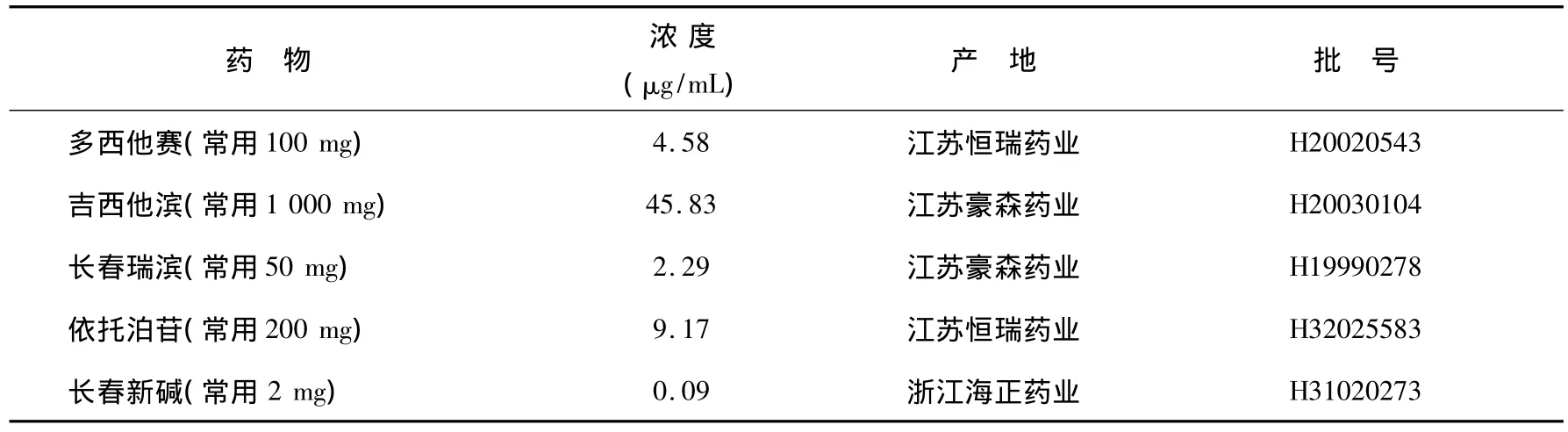
表1 化疗药物配制浓度及产地Table 1 Confected concentration and origin of chemotherapeutics
3.主要试剂与仪器
RPMI-1640(美国Gibco公司);胰蛋白酶(美国Amresco公司);淋巴细胞分离液:(天津市秀鹏生物技术开发有限公司);小牛血清:(杭州四季青生物工程材料有限公司);MTT(四甲基氮唑蓝):(美国Amresco公司);DMSO:二甲基亚砜,分析纯(美国Sigma公司);离心机(LXJ-II,TGL-16B,上海医用分析仪器厂);超低温冰箱(KK24E18TI,SIEMENS);电子天平(BP121S,Sartorius);CO2培养箱(HF240,Shanghai Lishen Scientific Equipment CO.Ltd);倒置光学显微镜(南京江南永新光学有限公司);96孔细胞培养板(Costar公司);酶联免疫检测仪((SYNTRON-MPR-2100,Thermo Labsystem公司);电热恒温水温箱(上海医疗器械七厂);蠕动泵(MILLPORE公司);微量振荡器(MH-1型,江苏海门市其林贝尔仪器制造有限公司)。
二、研究方法
1.制备单细胞悬液
取手术切除的新鲜癌组织约1.0 cm3大小,选取无坏死部分,尽量剔除纤维组织及黑色颗粒,立即浸入无菌培养瓶中,尽可能短时间(10 min内)转运至实验室。在超净台上,用无菌PBS液冲洗2次,无菌切除组织包膜,结缔组织与坏死组织,剪成尽可能小的组织碎块,大小约1 mm3。将组织小块置于0.25%胰酶40 mL中,装入培养瓶,置于37℃水浴箱中30 min,并不时摇动,使其充分消化,期间在镜下观察,当细胞变圆接近脱壁时,弃消化液,用10 mL完全-1640终止消化。用200目筛网将消化后的细胞悬液过滤收集,用无菌PBS液洗涤2次(离心,1500 r/min),悬于20 mL完全-1640中,镜下观察细胞。于无菌离心管中依次轻轻加入100%及60%的淋巴细胞分离液各10 mL,其上再沿管壁轻轻加入细胞悬液(离心,2000 r/min,20 min),收集60%分离液界面上的细胞,加5倍无菌PBS液(离心,2000 r/min,20 min),去上清,加15 mL无菌PBS液,离心前进行细胞计数,再次离心,2000 r/min,20 min,去上清,调整细胞浓度为1×105/mL ~2×105/mL。
2.实验方法
种96孔板,分设加药孔,阴性对照孔,空白孔,设3复孔。加药孔与阴性对照孔,每孔100 μL细胞悬液,空白孔每孔100 μL完全 -1640,最后每孔补加100 μL完全 -1640,每孔终体积为200 μL。在37℃、5%CO2培养箱培养24 h。加化疗药,加药孔加20 μL化疗药,阴性对照孔加20 μL完全-1640,空白孔加20 μL完全-1640。将96孔培养板密封后继续放入培养箱中培养,观察48 h。每孔加入5 mg/mL的MTT20 μL,继续培养4 h。吸去上清后,每孔加入二甲基亚砜150 μL,混匀,振荡培养板10 min,使孔中沉淀完全溶解。在酶联免疫检测仪上,以空白孔较0,以490 nm为测量波长,690 nm为参考波长,测每孔吸光度值(A值)。
计算活性抑制率:活性抑制率=(阴性对照组A值-加药组A值)/阴性对照组A值×100%。当加药组血浆高峰浓度水平时的抑制率大于50%时,即为高敏,小于30%为耐药,介于两者之间为中敏。
3.统计学方法
数据采用SPSS13.0软件处理分析,统计学方法采用完全随机设计行×列表资料χ2检验,组间比较用四格表的确切概率法,P<0.05为差异具有统计学意义。
结 果
本实验对30例非小细胞肺癌患者的癌细胞进行了体外药物敏感性测定,结合当前临床实际选用了5种化疗药,每种化疗药对非小细胞肺癌抑制率顺序依次为TAX>GEM>NVB>VP-16>VCR(表2),其总敏感率分别为100%、99%、62%、51%、32%,而高度敏感的敏感率分别为72%、63%、39%、35%、20%(表3),提示肺癌对上述5种药物均敏感。采用完全随机设计行×列表资料的χ2检验分析表3,P<0.05,差异具有统计学意义。采用四格表的确切概率法进行两两比较,TAX和GEM治疗NSCLC的有效率基本相同,可做为首选;而NVB、VP-16、VCR三药两两比较,NVB与VP-16的有效率基本相同,VP-16与VCR的有效率基本相同,其中NVP的有效率高于VCR,VCR的高度敏感率不足30%,提示VCR治疗效果差,。故治疗NSCLC时应首选TAX和GEM与铂类药物组合。五种化疗药对NSCLC的抑制率比较及治疗NSCLC的敏感性比较分别见表2和表3。
讨 论
肺癌是全球发病率和病死率最高的恶性肿瘤,约占所有肿瘤的12.4%,且发病率一直呈上升趋势。近年来,虽然医疗诊治水平有了较大的提升,但5年生存率仍不高[1]。中国预防医学科学院卫生信息中心公布,在21世纪,肺癌将成为中国居民的主要死因,肺癌将主导中国癌症流行趋势。而云南作为我国农民肺癌高发地区,尤其女性肺癌病死率居全国首位,对肺癌的综合治疗显得尤为重要。
临床对肺癌的化疗多凭经验给药,而公式化的治疗往往具有盲目性,造成多药耐药,不良反应大,疗效不佳的效果。有实验结果证实[2],用药敏试验结果指导临床用药治疗的有效率要明显高于不做药敏试验,凭经验给药的对照组。
为进行NSCLC的个体化药敏实验研究,我们选择了NSCLC细胞的原代培养,通过该方法获得NSCLC细胞。这是本实验成功的关键。我们总结几点主要注意事项如下:①病例入选标准为患者年龄越小越好,最好选择60岁以下的患者,以保证细胞的活力;尽可能地选择无其他合并疾病特别是传染病的患者,将细胞的污染机会降到最低;取材时应保证无菌,避开纤维组织和坏死部位,如果肿瘤较大,最好取肿瘤的外周部分;②实验前做到杜绝一切可能的污染是成功的关键;③取材后最好在30 min内(最佳为10 min)送到实验室开始实验,这样可以最大限度保证细胞的活力和数量;④肿瘤细胞的培养方法我们选择酶消化法,该种方法可以将妨碍细胞生长的细胞间质包括基质、纤维等去除,使细胞分散,形成悬液,易于从外界吸收养分和排除代谢产物,可以很快得到大量活细胞,细胞也可能在短时间内生长成片。同时我们采用淋巴细胞分离液密度梯度离心法分离纯化肺癌细胞悬液,有文献[3]证明采用梯度离心法收集纯化癌细胞后再行MTT药敏试验,比传统的方法药敏阳性率有显著提高(P<0.01),实验收到了预期的效果。
20世纪80年代中期开始MTT法药敏试验首先应用于急性白血病的治疗中,指导临床用药,取得了良好的相关性和疗效[4]。目前已逐步应用到肺癌、卵巢癌、肝癌、乳腺癌等实体肿瘤的治疗中,结果提高了药物的选择性,提高了化疗质量和化疗个体化效果[5-8]。目前,该方法已广泛应用于一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等。MTT法的特点是灵敏度高、重复性好、经济、快速、易自动化、无放射性污染、与其他体外药物敏感试验方法(如细胞计数法、软琼脂克隆形成试验和3H-TdR掺入试验等)相比操作较简单、实验误差减少,并且与临床化疗疗效有较好的一致性[9],利于临床应用,但尚存一些不足,有待克服。

表2 五种化疗药对NSCLC的抑制率比较Table 2 Comparison of inhibition ratio of five chemotherapeutics on NSCLC

表3 五种化疗药治疗NSCLC的敏感性比较Table 3 Comparison of sensitivity among five chemotherapy agents on the treatment of NSCLC
肿瘤是一个异质性、多形态、分化程度不等的细胞群体。肿瘤对各种化疗药物的敏感性存在着明显个体差异。即不同的肿瘤类型或同一类型的不同病人,甚至同一病人在不同的发病阶段,对化疗的敏感性并不完全相同,治疗效果差别也很大。至今还没有一种化疗药物或几种化疗药物的联合应用,能对某一种肿瘤 100% 有效[10,11]。
综上所述,本课题之肺癌细胞原代培养的方法可获得药敏实验所需的肺癌细胞。MTT法在原代肺癌细胞药物敏感性试验研究中值得推广,可在基层医院普及。30例非小细胞肺癌细胞对多西他赛与吉西他滨最敏感,可作为临床治疗NSCLC首选之一,该实验方法也可作为NSCLC个体化治疗的选择之一。通过本课题的研究能为临床NSCLC个体化化疗提供参考。
1 Parking M,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
2 高 隆,霍润辉.肺癌体外药敏试验与临床疗效的相关性[J].第四军医大学学报,2003,24(23):2203-2204.GAO Long,HUO Run-hui.The relevance between fungi susceptibility test in vitro and treatment response of lung cancer[J].J Four Milit Med Univ,2003,24(23):2203-2204.
3 谢晓东,李小民,蒋 芹,等.改良MTT法原代癌细胞培养药物敏感性试验的实验研究[J].陕西肿瘤医学,2001,9(4):230-232.XIE Xiao-dong,LI Xiao-min,JIANG Qin,et al.Experimental Study on the cancer cell primary culture fungal susceptibility test of improved MTT method[J].Shanxi Oncol Med,2001,9(4):230-232.
4 贾庆瑞.MTT比色分析法在白血病细胞药物敏感性测定中的应用[J].肿瘤防治研究,1992,19(3):163-164.JIA Qing-rui.The application of Method MTT colorimetric assay on leukemia cell fungal susceptibility test[J].Cancer Res Prev Treat,1992,19(3):163-164.
5 Kusumoto T,Sakaguchi Y,Machara Y,et al.Comparisgn of in vitro anticancer chemosensitivity between human squamous cell carcinoma and adenocarcinoma[J].Oncology,1992,49(5):343-346.
6 Yamaue H,Tanimura H,Tsunoda T,et al.Chemosensitivity testing with highly purified fresh human tumour cells with the MTT colormetric assay[J].Eur J Cancer Chin Oncol,1991,27(10):1258-1263.
7 张翠卿,唐东平,佐传田,等.MTT法在非小细胞肺癌优化治疗方案中的应用[J].现代肿瘤医学,2007,15(11):1566-1568.ZHANG Cui-qing,TANG Dong-ping,ZUO Chuan-tian,et al.The application of MTT method on optimize therapeutic scheme of non-small cell lung cancer[J].Mod Oncol,2007,15(11):1566-1568.
8 辛华雯,王润帮.MTT法在恶性肿瘤体外药物敏感试验中的临床应用[J].实用癌症杂志,1994,9(2):73-75.XIN Hua-wen,WANG Run-bang.The clinical application of MTT method on fungi susceptibility test in vitro of malignant tumour[J].Pract J Cancer,1994,9(2):73-75.
9 Sargent JM.The use of the MTT assay to study drug resistance in fresh tumour samp les[J].Recent Results Cancer Res,2003,161:13-25.
10 张银霞.肿瘤药敏试验方法及临床应用[J].医学综述,2003,9(1):34-35.ZHANG Yin-xia.The method and clinical application of tumor fungi susceptibility test in vitro[J].Med Recapit,2003,9(1):34-35.
11 刘 敏,吕 鹏,于志红,等.消化道癌原代培养体外药敏实验的研究[J].中国微生态,2006,18(6):468-470.LIU Min,LV Peng,YU Zhi-hong,et al.The inhibitory effect of chemotherapy on digestive tract carcinomas[J].Chin J Microecol,2006,18(6):468-470.

