19例肺隔离症临床分析
陈勃江 高 俊 李为民 张尚福 刘 丹 曾 静
肺隔离症(pulmonary sequestration)是一种先天性肺畸形,多因在胚胎发育过程中,肺动脉发育不全,主动脉分支代偿性供应部分肺组织,使其脱离正常组织;或额外发育的气管、支气管芽接受体循环的血供而形成无功能的囊性包块。因此,肺隔离症又被称为“有异常动脉供血的肺囊肿症”[1]。该病在临床上无特异性表现,易误诊。本文旨在通过分析我院近2年收治的肺隔离症患者资料,总结其临床特征,提高早期诊断率。
临床资料
一、一般资料
收集2009年1月至2010年12月我院手术病理活检证实的肺隔离症患者资料,共19例,其中女性12例,男性7例;年龄2岁~74岁,18岁以下3例,中位年龄34岁。
二、临床表现
患者临床症状以咳嗽(n=10,52.63%)、咳痰(n=8,42.11%)为主,4例出现黄脓痰;4例痰中带血,2例反复咯少量鲜血。1例患者以腰痛、尿频为首发症状,腹部B超发现左肾上腺包块,胸片示左下肺肿块影;另2例无明显不适,体检时分别发现左肾上腺、左下肺占位。胸部影像学检查病灶多位于左肺下叶(n=14,73.68%),以多发囊状扩张支气管扩张或软组织密度团块影常见(n=13,68.42%)(图1),误诊为肺囊肿伴支气管扩张或肺癌。2例患者因咯血、抗炎治疗效差,而行抗结核治疗,但症状缓解仍不明显。仅1例2岁患儿在出生时B超发现左下肺实变而诊断肺隔离症;1例19岁患者因咯血13 d行CT检查考虑该病;1例55岁患者经CT及血管造影发现异常供血动脉而诊断。19例患者的临床资料,详见表1。
三、治疗转归
所有患者均行手术治疗切除病灶(表1)。病灶最大直径8.5 cm;17例叶内型(89.47%)与胸腔及周围肺组织有不同程度的黏连;16例见异常胸主动脉分支血管,1例由腹主动脉上段分支血管供血;血管直径0.3 cm至2 cm不等,其中1例有3支异常血管;静脉引入奇静脉或肺静脉。2例叶外型(10.53%,肾上腺包块)未见确切血管。术中剥离并切除病灶,术后予抗感染、补液等治疗,患者恢复良好,未出现明显并发症,均好转出院。

表1 19例肺隔离症患者临床资料Table 1 19 cases of clinical clata of pulmonary sequestration patients
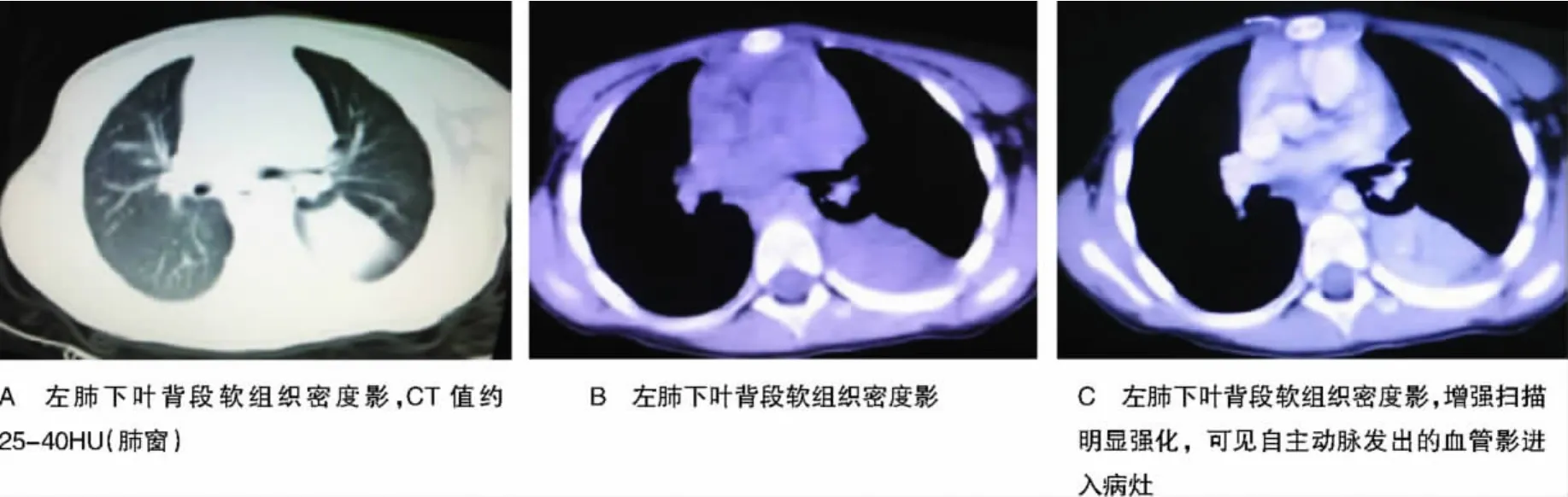
图1 左肺下叶背段软组织密度影Figure 1 Soft tissue density of left lung under the dorsal segment
四、病理检查
19例病灶均呈囊性,囊壁光滑,内有黄色、暗红色或白色分黏性分泌物。镜下见肺组织内支气管及血管分布失常;囊性区纤维组织增生伴较多慢性炎细胞浸润、淋巴细胞聚集、多核巨细胞反应及肉芽肿形成;囊壁被覆假复层纤毛柱状上皮或化生的鳞状上皮;部分肺组织实变,肺泡隔变宽,细支气管腔及肺泡腔内见急性炎性渗出及粘液聚集,部分肺泡机化(图2)。2例查见曲霉感染,1例抗酸染色阳性,诊断合并结核感染。2例肾上腺包块镜下以多发性囊腔改变为主,内衬纤毛柱状上皮而未见肾上腺结构。所有病理组织均未发现不典型增生或癌前病变或癌变。
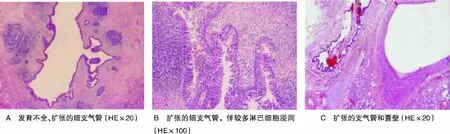
图2 肺隔离症的组织病理改变Figure 2 Pathological changes of pulmonary sequestration
讨 论
肺隔离症属先天性肺发育异常,约占肺畸形的0.15% ~6.40%[2],以肺组织血管异常和无功能为特点,可能涉及同源盒基因hoxb-5的异常[3]。根据病灶与正常肺组织是否被同一脏层胸膜所包裹,分为叶内型和叶外型。前者多见,可达75%,98%位于下肺,尤其是左肺下叶,且绝大部分在后或内基底段,病灶与正常支气管相通或不相通[4];后者有独立的包膜,多位于肺下叶与膈肌间或后纵隔部脊柱旁,胸腔以外部位罕见。异常供血血管来自于体循环系统,又以胸降主动脉及腹主动脉上段为主,少数见胃左动脉、脾动脉、肋间动脉、膈动脉等[1]。
肺隔离症的临床表现取决于病灶的类型和继发性改变。叶内型因与支气管有正常或病理性通道,局部易反复发生感染,表现为咳嗽、咳痰、发热、咯血、胸痛等;病灶较大,压迫邻近正常肺组织时,则出现胸闷、气短。发病年龄不定,可见于幼儿。咯血除与感染相关外,还可能因体循环系统压力较高所致。叶内型一般无支气管相通,可长期无症状。本组资料17例患者为叶内型,占90%,发病年龄2岁~74岁,与其它报道基本一致[2,4,5]。首发症状以反复咳嗽、咳痰为主,其次为咯血和气短,4例病程大于2年。提示当患者出现反复呼吸道感染时,临床医生应警惕是否有局部器质性病变;且除常见支气管扩张、肿瘤外,还应考虑本病,尤其是对年幼患者。另1例患者无呼吸道症状,而以腰痛、尿频起病,后经手术病理证实为该病左肾上腺叶外型,具有特殊性。可见,非胸腔部位的病灶亦不能完排除本病,但目前除Laje等[6]报道4例左肾上腺占位病例外,鲜有其它报道。另2例患者无任何不适,仅于体检时发现左上肺、左肾上腺团块影。
影像学是提示肺隔离症诊断的重要方法。普通X光摄片多表现为肺下叶三角形、圆形或椭圆形的囊性阴影、斑片影或团块影,与膈肌相连,合并感染时可见液气平。CT扫描可清晰显示其囊性、实性或囊实性特征。囊性者多为多发,内有分隔,亦可单发,壁较薄,边缘光滑;实性肿块影一般密度较均匀;囊实性则可表现为蜂窝状改变或多个大小不等的低密度透光区。易误诊为肺囊肿、肺癌和支气管扩张等。增强CT扫描囊壁可强化,病灶周围血管影局限性增多,并可显示病灶与供血血管的关系。Franco等[6]认为增强CT足以诊断该病。近年发展起来的CT或MRI血管成像技术,通过多平面及三维重建,有助于检查细小的血管异常,且可立体显示供血血管的起源、走向等,为临床制定治疗方案提供准确信息,已逐渐替代血管造影这一有创性“金标准”。典型征象为病灶通过条索状血管与胸主动脉、腹主动脉、膈动脉等体循环动脉相连;病灶周围由于空气引流,可出现局限性过度充气表现[7]。但需注意:发现异常动脉并非肺隔离症的特异表现,需与肺动脉畸形等鉴别。只有在异常动脉供血的基础上,病灶肺动脉缺如,才能诊断肺隔离症。因此,影像学发现下肺囊肿样或团块样阴影时,应行增强CT扫描,观察病变血供,必要时行CT或MRI血管成像及三维重建,以尽早明确诊断。彩色多普勒超声经济、无辐射、操作简单,但由于囊内气体的干扰降低了其应用价值,目前主要用于新生儿及胎儿的诊断,通常表现为下胸腔内有强回声团,中间可含囊性内容物,并可见异常血流影。而PET/CT、纤维支气管镜等检查,对本病意义不大。本组资料19例患者,3例首诊时行普通X光摄片检查,2例发现左下肺斑片影,诊断为肺炎,予抗感染治疗后缓解。但症状反复发生,医生未予重视,误诊漏诊时间分别达2年和3.5年。1例发现左下肺团块影,性质不定,倾向肺癌。12例患者经CT扫描发现囊性或实性占位,误诊为肺囊肿伴支气管扩张、肺结核或肺癌,予纤维支气管、全身骨显像、头CT、血清肿瘤标志物等检查;其中1例因反复咯血,抗炎效差、未获得肺结核病原学诊断时抗结核治疗1年(非组织病理学检查证实结核感染者),仍控制差,复查CT诊断肺脓肿。仅1例患者经CT检查发现右下肺背段多发囊状支气管扩张影考虑该病;另2例分别经增强CT和血管造影确诊。Sersar等亦报道本病误诊率可达71%[8]。可见,对影像学表现的认识水平,直接影响诊断的准确性,临床医生应予以重视。
由于叶内型肺隔离症多与支气管相通,容易引起局部反复感染,甚至大咯血;且较大的左向右分流引起血流动力学、血液氧合异常,并随年龄的增长而加重;叶外型多无明显影响。因此,一般认为确诊或拟诊的叶内型肺隔离症应在控制感染的基础上尽快手术;叶外型则可随访观察,出现压迫等症状时手术切除。叶内型主要采用肺叶切除术,叶外型可仅切除病灶。电视胸腔镜辅助手术(video assisted thoracoscopic surgery,VATS)相对于传统的开胸手术,具有切口小、损伤少、愈合快等特点,广泛用于临床,Peter等[9]报道该方法在肺隔离症的治疗中效果可靠。术中操作应轻柔,重点注意分离、结扎异常的供血血管,并同时注意有无其它合并的畸形,尤其是叶外型患者。近年来,介入治疗已成为肺隔离症的一种新的治疗方法,通过栓塞供血动脉而使病灶缺血、萎缩和机化。但若供血动脉过细或走行迂曲,则会增加插管困难、误栓、损伤动脉出血等风险,因此远期疗效尚待研究。术中组织病理学主要为排除是否合并其它病变,如真菌、结核感染甚至恶性变等。本病镜下以慢性炎症性改变为主要特征。本组患者11例行VATS,术中出血少,病灶剥离彻底,患者术后恢复良好,未出现明显不良反应,好转出院。
综上所述,肺隔离症的临床表现无特异性,诊断主要依靠影像学检查和手术。术前增强CT、CT或MRI血管成像发现异常的病灶体循环分支供血血管是诊断的重要依据,并可为手术方案等提供临床依据。临床医生应加强对本病影像学的认识,避免误诊误治。
1 Genç O,Gürkök S,Dakak M,et al.Pulmonary sequestration and surgical treatment[J].Asian Cardiovasc Thorac Ann,2006,14(1):3-6.
2 Lu G,Shen KL,Hu YH,et al.Diagnosis and treatment of 19 children with pulmonary sequestration.J Appl Clin Pediatr,2010,25(10):748-750.
3 Volpe MV,Archavachotikul K,Bhan I,et al.Association of bronchopulmonary sequestration with expression of the homeobox protein Hoxb-5[J].J Pediatr Surq.2000,35(12):1817-1819.
4 Clemente A,Morra A.Use of multidetector CT angiography and 3D postprocessing in a case of pulmonary sequestration[J].Clin Imaging,2007,31(1):210-213.
5 Berna P,Neves P JC,Cote JF et al.Left upper lobe pulmonary sequestration.Interact Cardiovasc Thorac Surg,2008,7(3):527-528.
6 Franco J,Aliaga R,Domingo ML,et al.Diagnosis of pulmonary sequestration by spiral CT angiography[J].Thorax,1998,53(12):1088-1089.
7 Zhang LJ,Liu XL.A clinical analysis of pulmonary sequestration on 3 cases and review of correlative literature[J].Journal of Clinical Pulmonary Medicine,2010,15(1):20-21.
8 Sameh IE,Diasty ME,Hammad RL,et al.Lower lobe segments and pulmonary sequestrations[J].J Thorac Cardiovasc Surg,2004,127(3):898-899.
9 Kestenholz PB,Schneiter D,Hillinger S,et al.Thoracoscopic treatment of pulmonary sequestration[J].European Journal of Cardiothoracic Surgery,2006,29(5):815-818.

