经气管镜超声引导针吸活检术在纵隔疾病诊断中的价值
邵 杨 姜淑娟
多数纵隔疾病未侵犯支气管黏膜,常规气管镜检查难以获取标本,成为诊断盲区,是临床常见的难题之一。1949年,阿根廷医生Schieppati首次经硬质气管镜对隆突进行穿刺,为气管镜检查开辟了一个新的领域[1]。经气管镜超声引导针吸活检术(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)通过针吸活检针穿透气管壁,可以获得纵隔病理以明确诊断。2009年1月至2010年12月对326例经CT扫描发现有纵隔病变患者行EBUS-TBNA。现分析结果并探讨其在纵隔疾病诊断中的价值。
资料与方法
一、一般资料
本组326例患者,女176例,男150例;年龄22~77岁,平均年龄(52.8±13.40)岁。胸部CT检查示隆突前淋巴结肿大220例,隆突后淋巴结肿大57例,隆突下淋巴结肿大78例,右气管旁淋巴结肿大145例,左气管旁淋巴结肿大37例。患者术前心电图、血常规、凝血常规、病毒七项检查均符合要求,均签署知情同意书。
二、操作方法
受检者术前准备纤支镜常规检查[2],妥善放置超声探头专用水囊并排净水囊及镜体内气体。穿刺吸引用的注射器内预先抽负压。同时检查超声设备连接完好。EBUS-TBNA内镜设备为Olympus公司产品,包括超声内窥镜,超声图像处理装置及穿刺针3部分。超声内窥镜型号为BF-UC206FOL8,超声图像处理设备型号为EU-C2000,穿刺针型号为NA-201SX-4022。最大插入部外径1.8 mm,工作长度700 mm,阵径22 G,最长出针距离40 mm。
经口插入内镜,行常规内镜检查。将内镜探头固定于穿刺部位,开启超声检查,确定所需穿刺病灶。测量并计算病灶大小,穿刺距离。开启多普勒血流检查,再次确定穿刺目标为病灶组织。常规内镜下置入穿刺针,以内镜视野下刚好可见穿刺针套管尖部为宜。调节穿刺针,确保准确的穿刺距离。开启超声内镜,充盈水囊,再次检查穿刺路径。以水囊贴紧穿刺部位,进行穿刺,成功时可见病灶内穿刺针强回声。
结 果
一、气管镜检查结果
326例患者中,192例常规气管镜检查无黏膜及管腔改变,47例局部黏膜增厚肿胀或有小结节样改变,62例管腔呈轻度外压型改变,25例气管局部软骨环消失。
二、经支气管针吸活检术(transbronchial needle aspiration,TBNA)穿刺结果
326例患者共穿刺486个位点,获得阳性诊断304例,阳性率为93.25%(304/326),其中恶性肿瘤260例(79.75%,260/326),分别为肺鳞癌81例、肺腺癌78例、肺大细胞未分化癌8例、肺小细胞未分化癌74例、淋巴瘤7例、难以分类的恶性肿瘤12例;良性病变44例,分别为结节病32例、结核病7例、慢性淋巴结炎5例。
486个位点共穿刺576针,482针(83.6%,482/576)TBNA涂片获得阳性诊断,其中恶性肿瘤421针(肺鳞癌137针、肺腺癌124针、肺大细胞未分化癌19针、肺小细胞未分化癌117针、淋巴瘤11针,难以分类的恶性肿瘤13针),良性病变61针(分别为结节病43针、结核病11针、慢性淋巴结炎7针);48针涂片中可见多个淋巴细胞团,认为穿刺成功,但无阳性发现;29针涂片见到较多纤毛柱状上皮细胞,未穿透气管壁,穿刺失败;17针涂片未见明显的细胞成分。
三、TBNA并发症
31例患者穿刺部位少量出血,勿需特别处理;5例穿刺针误刺入血管内抽出新鲜血液,及时更换穿刺点顺利完成操作;未出现纵隔气肿、纵隔感染等不良反应。患者均能很好耐受操作。
讨 论
一、EBUS-TBNA在恶性肿瘤诊断中的价值
EBUS-TBNA是近年来应用于临床的新技术。与TBNA(无超声引导下的盲穿)相比,EBUS-TBNA保留了TBNA技术操作简单、微创、涉及纵隔淋巴结区域广、可重复强的优点。同时,由于具有实时超声图像显示的功能,使得穿刺定位更加精确,显著提高了穿刺的准确率及安全性。纵隔淋巴结转移是影响肺癌患者预后的重要因素之一,影像学发现纵隔淋巴结肿大,以往需通过剖胸探查或纵隔镜来明确其性质,由于多种原因这两种诊断方法在临床上难以推广进行。EBUS-TBNA通过针吸活检针穿透气管壁,获得病变部位病理,对纵隔及肺门部肿物定性诊断和肺癌分期诊断有重要作用。本组326例患者共穿刺486个位点,获得阳性诊断304例,阳性率为93.25%(304/326),其中恶性肿瘤260例(79.75% ,260/326),分别为肺鳞癌81例、肺腺癌78例、肺大细胞未分化癌8例、肺小细胞未分化癌74例、淋巴瘤7例、难以分类的恶性肿瘤12例;良性病变44例、分别为结节病32例、结核病7例、慢性淋巴结炎5例。486个位点共穿刺576针,482针(83.6%,482/576)TBNA涂片获得阳性诊断,其中恶性肿瘤421针(肺鳞癌137针、肺腺癌124针、肺大细胞未分化癌19针、肺小细胞未分化癌117针、淋巴瘤11针、难以分类的恶性肿瘤13针),良性病变61针(分别为结节病43针、结核病11针、慢性淋巴结炎7针);48针涂片中可见多个淋巴细胞团,认为穿刺成功,但无阳性发现;29针涂片见到较多纤毛柱状上皮细胞,未穿透气管壁,穿刺失败;17针涂片未见明显的细胞成分。EBUS-TBNA细胞学在肿瘤的病理分型中的特点:肺鳞癌[图1(a)]细胞可单个分散,也可重叠,核大小不均,胞浆较丰富,部分可见坏死背景;肺腺癌[图1(b)]细胞大小一致,胞间分界较清楚,圆形、类圆形或印戒形。核多位于细胞一侧,胞浆内常有空泡;肺小细胞癌[图1(c)]细胞拥挤重叠,成体积小,成圆形、类圆形、瓜籽形等。核膜粗糙,核仁罕见;淋巴瘤[图1(d)]胞体大,畸形,胞浆深蓝,胞核常有切迹。霍奇金细胞即R-S细胞(Reed-Sternberg cells)典型者细胞含有镜影状双核,每个核都含有一个大而突出的核仁。
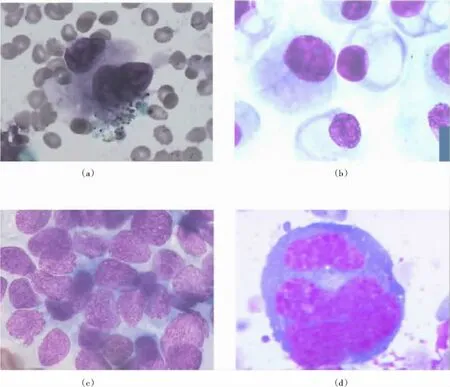
图1 肺鳞癌、肺腺癌、肺小细胞癌和淋巴瘤Figure 1 Lung squamous carcinoma,lung adenocarcinoma,small cell lung carcinoma and lumphoma
二、EBUS-TBNA对纵隔良性病变的诊断价值
目前结节病的辅助检查方法较多,如胸部CT、Kveim试验、血清血管紧张素转化酶(angiotensin converting enzyme,ACE)测定等,但均无特异性。对于结节病I期、Ⅱ期患者,纵隔镜检查是公认的“金标准”[3],诊断率较高。但由于纵隔镜或开胸检查创伤大、费用高且需要全身麻醉或局部麻醉下进行检查,不易被患者及家属所接受,难以作为常规的方法和手段在临床中开展。与纵隔镜相比,TBNA和EBUS-TBNA应用特制的穿刺针通过支气管镜进入气道内穿透气管壁对腔外病变(肿块、淋巴结等)进行穿刺抽吸获取细胞学或组织学标本,减少了患者的痛苦和手术风险,为诊断纵隔及肺门病变提供了一项简单、方便的手段[4]。EBUS-TBNA以其操作技术简单、微创、定位准确、灵敏度和特异度高及可重复性强的优势,越来越获得临床医师的认可。
本文特别指出EBUS-TBNA在结节病诊断中的价值。EBUS-TBNA为结节病I期、Ⅱ期(即肺门和/或纵隔淋巴结肿大,伴或不伴肺内病变)患者提供了一种崭新的诊断方法。在结节病的细胞学表现中,尤以见到大量纤维丝(形象地称为“拔丝地瓜”)(图2)最为典型,最具有诊断价值。结节病的细胞学表现与其发病机制密切相关。现多认为在某些致病抗原的刺激下,T淋巴细胞、单核细胞及巨噬细胞等浸润在肺泡内,形成结节病早期阶段——肺泡炎阶段。继而肺泡炎的细胞成分不断减少,而巨噬细胞衍生的上皮样细胞逐渐增多,渐而形成非干酪性结节病肉芽肿,后期巨噬细胞释放纤维连结素,成纤维细胞数目增加,周围的炎症和免疫细胞进一步减少以致消失,最终导致肺广泛纤维化,所以结节病细胞学表现早期为大量成熟小淋巴细胞,少量吞噬细胞,少量成纤维细胞及少量纤维丝。随着病情的发展,吞噬细胞、成纤维细胞及纤维丝的数量逐渐增多。本文研究发现,32例经EBUS-TBNA诊断为结节病的患者,有较为典型的胸部CT表现,确诊后给予糖皮质激素治疗,并定期随访,治疗两周后症状基本控制,一个月后纵隔肺门阴影均有不同程度缩小,肺内病灶减少,两至三个月后肿大淋巴结几乎消失。
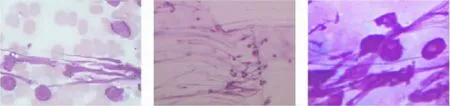
图2 纤维丝,“拔丝地瓜”现象Figure 2 Filament,“candied Sweet Potato”Phenomenon
三、提高EBUS-TBNA诊断阳性率
在大多数方面,EBUS-TBNA与标准的TBNA相比,EBUS-TBNA方法有助于更好地穿透支气管壁(由于存在活检管道,TBNA穿刺针形成向前的成角),可以显示淋巴结内穿刺针的确切位置,并可见周围血管,特别是肺门和低位气管旁区域的血管。其学习曲线相对较短,在20~30例(或更少)操作后可获得持续良好的细胞学诊断率[5]。
提高EBUS-TBNA诊断的阳性率,首先,操作者必须熟练掌握纵隔淋巴结定位及病变与纵隔解剖结构的关系,这是EBUS-TBNA穿刺成功的关键与基础。WANG[6]提出的纵隔淋巴结CT定位标准比较符合临床实际,应根据其指导穿刺的部位及进针的深度与角度。
其次,操作者要熟练掌握穿刺技术,支气管镜准确定位,穿刺针垂直刺入,以确保完全刺破支气管壁,到达病变位置;穿刺时需要患者的配合,采用推进法结合猛刺法、咳嗽法刺入;穿刺针反复抽吸,每个部位EBUS-TBNA 2~3次,以增加取样的阳性率。
另外,需要病理科及细胞室专家的配合,掌握恶性肿瘤的细胞学表现及分型特点,良性肿瘤的细胞学表现,特别是对结节病的诊断,应予以足够的重视,从而提高诊断的阳性率和准确率,指导临床进一步治疗。
1 李 强.呼吸内镜学[M].上海:上海科学技术出版社,2004:126-127.LI Qiang.Respiraory endoscopy[M].Shanghai:Shanghai Sci Techn Press,2004:126-127.
2 Chinese Thoracic Society,Bronchoscopic Group.Guideline onclinical application of flexible bronchoscopy[J].Chin J Tuberc Respir Dis,2000,23(3):134-135.
3 Rusch VW.Mediastinoscopy:an endangered species?[J].J Clin Oncol,2005,23:8283-8285.
4 Harrow EM,Abi-Saleh W,Blum J,et al.The utility of transbronchial needle aspiration in the staging of bronchogenic carcinoma[J].Am J Respir Crit Care Med,2000 ,161(2Pt1):601-607.
5 Groth SS,Whitson BA,D'Cunha J,et al.Endobronchial ultrasound-guided fine-needle aspiration of mediastinal lymph nodes:a single institution's early learning curve[J].Ann Thorac Surg,2008,86(4):1104-1110.
6 Wang KP.Transbronchial needle aspiration and percutaneous needle aspiration for staging and diagnosis of lung cancer[J].Clin Chest Med,1995,16(2):535-552.

