右归饮对激素性股骨头坏死氧化应激途径相关基因表达的影响研究
姜月艳 方剑利 毛 强 童培建
股骨头坏死是激素在临床广泛应用后被公认的主要并发症之一,目前激素性股骨头坏死的发病率已经超过了外伤所致的股骨头坏死[1,2]。激素性股骨头坏死的发病机制尚未被完全阐明,目前主要存在的学说有骨质疏松学说、脂肪栓塞学说、血管病变学说、骨内高压学说等[3~5]。但尚无一能明确阐释其确切病机病程[6]。所以临床对SINFH也缺乏相应特异有效的药物[7]。
随着基因技术的发展,对SINFH的病机研究逐渐深入到细胞分子机制和基因层面[8,9]。现在越来越多的研究显示,氧化应激在SINFH的发生发展过程中起作用,而与氧化应激相关的基因在SINFH的发生发展过程中亦有不同程度的表达[10,11]。那么是否可以通过抑制氧化应激而达到防治SINFH的目的呢?于是就这一设想我们进行了本项实验研究,希望可以借此为中药防治SINFH提供一点思路。
材料与方法
1.材料:(1)实验动物:成年健康Wistar大鼠20只,雌雄各半,体重200±10g;喂食大鼠普通饲料。于清洁级环境中饲养,正压屏障系统,空气经过3级过滤,空气洁净度达万级;24h循环光照,自由摄食饮水,每个标准笼饲养5只。以上实验动物、饲料及设施均由浙江中医药大学实验动物中心提供。(2)实验试剂和仪器:大肠杆菌内毒素 L2880(美国Sigma公司);甲泼尼龙(美国Pfizer公司);多聚甲醛(天津市化学试剂研究所);中性甲醛缓冲溶液(衢州巨化有限公司);Prime-ScriptTM RT reagent试剂盒(日本 TaKaRa公司);BioEasy SYBR GreenⅠReal Time PCR试剂盒(中国Bioer Technology公司)、Leica RM2016切片机(德国Leica公司);樱花全封闭组织脱水机(日本SAKURA公司);Microm EC350模块化组织包埋机(德国Thermo公司)。(3)右归饮制备:称取30倍量处方,加1L水浸泡1h后,加10倍水于密闭式高压自动煎药锅内煎煮,提取1.5小时/次,提取2次;所得提取液趁热过四层纱布后合并,放冰箱内冷藏12h后,以4000r/min,3℃下离心15min,共2次。合并上清液,加热至沸腾,趁热放置冰箱内冷藏12h后,再以4000r/min,3℃下离心15min,共2次,合并上清液,浓缩到密度为1.35g/ml,于60℃减压干燥。干燥物碾细,过120目筛子后得到右归饮细粉。
2.方法:(1)实验动物分组及模型制备:20只 Wistar大鼠适应性喂养1周后,精确称重,采用随机数字表法分为模型对照组和右归饮治疗组,每组10只。两组大鼠均按2μg/100g剂量经腹腔注射大肠杆菌内毒素2次,每次间隔24h。最后1次注射大肠杆菌内毒素24h后,再按4mg/100g剂量经左侧臀肌注射甲泼尼龙,连续注射3次,每次间隔24h。最后一次注射甲泼尼龙24h后,模型对照组予以蒸馏水1ml/100g灌胃,每天1次,共6周。右归饮治疗组:按1ml/100g剂量右归饮灌胃,每天1次,共6周。(2)标本制备:于第6周末采集左侧股骨头标本。大鼠称重后,按4ml/kg剂量腹腔注射水合氯醛,麻醉成功后,依次固定,备皮,消毒。严格无菌手术下迅速取出连同大小转子在内的左侧股骨头,尽量除去周围软组织后,肉眼观察股骨头形态、关节软骨色泽及外形(由专人记录),再从冠状面切开,其中一半经焦碳酸二乙酯(diethypyrocarbonate,DEPC)水漂洗后立即投入液氮中保存,用于基因芯片检测、实时荧光定量PCR检测和免疫组化检测;另一半投入100g/L多聚甲醛溶液中保存,用于组织病理学观察。(3)组织病理学观察:本研究主要通过HE染色对所取标本进行组织病理学观察。具体方法如下:将所取标本置于体积分数为10%的中性甲醛溶液(0.1mol/L,pH7.4)中固定3天,然后置于100g/L EDTA-Tris缓冲液中脱钙,每周更换脱钙液1次,以大头针能无阻力刺进骨密质为完全脱钙标准。脱钙完全后,再逐级脱水,二甲苯透明,石蜡包埋切片,沿冠状位切片,切片厚度为4μm,切片后行常规 HE染色,光镜下观察。(4)基因芯片检测:此项实验操作委托上海晶泰生物技术有限公司操作完成。基因芯片检测数据见表1。(5)基因芯片数据验证:主要运用实时荧光定量PCR技术。具体方法如下:实时荧光定量PCR检测方法:选定基因芯片发现的下调表达基因Gclc、SOD3和COX6A2,用同一RNA样品,通过实时荧光定量PCR检测,对基因芯片数据进行验证。采用两步法完成实时荧光定量PCR整个检测过程。先将提取出的总RNA(0.5μg)应用 PrimeScriptTMRT reagent试剂盒,通过 Thermo-ScriptTMreverse transcriptase(RT)-PCR System合成 cDNA。合成的cDNA(2μl)采用BioEasy SYBR GreenⅠReal Time PCR试剂盒通过real-time PCR(ABIPRISM 7000)进行扩增。设立看家基因β-actin作为内参,与目的基因在同一条件下进行扩增反应。结果通过序列检测软件(ABIPRISM 7000)获得。特定基因引物根据GenBank公布的序列,应用Primer Express(Applied Biosystems CA,USA)软件进行设计。并由上海生工生物技术有限服务公司合成引物,各引物具体序列见表2。基因表达水平以β-actin表达水平进行校正。在相对定量分析中,实时荧光定量PCR的结果以Ct值显示,Ct值为每个反应管内的荧光信号到达设定的域值时所经历的循环数,Ct值越大,表达量越低。平均△Ct值为样本目的基因的平均Ct值减去β-actin的平均Ct值。用模型对照组的平均△Ct值为标准计算出右归饮治疗组的2-△△Ct,以2-△△CT代表目的基因的相对表达水平[6]。
3.统计学方法:所得数据应用SPSS 13.0统计软件,采用两组独立样本t检验进行两组样本均数比较,P<0.05为差异有统计学意义。本研究中,表达倍数变化2倍以上的基因数据经We1ch T-test分析(P<0.01)即确定为显著差异表达基因。

表1 模型对照组及右归饮治疗组基因芯片数据差异谱
结 果
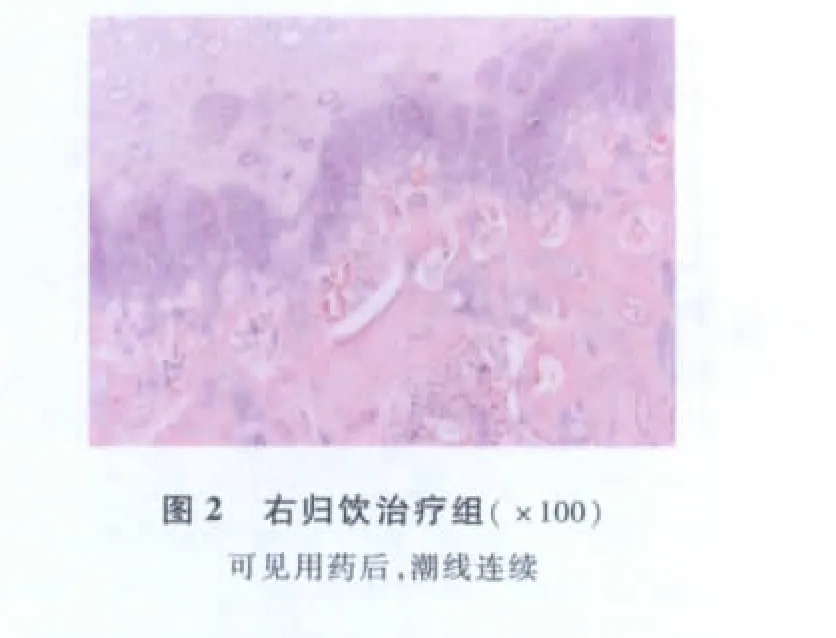
1.组织病理学观察结果:(1)标本肉眼大体观察:1)模型对照组:软骨表面不光滑、色晦暗,部分皱缩,软骨厚度明显变薄,有部分软骨表面剥脱、成台阶样改变、软骨下骨裸露和软骨脱落后的部分肉芽变。2)右归饮治疗组:软骨表面尚光滑、有光泽,部分皱缩,软骨厚度变薄,未见软骨表面剥脱。(2)组织病理学观察:1)模型对照组:股骨头结构完整,软骨细胞排列紊乱,软骨基质不均匀,在软骨表面有纤维结缔组织的增生,出现片状软骨钙化,潮线断续或消失,钙化带与软骨下骨小梁断裂或不连续。骨坏死区骨髓的病变特征为大片灶性或弥漫性骨髓坏死、溶解、渗出,髓内小血管变性、坏死,非坏死区骨髓基本为脂肪细胞所取代,骨髓内造血组织数目减少或接近消失,髓腔内脂肪细胞增大,有的融合呈泡状;骨细胞肿大,细胞核受压变形、边聚,有的胞核固缩、溶解、碎裂,空虚骨陷窝增多。骨坏死区主要集中在软骨下区,可见坏死骨小梁间隙纤维组织增生,包绕骨小梁,内有大量充血扩张的血管或静脉窦,多核破骨细胞出现,未见新生骨沉积,软骨下小血管明显减少(图1)。2)右归饮治疗组:股骨头结构完整,软骨基底层灶性变性,软骨细胞排列不规则,软骨基质不均匀,可见片状软骨钙化,潮线部分断续,钙化带与软骨下骨小梁断裂或不连续。骨小梁板层样结构稀疏但较为整齐,骨小梁边缘成骨细胞多见,软骨下血管丰富。部分骨小梁内骨细胞数减少,散在细胞核固缩,核深染,出现少量骨陷窝空虚。骨细胞核大居中,有空虚骨陷窝,但较模型组少,髓腔内造血细胞较丰富,散在的骨髓细胞结构模糊或细胞结构消失,呈淡染的粉红色区域,局部红骨髓坏死(图2)。

2.基因芯片检测结果:基因芯片检测结果显示模型对照组与右归饮治疗组相比氧化应激相关基因中有32条基因的表达存在差异,其中18条表达上调,14条表达下调。经分析,这些差异表达基因中有3条基因的表达存在显著差异,且都成下调表达,见表2。这3条基因的功能分别涉及抑制ROS的生成、增加ROS的清除以及保护细胞免受氧化损伤等方面。

表2 实时荧光定量PCR引物序列
3.实时荧光定量PCR检测结果:选取基因芯片筛选出的3条明显差异基因(Gclc、SOD3和COX6A2)进行实时荧光定量PCR验证,结果见表3。
表3 实时荧光定量PCR结果比较(△CT值,)
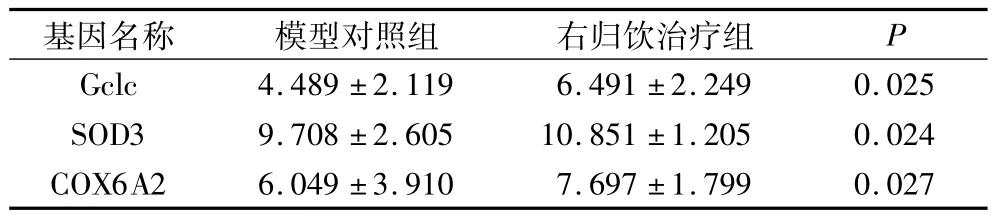
表3 实时荧光定量PCR结果比较(△CT值,)
与模型对照组相比右归饮治疗组的Gclc、SOD3、COX6A2基因mRNA的表达下调,差异有统计学意义(P<0.05)。可见基因芯片检测结果与RT-PCR检测结果相符。
讨 论
生物体内的自由基主要为氧自由基(oxygen derived freeradicals,OFR)。这些氧自由基以及由它们衍生的单线态氧(O2)、过氧化氢(H2O2)和脂质过氧化物(RO-、OO-与ROOH)等,统称为活性氧(reactive oxygen species,ROS)[12,13]。细胞内的 ROS有多种来源,许多细胞内的酶促化学反应途径均生成ROS。除线粒体呼吸链外,内皮细胞一氧化氮合酶(eNOS)、还原型辅酶Ⅱ(NADPH)氧化酶、细胞色素P450氧化酶、黄嘌呤氧化酶、环氧化酶和脂氧合酶催化的反应均伴有活性氧的产生[14]。
新近研究表明氧化应激几乎参与了生物体所有疾病的发病过程,其参与机制主要包括引起血管损伤和细胞凋亡[15~18]。亦有研究表明血管损伤参与了SINFH的发病过程,而细胞凋亡也被认为是SINFH的发病机制之一[15~23]。因此,可推测氧化应激参与了SINFH的发生发展过程。另一方面,临床上在治疗SINFH时运用的一些抗氧化应激药物(如他汀类药物 statins,ACEI类,TZDs,CCB 等)也都取得了一定疗效,这也反证了氧化应激在SINFH的发病过程中起作用[24,25]。目前关于中医药防治SINFH的研究也越来越多,右归饮作为中医补肾的经典名方,将其运用于SINFH大鼠模型后,其对SINFH大鼠股骨头组织结构产生了一定影响(表现为股骨头结构较模型对照组完整,骨小梁板层样结构也较模型对照致密整齐,空骨陷窝率远低于模型对照)。研究的主要思路是尝试从分子生物学角度阐明右归饮抗氧化应激进而防治SINFH的分子机制。本研究运用基因芯片技术,发现了3个右归饮抗氧化应激相关显著差异基因(Gclc、SOD3和COX6A2),提示此3个基因可能是SINFH发病的关键基因[26~28]。本研究为研究SINFH的发病机制及其防治提供了一个新的角度,在此基础上,可进一步运用其他基因技术(如基因敲除、基因导入等)来探讨SINFH的发病机制及行之有效的防治方法,并最终战胜SINFH。
1 Nagasawa K,Tada Y,Koarada S,et al.Prevention of steroid-induced osteonecrosis of femoral head in systemic lupus erythematosus by anti- coagulant[J].Lupus,2006,63(6):2179 -2184
2 Kubo T,Fujioka M,Yamazoe S,et al.Relationship between steroid dosage and osteonecrosis of the femoral head after renal transplantation as measured by magnetic resonance imaging[J].Transplant Proc,1998,11(30):3039-3040
3 Liu YF,Chen WM,Lin YF,et al.TypeⅡ collagen gene variants and inherited osteonecrosis of the femoralhead[J].N Engl J Med,2005,35(2):2294-2301
4 Ichiseki T,Matsumoto T,Nishino M,et al.Oxidative stress and vascular permeability in steroid-induced osteonecrosis model[J].Orthop Sci,2004,9(9):509 -515
5 Ichiseki T,Kaneuji A,Katsuda S,et al.Matsumoto T.DNA oxidation injury in bone early after steroid administration is involved in the pathogenesis of steroid-induced osteonecrosis[J].Rheumatology,2005,44(11):456-460
6 Assouline-Dayan Y,Chang C,Greenspan A,et al.Pathogenesis and natural history of osteonecrosis[J].Semin Arthritis Rheum,2002,32(8):94-124
7 Pritchett JW.Statin therapy decreases the risk of osteonecrosis in patients receiving steroids[J].Clin Orthop,2001,21(386):173 -178
8 Petersen SV,Oury TD,Ostergaard L,et al.Extracellular superoxide dismutase(EC-SOD)binds to type I collagen and protects against oxidative fragmentation[J].J Biol Chem,2004,12(100):13875-13880
9 Regan E,Flannelly J,Bowler R,et al.Extracellular superoxide dismutase and oxidant damage in osteoarthritis[J].Arthritis Rheum,2005,54(52):3479-3491
10 Du Y,Miller CM,Kern TS.Hyperglycemia increases mitochondrial superoxide in retina and retinalcells[J].Free Radic Biol Med,2003,35(11):1490-1499
11 Munzel T,Daiber A,Ullrich V,et al.Vascular consequences of endothelial nitric oxide synthase uncoupling for the activity and expression of the soluble guanylyl cyclase and the cGMP[J].Arterioscler Thromb Vasc Biol,2005,25(8):1551-1557
12 Betteridge DJ.What is oxidative stress? [J].Metabolism,2000,49(3):3-8
13 Baynes JW.Role of oxidative stress in development of complications in diabetes[J].Diabetes,1991,9(40):405 -412
14 Miyata T,Maeda K,Kurokawa K,et al.Oxidation conspires with glycation to generate noxious advanced glycation end products in renal failure[J].Nephrol Dial Transplant,1997,2(12):255-258
15 Kim TH,Hong JM,Cho YS,et al.Genetic association study of polymorphisms in the catalase gene with the risk of osteonecrosis of the femoral head in the Korean population[J].Osteoarthr Cartilage,2008,20(16):1060-1066
16 Ichiseki T,Ueda Y,Katsuda S,et al.Oxidative stress by glutathione depletion induces osteonecrosis in rats.Rheumatology(Oxford),2006,19(45):287-290
17 Cojocaru IM,Cojocaru M,Musuroi C,et al.Lipid peroxidation and catalase in diabetes mellitus with and without ischemic stroke[J].Rom J Intern Med,2004,10(42):423-429
18 Lean JM,Jagger CJ,Kirstein B,et al.Hydrogen peroxide is essential for estrogen-de?ciency bone loss and osteoclast formation[J].Endocrinology,2005,3(146):728-735
19 Eun MC,Gun HK,Yong SL.Protective effects of dehydrocostus lactone against hydrogen peroxide-induced dysfunction and oxidative stress in osteoblastic MC3T3-E1 cells[J].Toxicol in Vitro,2009,11(23):862-867
20 Cortizo AM,Bruzzone L,Molinuevo S,et al.A possible role of oxidative stress in the vanadium-induced cytotoxicity in the MC3T3E1 osteoblast and UMR106 osteosarcoma cell lines[J].Toxicology,2000,21(147):89-99
21 Shoubridge EA.Cytochrome c oxidase deciency[J].Am J Med Genet,2001,20(106):46 -52
22 Hampton MB,Orrenius S.Redox regulation of apoptotic cell death[J].Biofactors,1998,11(8):1 -5
23 Kabata T,Kubo T,Matsumoto T,et al.Apoptotic cell death in steroid induced osteonecrosis:an experimental study in rabbits[J].J Rheumatol,2000,21(27):2166 -2171
24 Regan EA,Bowler RP,Crapo JD.Joint fluid antioxidants are decreased in osteoarthritic joints compared to joints with macroscopically intact cartilage and subacute injury[J].Osteoarthritis and Cartilage,2008,30(16):515-521
25 Fattman CL,Schaefer LM,Oury TD.Extracellular superoxide dismutase in biology and medicine[J].Free Radic Biol Med,2003,35(56):236-256
26 Aigner T,Fundel K,Saas J,et al.Large-scale gene expression proling reveals major pathogenetic pathways of cartilage degeneration in osteoarthritis[J].Arthritis Rheum,2006,32(54):3533 -3544
27 Jun YZ,Yusen L,Gen SW.The role of mitogen-activated protein kinase phosphatase-1 in oxidative damage-induced cell death[J].Cancer Res,2006,66(9):4888-4894
28 Qihe X,Tsuneo K,Kenji N,et al.Cellular defense against H2O2-induced apoptosis via MAP Kinase-MKP -1 pathway[J].Free Radical Biol Med,2004,36(8):985-993