血清游离HER-2在乳腺癌患者检测的临床意义
万 轲 王雅杰
HER-2/neu基因是人表皮生长因子家族的第二位成员。表皮生长因子受体(EGFR)家族,也称为HER家族或ErbB家族,在细胞信号传导中发挥重要作用,是细胞生长、分化和存活的重要调节者。表皮生长因子是一种具有酪氨酸激酶活性的膜表面传感器,在多种人类恶性肿瘤中存在过表达。HER-2/neu基因扩增在原发性乳腺癌中的发生率为20%~40%[1]。大量的研究表明,HER-2受体过表达的乳癌患者生存期短、复发快,对内分泌治疗和化疗相对耐药。多种方法可用于检测组织HER-2状态,最常用的技术为以下3种:免疫组化(IHC)检测蛋白过表达,荧光原位杂交(FISH)及显色原位杂交(CISH)检测HER-2基因扩增。虽然HER-2受体的组织学检测对于判断预后、指导用药价值已得到证实,但由于乳腺癌的病程是一个长期的过程,HER-2受体可能存在异质性。如能够通过简单方法实时监测HER-2状态,无疑会使临床治疗获益匪浅。HER-2受体由以下部分组成,分别是具有酪氨酸激酶活性的胞质区、跨膜区及胞外域(extracellular domain,ECD)。HER-2的ECD可从乳腺癌细胞表面脱落,可通过酶联免疫吸附法(ELISAs)检测到血清ECD浓度,因此美国FDA已经批准血清HER-2可用于晚期转移性乳腺癌疗效监测和随访[2]。
本研究以晚期转移性乳腺癌患者为对象,用ELISA法检测以上患者化疗前和化疗后血清HER-2的浓度,观察治疗前血清HER-2水平是否可作为监测乳腺癌晚期复发的敏感标志物,以及和化疗疗效的关系。另研究化疗前后血清HER-2浓度变化与化疗疗效的相关性。
材料与方法
1.临床资料:实验组标本来自2009年8月~2010年10月期间第二军医大学附属长海医院肿瘤科初治的复发转移乳腺癌患者40例,年龄41~71岁,中位年龄50.5岁。绝经前者10例,绝经后者30例。ER阳性者21例,阴性者19例。PR阳性者18例,阴性者22例。实验组患者均为我院病理科经组织形态学和免疫组化确诊的复发乳腺癌,并都有可评价病灶,主要接受含紫杉类和蒽环类的方案为主,每21天为1个化疗疗程,2周期后行影像学检查评价治疗疗效。
对照组为同时期经手术病理确诊的30例初治手术后乳腺癌女性患者,年龄40~72岁,中位年龄50岁。绝经前者15例,绝经后者15例。ER阳性者18例,阴性者12例。PR阳性者17例,阴性者13例。
2.方法:(1)标本采集:收集40例晚期乳腺癌患者血清,其中32名患者为前2次化疗前后的血清,另8名患者为首次化疗前后的血清。30例早期乳腺病患者初次辅助化疗前血清。抽取晨起空腹静脉血3ml,置于干燥无抗凝试管,室温下静置2h后,2000r/min离心15min,取上清液即血清,保存于-80℃冰箱中。(2)实验方法:将保存于-80℃冰箱中的血清样本取出,采用ELISA方法对血清HER-2进行定量检测,试剂盒购自上海劲马生物公司(human sp-185 HER-2,H143-9;原装美国GBD产品),其中包括底物、检测抗体、结合抗体、稀释液及终止液。按照说明书上操作步骤进行。
3.结果判定:(1)血清HER-2结果判定 血清经定量检测商品试剂盒反应结束后,用450nm波长读取每孔吸光度(OD值),根据标准品浓度与吸光度值绘制标准曲线,即可得出没孔的浓度,遵照试剂盒说明,以15ng/ml为标准,HER-2浓度≥15ng/ml为阳性,浓度<15ng/ml为阴性。(2)疗效结果判断:近期疗效评价采用RECIST实体瘤疗效评价标准,测量实体瘤最长径总和变化,即分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)和进展(progression disease,PD)。以 CR 和 PR定义为有效,以SD和PD定义为无效。①完全缓解(complete remission,CR):全部病灶消失维持4周,无新病灶出现;②部分缓解(partial remission,PR):肿瘤最长径之和缩小≥30%维持4周,无新病灶出现;③稳定(stable disease,SD):肿瘤最长径之和缩小未 PR,或增大未达PD;④进展(progression disease,PD):肿瘤最长径之和增加≥20%或出现新病灶。
结 果
1.晚期乳腺癌患者血清HER-2浓度与各临床参数的关系:40例晚期乳腺癌患者血清HER-2的平均浓度 28.09ng/ml(0.41 ~178.35ng/ml),其中 19例患者血清HER-2为阳性,占所有病例的47.5%,21例患者血清 HER-2为阴性,占所有病例的52.5%。在年龄、原发肿瘤大小、有无淋巴结转移、月经状况、激素受体情况、病理类型、RFS等方面两组无差异性。但转移部位、转移数目对血清HER-2 ECD有影响(P值分别为0.022,0.012)。提示随着转移器官数目的增多,血清HER-2的浓度也随之升高,且相对于仅有骨或软组织转移的患者,存在内脏转移的患者血清HER-2的阳性率较高(表1)。
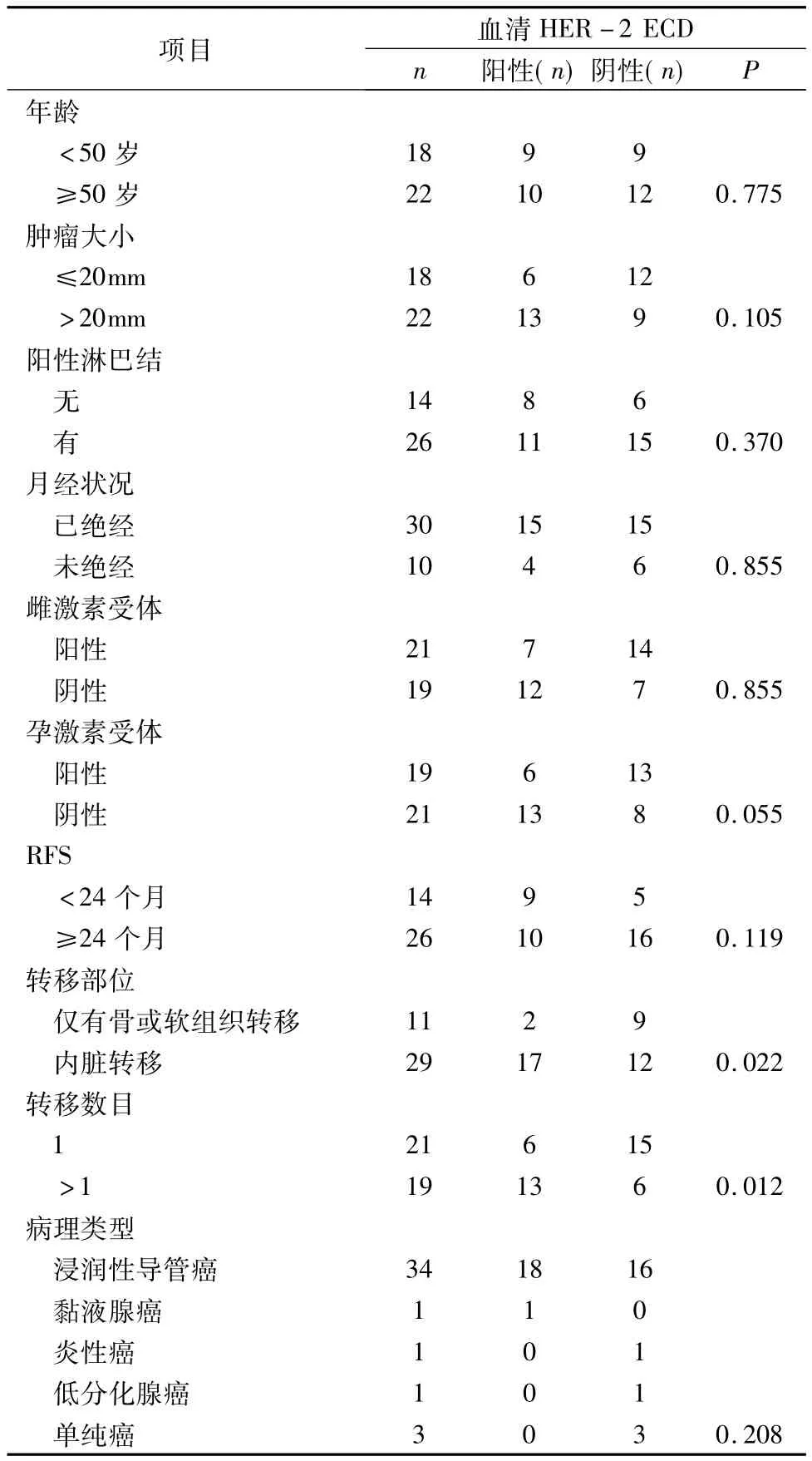
表1 晚期乳腺癌患者血清HER-2浓度与各临床参数的关系
2.早期乳腺癌患者术后血清HER-2浓度与各临床参数的关系:30例早期乳腺癌患者术后血清HER-2 的平均浓度 7.66ng/ml(0.47 ~24.32ng/ml),其中2例患者血清HER-2为阳性,占所有病例的6.67%,28例患者血清HER-2为阴性,占所有病例的93.3%。在年龄、原发肿瘤大小、有无淋巴结转移、月经状况、激素受体情况、病理类型等方面两组无差异性(表2)。
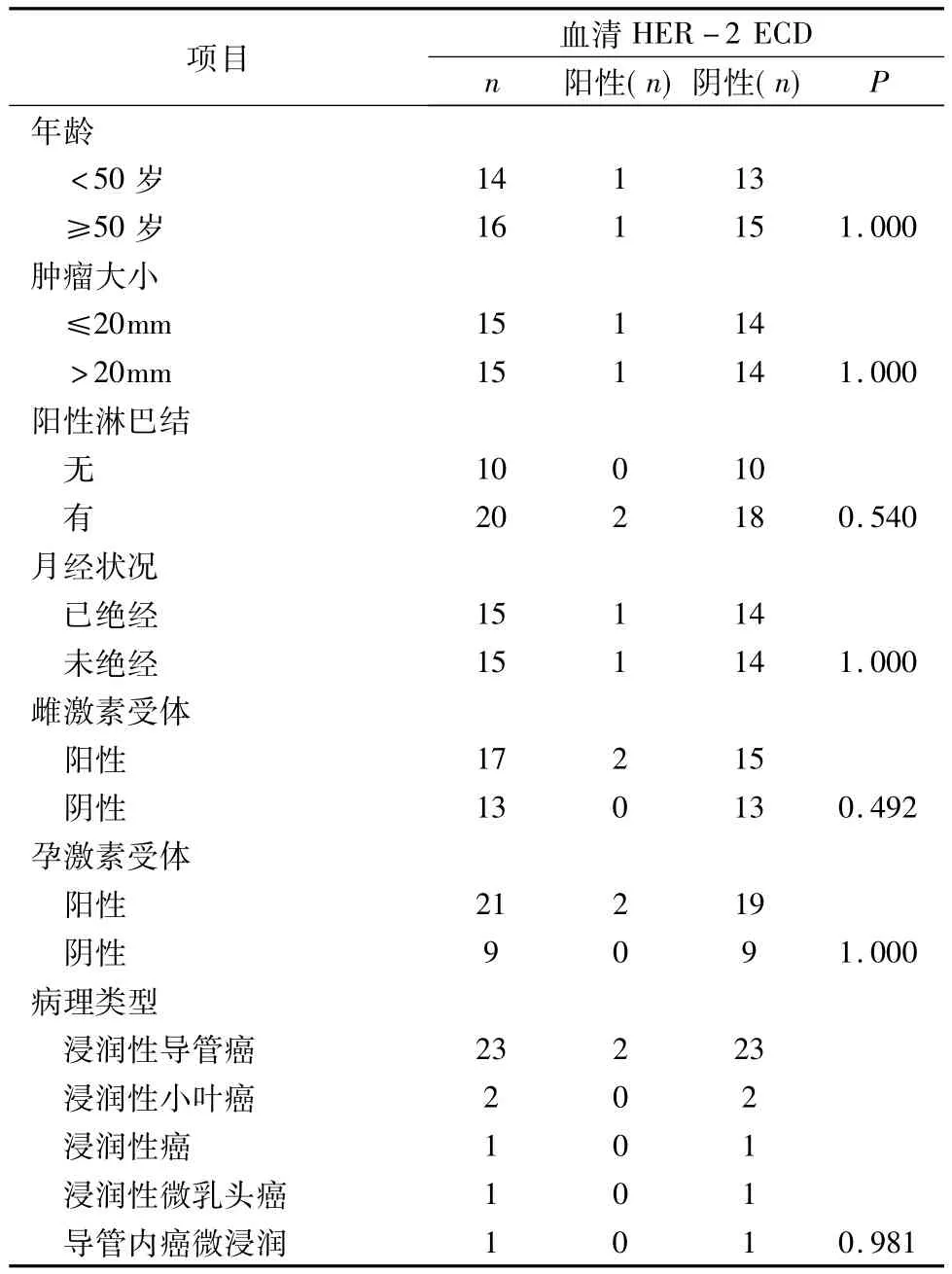
表2 早期乳腺癌患者术后血清HER-2浓度与各临床参数的关系
3.晚期乳腺癌和早期乳腺癌患者血清HER-2水平与肿瘤组织HER-2表达的关系:比较晚期乳腺癌患者血清HER-2水平与肿瘤组织中HER-2的表达,两者具有相关性,有统计学意义(P=0.003)。比较早期乳腺癌患者血清HER-2水平与肿瘤组织中HER-2的表达,两者之间无相关性,无统计学意义(P=0.517)。
4.晚期乳腺癌患者化疗前血清HER-2 ECD浓度与疗效的关系:40例晚期乳腺癌患者均予以晚期全身姑息化疗。方案主要以含葸环类及紫杉类药物为主,如FAC(氟尿嘧啶、阿霉素或表阿霉素、环磷酰胺)、TAC(阿霉素或表阿霉素、环磷酰胺、多西紫杉醇)、GT(吉西他滨、紫杉醇)、DX(多西紫杉醇、卡培他滨)等。其中7名患者使用赫塞汀靶向联合化疗综合治疗。化疗前血清HER-2 ECD阳性组共19例,化疗后CR 1例,PR 8例,SD 6例,PD 4例,有效(CR+PR)9例,无效(SD+PD)10例。化疗前血清HER-2 ECD阴性组共21例,化疗后CR 0例,PR 10例,SD 5例,PD 6例,有效(CR+PR)10例,无效(SD+PD)11例。晚期乳腺癌患者化疗前血清HER-2 ECD阳性组有效率与阴性组有效率差异无统计学意义(P=0.987)。提示晚期乳腺癌患者化疗前HER-2 ECD浓度与化疗疗效无关。
5.晚期乳腺癌患者化疗前后血清HER-2 ECD水平的变化:40例患者第一次治疗前血清HER-2 ECD 平均浓度为28.09 ±36.80ng/ml,第一次治疗后血清 HER -2 ECD 平均浓度21.65±23.08ng/ml,第一次治疗后较治疗前血清HER-2下降,有统计学意义(P<0.001)。32例患者第二次治疗前血清HER-2 ECD 平均浓度为 31.75 ±40.21ng/ml,第二次治疗后血清HER-2 ECD平均浓度19.62±19.65ng/ml,第二次治疗后较治疗前血清HER-2 ECD下降,有统计学意义(P<0.001)。提示前两次化疗每次化疗后均较化疗前血清HER-2 ECD有显著下降。
6.晚期乳腺癌患者治疗前后患者血清Her-2浓度的变化与化疗疗效的关系:第一次治疗后(CR+PR)组血清HER-2 ECD下降值为16.63±31.55ng/ml,(SD+PD)组血清HER-2 ECD下降值为0.90±1.87ng/ml,有显著差异(P=0.010)。第二次治疗后(CR+PR)组血清 HER-2 ECD下降值为22.72±44.20ng/ml,(SD+PD)组血清 HER -2 ECD 下降值为1.54 ±3.21ng/ml,有显著差异(P=0.026)。提示晚期乳腺癌患者化疗有效组相对无效组,治疗前后血清HER-2 ECD下降幅度更大。
讨 论
人表皮生长因子受体-2(HER-2)是影响乳腺癌发生、发展及预后的主要癌基因[3]。临床研究显示,HER-2蛋白过表达和基因扩增的患者比HER-2蛋白无过表达以及无基因扩增的患者总生存时间(OS)和无病生存时间(DFS)缩短,肿瘤负荷大,淋巴结转移的概率高,激素受体阴性的比例高,组织学分级低,肿瘤的增殖指数高[4]。血清HER-2 ECD作为一种简单快捷、可动态实时监测的方法,其在检测和指导治疗方面具有独特的优势。
在Watanahe等[5]的研究中,晚期转移性乳腺癌患者中大约有30%~50%患者的高于正常水平。而在本实验中,40例晚期乳腺癌患者初诊时的血清HER -2平均浓度为 28.09ng/ml(0.41 ~178.35ng/m1),其中19例患者血清HER-2浓度高于正常值上限,占所有病例的47.5%,与Watanahe的结论基本吻合。而30例早期乳腺癌手术后患者的血清HER-2 平均浓度为 7.66ng/ml(0.47 ~24.32ng/m1),其中2例患者血清HER-2浓度高于正常值上限,占所有病例的6.67%。本实验结果提示大多数乳腺癌患者在手术切除原发肿瘤后血清HER-2 ECD为阴性,分析原因可考虑为与手术后患者体内肿瘤负荷减小造成,但与 Prˇibylova 等[6]之前的研究结果 19.05%(8/42)相比略小,可能与入组病人数目较少,且病人临床分期等不同有关。这一问题有待于增加样本含量及进一步分层分析后解决。但是,根据本实验可以得出结论,血清HER-2 ECD水平可能可作为筛查乳腺癌患者术后复发的指标。
本研究中,我们用IHC法检测发现晚期乳腺癌患者肿瘤组织中HER-2蛋白过表达(+++)和用ELISA法检测患者血清中HER-2 ECD阳性是呈相关性的。但本研究中存在1例患者,IHC检测肿瘤组织中HER-2蛋白表达(-),ELISA法检测血清HER-2 ECD呈阳性,产生这种结果的原因较为复杂,笔者认为可考虑为以下几种:①经IHC检测的样本中,因检测人员技术性及方法学的不同可以造成20%的结果出现误差[7];②随着病情的进展,肿瘤生物学行为发生改变;③因肿瘤异质性引起的采样误差[8];④血清HER-2浓度可能与循环中肿瘤负荷有关。
对晚期转移性乳腺癌患者进行血清HER-2浓度与患者临床特征分析过后,试验结果表明,血清HER-2浓度与ER表达、PR表达、病理类型、年龄、月经状况、放疗与否、PFS等均无相关性。但转移器官的部位及数目的多少与血清HER-2浓度呈相关性,这也就可以解释早期初治手术组织病理HER-2蛋白表达(-)的患者,在晚期复发转移时检测血清HER-2 ECD呈阳性的原因。当然,肿瘤的异质性及病人复发前接受的化疗均有可能对此产生影响,这值得我们进一步的研究。
本研究结果显示治疗前血清HER-2 ECD升高组与非升高组对于化疗的反应率并无差别。而关于这点,既往其他学者的研究结果并不一致,在一些未限定特定化疗方案的研究中,如Harris等[9]认为治疗前出现HER-2 ECD升高意味着治疗有效率(response rate,RR)较低。然而另一些研究结果显示RR值与HER-2 ECD并无联系。Colomer等[10]实验入组52名病人,均采用吉西他滨2500mg/m2联合长春瑞滨30mg/m2,在14天方案中的第1天使用,最长治疗周期为10周期。并检测治疗前血清HER-2 ECD水平,结果显示其与治疗有效率并无联系,不能预测疗效。将患者按不同的化疗方案分组分析后,Harris等[11]发现在HER-2 ECD升高的病人中,相比由环磷酰胺、甲氨蝶呤、5-氟尿嘧啶组成的CMF方案,使用含多柔比星化疗方案有效率(response rate,RR)更高,64.1%vs 30.8%。Muller等[12]曾进行一项紫杉醇剂量密集型治疗实验,显示HER-2 ECD升高患者RR值更高。Muller等在1项100名转移性乳腺癌入组的研究显示,HER-2 ECD升高的患者可从紫杉类药物中获益。这也支持了目前NCCN推荐将蒽环类和紫杉醇类药物作为用于复发转移性乳腺癌治疗主要治疗药物的建议。但本研究样本量较小,且大部分患者以TE方案为主,未前瞻性地以化疗方案分组,不能得出治疗前HER-2 ECD升高与否和接受何种化疗方案治疗后疗效的关系,有待在今后的研究中扩大样本量及设计特定方案后得出相应结论。
本实验中32名患者拥有前2次化疗前后的血清,另8名患者拥有首次化疗前后的血清。研究结果显示,无论疗效如何,第1次化疗后及第2次化疗后患者血清HER-2 ECD值均较化疗前有显著下降(P<0.001)。但按疗效分类,CR及PR的患者与SD及PD的患者比较,前者在治疗后血清HER-2 ECD的下降幅度明显大于后者。该结论与Leary等[13]的研究结果相似,即大部分患者在接受治疗后血清HER-2 ECD值出现下降。但能否通过血清HER-2 ECD的下降幅度预测疗效,这是一个有争议的问题。Lieberman等[14]研究显示,在接受赫塞汀方案治疗的患者中,HER-2 ECD降幅>20%的患者临床获益较降幅<20%的患者大。另一项研究显示,在赫塞汀治疗后,下降至基线水平77%以下的患者,PFS较其他患者明显延长[15]。然而在本研究中仅有8名患者使用了赫塞汀靶向治疗,样本量较小,无法评估得出相应的结论。
综上所述,本研究通过对40例晚期转移性乳腺癌患者血清HER-2 ECD浓度的测定和肿瘤组织中HER-2表达情况的检测,发现两者之间有较好的一致性,且在晚期患者中血清HER-2 ECD阳性的患者比例较高,血清HER-2 ECD水平可能可作为筛查乳腺癌患者术后复发的指标。但在30例早期乳腺癌术后患者中,血清HER-2 ECD则与肿块大小、ER、PR、HER -2、病理类型、年龄、月经状况、放疗与否、PFS等均无相关性。血清HER-2浓度作为晚期转移性乳腺癌患者独立的预后指标还没得到完全的确立,仍需加大样本量及延长随访时间进一步的研究。相对于一次性的组织检测,动态监测乳腺癌患者复发、化疗前后血清HER-2 ECD水平变化可提供实时的HER-2状态,可在制定乳腺癌患者更合适的治疗方案以提高生存率及生存质量时提供重要参考,有较大的临床研究意义。
1 lamon DJ,Clack GM,Wong SG,et al.Human breast cancer:corre lation of relapse and survival with amplification of the Her-2/neu oncogene[J].Science,1987,235(4785):177 -182
2 Cook GB,Neaman IE,Goldblatt JL,et al.Clinical utility of serum Her-2/neu testing on the bayer immunol automated system in breast cancer[J].Anticancer Res,2001,21(2B):1465-1470
3 Meric F,Hung MC,Hortobagyi GN,et al.HER -2/neu in the management of invasive breast cancer[J].J AM Coil Surg,2002,194:488-501
4 Ross JS,Fletcher JA,Linette GP,et al.The HER -2/neu gene and protein in breast cancer 2003:biomarker and target of therapy[J].Oncologist,2003,8(4):307 -325
5 Watanahe N,Miyamoto M,Tokuda Y,et al.Serum c- erbB -2 in breast cancer patients[J].Aeta Oncol,1994,33:901 -904
6 Pribylovea O,Springer D,Vitkova I,et al.HER -2 Tissue Expression correlated with serum levels in breast cancer patients[J].Folia Bio,2007,53(4),129 -133
7 Paik S,Bryant J,Tan-Chiu E,et al.Real- world performance of HER-2 testing:national surgical adjuvant breast and bowel project experience[J].J Natl Cancer Inst,2002,94(11):852 -854
8 Hanna W,Nofech-Mozes S,Kahn HJ.Intratumoral heterogeneity of HER -2/neu in breast cancer:a rare event[J].Breast J,2007,13(2):122-129
9 Harris LN,Liotcheva V,Broadwater G,et al,Comparison of methods of measuring HER-2 in metastatic breast cancer patients treated with highdose chemotherapy[J].J Clin Oncol,200119(6):1698-1706
10 Colomer R,Llombart- Cussac A,Tusquets I,et al,Biweekly gemcitabine plus vinorelbine in firstlinemetastatic breast cancer:Efficacy and correlation with HER -2 extracellular domain[J].Clin Transl Oncol,20068(12):896 -902
11 Harris L,Luftner D,Jager W,et al,C-erbB-2 in serum of patients with breast cancer[J].Int J Biol Markers,1999.14:8 -15
12 Muller V,Witzel I,Luck HJ,et al,Prognostic and predictive impact of the HER-2/neu extracellular domain(ECD)in the serum of patients treated with chemotherapy for metastatic breast cancer[J].Breast Cancer Res Treat,200486(1):9 -18
13 Leary AF,Hanna WM,Van de Vijver MJ,et al,Value and limitations of measuring HER-2 extracellular domain in the serum of breast cancer patients[J].J Clin Oncol,200927(10):1694-1705
14 Lieberman GL,Gourlay S,Pharmacokinetic-pharmacodynamic relationships of single agent weekly trastuzumab in patients with HER-2- overexpressing MBC[J].Proc Am Soc Clin Oncol,2003,22:20
15 Esteva FJ,Cheli CD,Fritsche H,et al,Clinical utility of serum HER-2/neu in monitoring and prediction of progression-free survival in metastatic breast cancer patients treated with trastuzumab-based therapies[J].Breast Cancer Res,2005,7(4):R436-R443