新型CpG佐剂——BW006协同乙型肝炎病毒表面抗原活化小鼠B、T淋巴细胞的作用
何 鹏 张现臣 胡忠玉 方 鑫 邱少辉 梁争论
近年来的研究表明,细菌DNA及人工合成的含未甲基化CpG基序的寡核苷酸(CpG-ODN)可刺激机体免疫反应,诱导天然免疫,促进免疫细胞的增殖和分化,具有重要的免疫调节作用。由于CpG-ODN既能刺激细胞免疫又能刺激体液免疫,因此被认为是一种有潜力的新型免疫佐剂[1,2]。目前国内外对于CpG-ODN作为乙型肝炎(乙肝)疫苗佐剂应用已有较多研究,而有关CpG-ODN如何增强免疫机制的研究仍较为缺乏,影响了对疫苗佐剂免疫原性评价的相关标准的制定[3~5]。本文对一种新设计合成的含有CpG基序的寡核苷酸(BW006)对乙肝病毒表面抗原刺激B、T淋巴细胞免疫的影响进行研究。
材料与方法
1.材料:(1)无特定病原体BALB/c小鼠(H-2d):雌性,6~8周,体重16~18g,由中国食品药品检定研究院实验动物中心提供。(2)BW006:序列为5'-tcgacgttcgtcgttcgtcgttc-3',全硫代修饰,由云南沃森生物技术有限公司提供。(3)重组乙肝病毒表面抗原:adw2亚型,Hansenular polymorpha yeast表达,浓度为0.236mg/ml,经高效液相(HPLC)和银染测定纯度>99.0%,细菌内毒素<10EU/ml(10μg剂量),由云南沃森生物技术有限公司提供。(4)培养基:RPMI 1640、胎牛血清均为美国Hyclone公司产品。完全培养基为含10%胎牛血清、20mmol/L HEPES、2mmol/L L-谷氨酰胺、1mmol/L丙酮酸钠、0.05mmol/L 2-巯基乙醇、100U/ml青霉素、100μg/ml链霉素的 RPMI 1640。(5)淋巴细胞分离液:NycoPrepTM 1.077A,为挪威AXIS-SHIELD PoC AS公司产品。(6)磷酸盐缓冲液(PBS):8g NaCl,0.2g KCl,1.44g Na2HPO4,0.24g KH2PO4,以超纯水溶解并定容至1L(pH 7.2),过滤除菌,于4℃储存。(7)牛血清白蛋白(BSA):美国Sigma公司产品。(8)流式抗体:CD80-FITC、CD86-PE、CD69-PE,美国 Bio-Legend公司产品;CD3e-PE-Cy5、CD19-APC,美国BD公司产品。
2.方法:(1)BW006与HBsAg体外刺激对B细胞活化的影响:①无菌分离小鼠脾单个核细胞(MNCs),以完全培养基调细胞浓度为2×106/ml;②细胞孵育:设4个实验组,每组4孔,于24孔细胞培养板中每孔加入0.5ml MNCs,并分别加入完全培养基(对照组)、40μg HBsAg、5μg BW006、40μg HBsAg+5μg BW006,终体积均为 1ml。置于 37℃,5%CO2培养箱孵育24h;③流式荧光抗体标记检测:调MNCs浓度为1×107/ml,取100μl至流式管,分别用大鼠抗小鼠 APC-CD19、PECD86、FITC-CD80单克隆抗体三色标记B细胞,同时设阴性对照管、同型对照管,室温闭光静置20min。加入2ml PBS,1000r/min离心5min,弃上清,再加入PBS重复洗涤1次,以500μl 1%多聚甲醛重悬固定细胞。流式细胞仪检测,以APC-CD19b圈出B细胞,计算B细胞活化分子CD80、CD86表达水平。(2)BW006与HBsAg体外刺激对T细胞活化的影响:①脾MNCs分离与孵育,同(1);②荧光抗体标记检测:调MNCs浓度为1×107/ml。取100μl细胞至流式管,以大鼠抗小鼠PE-CY5-CD3、PE-CD69单克隆抗体双色标记T细胞,同时设阴性对照管、同型对照管,室温闭光孵育20min。细胞洗涤与固定同(1)。流式细胞仪检测,以PE-CY5-CD3圈出T细胞,计算T细胞活化分子CD69表达水平。(3)BW006与HBsAg体内免疫对B细胞活化的影响:①16只小鼠随机分为4组,分别于背部皮下免疫生理盐水(对照组)、4μg HBsAg、20μg BW006 和 4μg HBsAg+20μg BW006,注射体积均为100微升/只;②免疫24h时处死小鼠,无菌分离脾MNCs;③流式抗体标记检测,同(1)。(4)BW006与HBsAg体内免疫对T细胞活化的影响:①动物免疫方案同(3);②免疫24h时处死小鼠,无菌分离脾MNCs;③流式抗体标记检测,同(2)。
结 果
1.BW006与HBsAg体外刺激对B细胞活化的影响:分别以40μg HBsAg、5μg BW006、40μg HBsAg+5μg BW006及完全培养基刺激鼠脾MNCs,24h时检测B细胞CD80和CD86的表达水平。结果如图1所示,体外刺激24h时,5μg BW006组和40μg HBsAg+5μg BW006组 B细胞 CD80阳性率(25.88% ±1.92%,27.36% ±1.77%)显著高于对照组(10.41% ± 0.72%)(P 均 <0.01),CD86 阳性率(98.90% ±0.16%,98.92% ±0.09%)显著高于对照组(74.85% ±5.13%)(P 均 <0.01),CD86 平均荧光强度(832.66 ±51.08,877.64 ±53.72)显著高于对照组(377.01 ±24.61)(P 均 <0.01)。
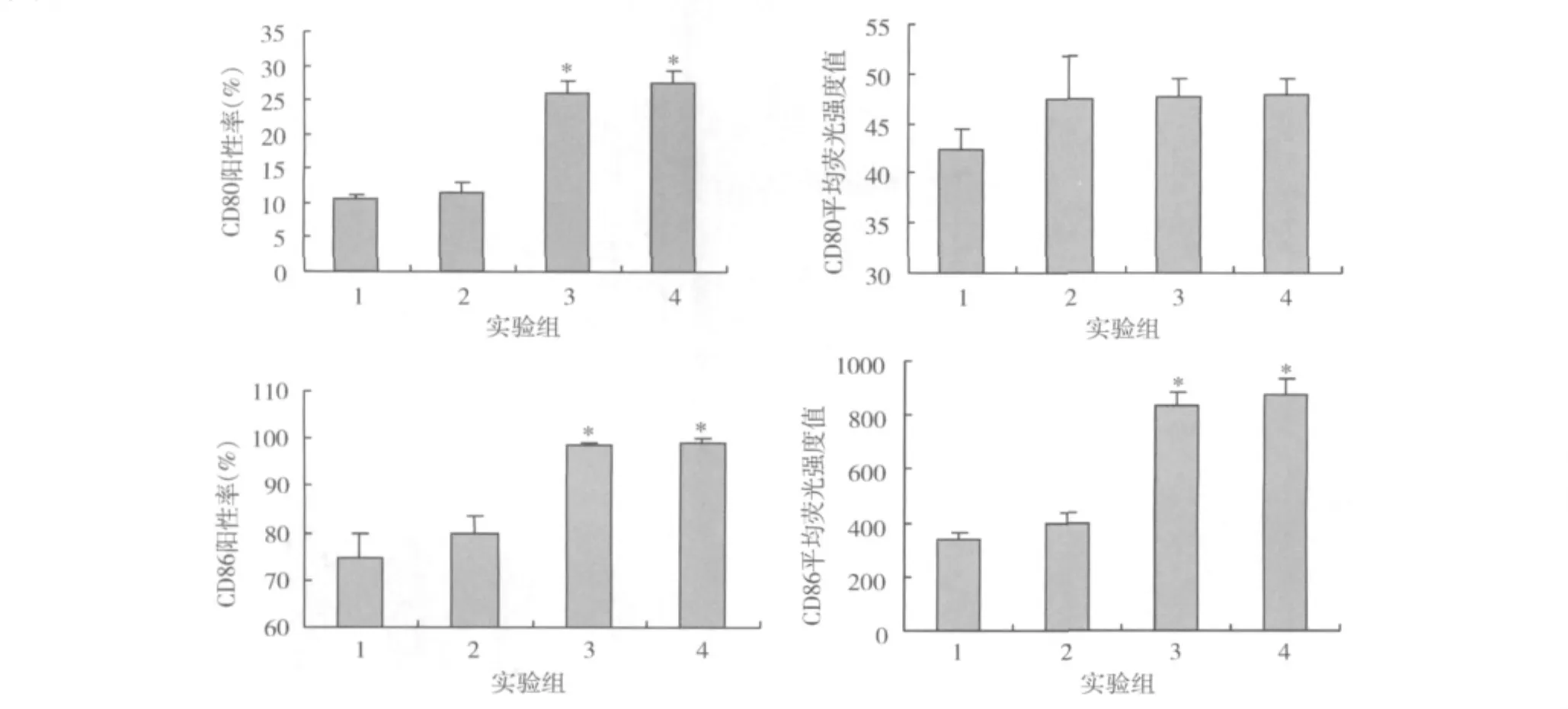
图1 BW006与HBsAg体外刺激B细胞活化分子CD80、CD86的表达
2.BW006与HBsAg体外刺激对T细胞活化的影响:分别以 40μg HBsAg、5μg BW006、40μg HBsAg+5μg BW006及完全培养基刺激鼠脾MNCs,24h时检测T细胞表面分子CD69的表达水平,结果见图2。40μg HBsAg+5μg BW006组CD69表达阳性率显著高于对照组(12.47% ±3.31%vs 7.15% ±1.37%,P<0.01);40μg HBsAg+5μg BW006 组 CD69平均荧光强度显著高于 BW006组(387.11±10.32 vs 307.85 ±11.46,P <0.01)和对照组(387.11 ±10.32 vs 130.06 ±13.32,P <0.01)。

图2 BW006与HBsAg体外刺激T细胞活化分子CD69的表达
3.BW006与HBsAg体内免疫对B细胞活化的影响:如图 3 所示,免疫 24h时,4μg HBsAg+20μg BW006组小鼠脾B细胞CD80的阳性率显著高于BW006 免疫组(12.26% ±2.33%vs 9.80% ±1.17%,P<0.05)和生理盐水免疫组(12.26% ±2.33%vs 8.50% ±1.34%,P <0.05),CD86阳性率显著高于生理盐水免疫组(63.84% ±1.48%vs 56.69% ±1.33%,P<0.05),CD86平均荧光强度显著高于BW006免疫组(94.71% ±6.51%vs 91.22% ±4.36%,P <0.05)和生理盐水免疫组(94.71% ±6.51%vs 85.46% ±1.01%,P <0.05)。

图3 BW006与HBsAg皮下免疫诱导B细胞CD80、CD86分子的表达
4.BW006与HBsAg体内免疫对T细胞活化的影响:皮下免疫 20μg BW006和(或)4μg HBsAg,24h时检测T表面协同刺激分子CD69的表达水平,结果如图4所示。BW006联合HbsAg免疫24h时T细胞CD69表达阳性率显著高于BW006组(33.97% ±2.17% vs 31.32% ±2.78%,P<0.05)和生理盐水组(33.97% ±2.17%vs 27.77%±2.51%,P<0.05),CD69平均荧光强度显著高于生理盐水组(182.14% ±11.29%vs 162.92% ±6.44%,P < 0.05)。
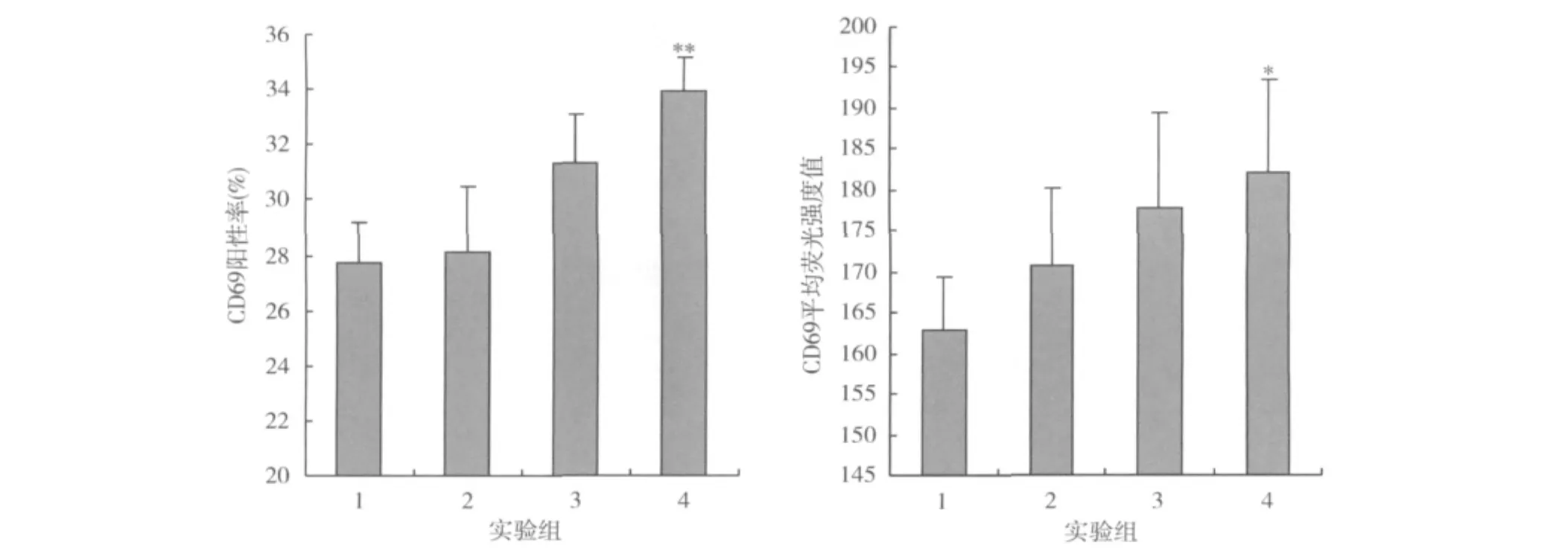
图4 BW006与HbsAg皮下免疫诱导NK细胞早期活化分子CD69的表达
讨 论
CpG-ODN是以未甲基化的CpG为核心的寡聚脱氧核苷酸,具有广泛的生物学活性,如非特异性抗感染、抗肿瘤、免疫调节等[6~8]。但目前有关CpGODN细胞免疫机制的研究主要集中在体液免疫方面,对其细胞免疫的研究较少。为研究BW006对免疫细胞的活化作用,我们通过体外克隆刺激与体内免疫刺激的途径,应用流式细胞术探讨了一种新型CpG-ODN(BW006)对B、T淋巴细胞膜表面分子表达的影响,对BW006在B、T淋巴细胞免疫机制中的作用进行了研究,为其作为乙肝疫苗佐剂提供依据。
CD80、CD86是两个提供协同刺激信号的重要分子,二者均以单体形式表达于抗原递呈细胞表面。经活化后,CD80、CD86的表达均显著上调。激活的B细胞、单核细胞、树突状细胞、巨噬细胞均表达高水平CD80 和 CD86[9]。
CD69是C-型凝集素受体家族的成员,通常以同源二聚体形式存在,静止的T细胞一般不表达CD69,通过T细胞受体接受刺激后表达CD69,后者作为细胞共刺激信号进一步增强细胞的活化或增殖分化[10,11]。
BW006和HBsAg体外诱导小鼠免疫细胞活化结果表明,BW006和HBsAg联合诱导B细胞活化水平显著高于对照组,但与单用BW006诱导B细胞活化水平比较无显著性差异,可能与BW006本身活化B细胞作用较强有关;而BW006和HBsAg联合诱导T细胞活化水平显著高于对照组,且荧光强度亦显著高于BW006组,表明BW006体外刺激可协同HBsAg活化T淋巴细胞。B细胞与T细胞活化情况略有不同,可能与BW006和HBsAg对不同免疫细胞刺激机制不同有关。
BW006和HBsAg联合免疫小鼠,可显著上调B细胞表面分子CD80、CD86和T细胞早期活化分子CD69的表达水平。由此可见,BW006能够协同HB-sAg活化T细胞。表明BW006体内刺激可协同HB-sAg活化B、T淋巴细胞。
本研究结果表明,BW006联合HBsAg,能够有效活化B、T淋巴细胞,提高机体细胞免疫应答水平。活化剂作为新型预防性或治疗性乙肝疫苗的新型佐剂具有较大的潜力。
1 Lin KW,Kirchner JT.Hepatitis B[J].Am Fam Physician,2004,69(1):75-82
2 Mostert MC,Richardus JH,De M R.Referral of chronic hepatitis B patients from primary to specialist care:making a simple guideline work[J].J Hepatol,2004,41(6):1026 -1030
3 孙玉红,朱朝敏,谢尧.含CpG基序的寡脱氧核苷酸联合乙型肝炎表面抗原免疫转基因小鼠的实验研究[J].中华肝脏病杂志,2005,13(1):61 -62
4 Malanchere-Bres E,Payette PJ,Mancini M,et al.CpG oligodeoxynucleotides with hepatitis B surface antigen(HBsAg)for vaccination in HBsAg-transgenic mice[J].J Virol,2001,75:6482 -6491
5 李文波,张修礼,姚志强.含CpG基序的寡核苷酸对乙型肝炎病毒基因疫苗的细胞免疫效应的影响[J].中国现代医学杂志,2004,14(10):104 -107
6 Krieg A M.Antiinfective applications of toll-like receptor 9 agonists[J].Proc Am Thorac Soc,2007,4(3):289 -294
7 Friedberg J W,Kim H,Mccauley M,et al.Combination immunotherapy with a CpG oligonucleotide(1018 ISS)and rituximab in patients with non-hodgkin lymphoma:increased interferon-alpha/beta-inducible gene expression,without significant toxicity[J].Blood,2005,105(2):489-495
8 Weigel B J,Rodeberg D A,Krieg A M,et al.CpG oligodeoxynucleotides potentiate the antitumor effects of chemotherapy or tumor resection in an orthotopic murine model of rhabdomyosarcoma[J].Clin Cancer Res,2003,9(8):3105-3114
9 Kalinski P,Hilkens C M,Wierenga E A,et al.T-cell priming by type-1 and type-2 polarized dendritic cells:the concept of a third signal[J].Immunol Today,1999,20(12):561 -567
10 Cho D,Campana D.Expansion and activation of natural killer cells for cancer immunotherapy[J].Korean J Lab Med,2009,29(2):89 -96
11 Vazquez BN,Laguna T,Carabana J,et al.CD69 gene is differentially regulated in T and B cells by evolutionarily conserved promoter-distal elements[J].J Immunol,2009,183(10):6513-6521