阿克苷神经保护机制研究进展
王双珠 曾 勇 李 燕 贺震旦
一、阿克苷概述
阿克苷(acteoside)属于苯丙素苷化合物(phenylpropanoid glycosides,PPGs),阿克苷结构中的配基为苯乙醇基,配糖基为1个葡萄糖和1个鼠李糖基,取代基为肉桂酰基,为天然糖苷化合物。广泛存在于双子叶植物中,和绿茶多酚一样属于天然多酚类成分。阿克苷结构式见图1。
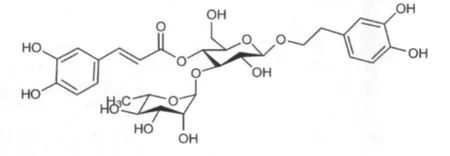
图1 阿克苷结构式
阿克苷自1968年首先从洋丁香分离获得以来,至今已证实分布于唇形科(labiatae)15属41种,紫薇科(bignoniaceae)4属5种,木犀科(oleaceae)7属12种,列当科(orobanchaceae)5属10种,玄参科(scrophulariaceae)21属34种,马钱科(loganiaceae)2属7种,马鞭草科(verbenaceae)12属31种,车前科(plantaginaceae)2属7种,爵床科(acanthaceae)2属3种,木兰科(magnoliaceae)1属2种,苦槛蓝科(myoporaceae)1属1种,蓼科(polygonaceae)1属1种,菊科(compositae)1属1种,胡麻科(pedaliaceae)1属1种,桔梗科(campanulaceae)1属1种,胡椒科(piperaceae)1属1种,苦苣苔科(gesneriaceae)1属1种,蔷薇科(rosaceae)1属1种,共计79属160种植物中。近年研究表明阿克苷具有多种生理活性:抗氧化、抗病毒、保肝、抗肿瘤转移、抗炎、降血脂、抗菌、神经保护、抗凝血、降血压、心血管保护和免疫调节等[1~16]。由于阿克苷具有多种生理活性,分布广泛,资源丰富,因此对其药用价值的研究已成为天然药物研发的新热点。阿克苷是新一类天然活性结构分子类群,随着药理研究的不断深入,必将给阿克苷的临床应用带来广阔的前景。
二、阿克苷的神经保护作用机制
神经细胞是神经系统的主体,神经元的损伤是诸多神经疾病的主要原因,卒中、中毒、外伤、感染、变性都是因为神经元受到致病因子的损害导致不可逆的功能丧失。近年研究神经元损伤的机制包括氧化损伤、自由基、炎症、兴奋性毒性、钙离子超载、凋亡及免疫损伤等。神经保护治疗就是通过药物等手段阻断神经细胞坏死的不同环节,增加神经细胞存活能力,促进神经功能的恢复。研究表明阿克苷具有以下生理活性以保护神经细胞。
1.抗氧化作用:超氧阴离子(O-2)、羟自由基(OH·)、过氧化氢(H2O2)和单线态氧(1O2)等属于机体代谢过程中产生的活性氧族(reactive oxygen species,ROS),正常情况下自由基的产生和清除处于动态平衡。自由基构成和抗氧化防御机制的失衡是造成氧化损伤的原因之一。大量证据表明氧化应激引起自由基的过度产生会引起神经细胞的死亡,过多的自由基,导致细胞和细胞器损伤,特别是对线粒体。线粒体是产生氧自由基的场所也是细胞的能量合成中心,线粒体也是细胞凋亡信号传导途径中非常重要的传导通路。急性大量的ROS抑制电子传递链酶复合体Ⅰ、Ⅱ、Ⅲ活性,使线粒体ATP生成减少,出现能量合成障碍并引发氨基酸兴奋性毒性,还可造成线粒体及细胞内蛋白质,脂类及核酸的氧化,最终造成线粒体功能的损害。脂质过氧化反应并产生大量有害代谢产物气质包括毒性最大的丙二醛(MDA),其造成线粒体膜膜电位减低,通透性增大,Ca2+内流增多,细胞色素C释放,mRNA突变等最终导致细胞凋亡,是衰老及其他神经退行性疾病的主要发病机制之一。多项研究表明阿克苷具有很强的抗氧化活性,在兔肢体固定造成肌肉萎缩模型中及大鼠肌肉运动损伤模型中,研究发现阿克苷可以减少脂质过氧化后MDA的产生,在对牛肺血管内皮细胞的氧化损伤模型研究中证实阿克苷具有很强的自由基清除能力[2,17~19],在β-淀粉样肽(amyloid β -peptide,Aβ)诱导的 SHSY5Y细胞(人神经母细胞瘤细胞)损伤模型、细菌诱导大鼠胶质瘤细胞系C6细胞感染产生炎症反应模型及海洛因诱导大鼠大脑氧化损伤等模型研究中发现,阿克苷具有减少活性氧ROS,增强SOD生物活性等作用[10,20,21]。
2.抑制谷氨酸:谷氨酸是中枢神经系统主要的兴奋性神经递质,具有重要的生理功能。但是谷氨酸受体的过度表达会导致神经细胞的功能障碍,甚至是损伤、死亡,这就是谷氨酸的神经毒性,其在神经系统的许多疾病中起着决定性的作用,特别是阿尔茨海默病(Alzheimer's disease)、帕金森病(Parkinson's disease)、癫痫及脑缺血发作。谷氨酸引起的神经毒性与NOS(一氧化氮合成酶)和活性氧ROS的增加以及伴随的过量钙离子的流入有密切关系,最终发生脂质过氧化。在对细菌诱导大鼠胶质瘤细胞系C6细胞感染产生炎症反应模型及经LPS(脂多糖)诱导巨噬细胞产生诱生型一氧化氮合成酶(iNOS)的模型的研究表明,阿克苷可以有效抑制钙离子流入,并且可以通过抑制iNOS以抑制NO的过度产生[20];阿克苷还具有促进抗氧化防御系统如还原型谷胱甘肽GSH,过氧化物歧化酶SOD等,以减轻免疫应激的作用[22,23]。线粒体膜电位的降低是谷氨酸引起的神经毒性的另一特征,这提示线粒体膜功能的降低。对经1-甲基-4-苯基吡啶(MPP+)诱导的PC12细胞(大鼠肾上腺嗜铬细胞瘤细胞系)损伤模型及Aβ诱导的SH-SY5Y细胞损伤模型研究表明阿克苷可以增加受损线粒体的膜电位,这可能与其抑制钙离子的流入和氧化应激有关[10,11,24]。
3.调节信号转导通路:丝裂酶原活化蛋白激酶(MAPK)是一类重要的细胞信号传导介质,可以将细胞外信号转导至胞内,参与细胞内若干信号转导的重要级联过程,细胞外刺激通过MAPK的磷酸化级联反应引起细胞内应答,从而参与细胞的生长分化,调节细胞周期和细胞凋亡等过程。核因子κB(NF-κB)是真核细胞的转录因子,也是一类重要的细胞信号传导介质,主要参与机体防御反应、组织损伤和应激、细胞分化和凋亡,以及肿瘤生长抑制过程的信息传递。当MAPK及NF-κB被激活后可以诱导iNOS等炎症介质的表达从而放大炎症反应,引起细胞的氧化损伤并最终诱导细胞凋亡。大量研究表明抗氧化物可以抑制核因子κB(nuclear factor kappa B,NF-κB)的活性[25]。Emanuela Mazzon 等[26]研究发现在二硝基本磺酸盐诱导下的大肠炎细胞培养模型中,阿克苷减少了该模型中增多的 NF-κB及 iNOS。Emanuela Esposito等研究还发现阿克苷可以通过抑制NF-κB和MAPK的活性以减少相应蛋白质的表达[20]。Jeong Yong Lee等研究发现在巨噬细胞培养中阿克苷可以通过抑制AP1通路减少脂多糖诱生型iNOS的表达,这些也提示了阿克苷的神经保护机制可能与其对转录因子的调节而最终改变基因的表达有关。
4.抗凋亡作用:细胞凋亡是一种由细胞内基因调控的主动死亡过程,在调控机体发育,控制细胞衰老,维持内环境稳定中起重要作用。当细胞凋亡失调时可引起多种疾病。其在神经系统发育、神经退行性病变和兴奋性神经元损伤中均起重要作用。目前认为细胞凋亡有3条基本通路:线粒体途径、死亡受体途径和内质网途径。在这3条凋亡通路中半胱氨酰天冬氨酸特异性蛋白酶(caspase)的级联反应起重要作用。尽管不同的信号可以激活不同的caspase,但最终都是通过激活caspase-3激活凋亡级联反应,caspase-3是已知的最重要的凋亡执行者。Bcl-2及Bax是细胞凋亡线粒体通路的组成基因,分别具有抑制细胞凋亡及促进细胞凋亡的作用。对阿克苷在阿尔茨海默病细胞模型包括MPP+诱导的PC12细胞凋亡及β-淀粉样肽诱导的SH-SY5Y细胞凋亡模型研究中,经阿克苷处理后不仅MPP+诱导的PC12细胞及SHSY5Y细胞凋亡数目减少,而且荧光酶标仪显示caspase-3活性下降,并用Western blot测定了caspase-3的量,证实了其抑制神经元凋亡的机制之一在于抑制 caspase-3的活性[10,24]。研究还发现阿克苷可以通过调节Bcl-2,细胞色素C(cytochrome C)等细胞凋亡信号通路以实现对细胞的保护[10]。
三、结 语
中枢神经损伤后的神经保护和再生一直是神经科学研究的难点和重点,经过大量研究已发现多种神经保护的药物和方法,但都未能从根本解决这一难题。因此,临床上迫切需要更多的具有确切神经保护作用的药物。大量研究表明,阿克苷具有多种生物学效用,而对其神经保护作用的研究尤其受到关注。目前,对阿克苷神经保护的研究主要还处于细胞培养阶段,其神经保护机制尚未完全阐明。虽然在相关神经细胞的损伤模型的研究中证实阿克苷确实具有抗氧化、抑制谷氨酸盐、抑制细胞凋亡等作用以保护神经细胞,但对于其研究还有待进一步完善。如阿克苷是否还通过其他途径保护神经细胞。Jun Zhao在对大鼠免疫性肝损伤模型的研究显示阿克苷具有调节免疫而起到保护肝脏的作用,而免疫调节也是现今研究神经保护的热点[16]。阿克苷对神经元是否也通过调节免疫而起到保护神经细胞的作用,这些也是下一步研究的方向。再如,在典型的神经损伤动物模型中阿克苷是否具有神经保护作用,阿克苷对人类是否具有神经保护作用以及神经保护作用的细胞靶点及信号传导通路等也都有待进一步研究。阿克苷来源广泛,资源丰富且具有多种神经保护方面的生理活性,具有广泛的临床应用前景,期望其在人类神经损伤疾病中发挥积极作用。
1 He ZD,Lau KM,Xu HX,et al.Antioxidant activity of phenylethanoid glycosides from brandisia hancei[J].J Ethnopharmacol,2000,71(3):483-486
2 Nguyen XN,Phan VK,Chau VM.Phenylpropanoid glycosides from heterosmilax erythrantha and their antioxidant activity[J].Arch Pharm Res,2009,32(10):1373-1377
3 Kim HJ,Yu YG,Park H,et al.HIV gp41 binding phenolic components from fraxinus sieboldiana var,angustata[J].Planta Medica,2002,68(11):1034-1036
4 Xiong G,Hase K,Tezuka Y,et al.Hepatoprotective activity of phenylethanoids from cistanche deserticola[J].Planta Medica,1998,64(2):120-125
5 Ohno T,Inoue M,Ogihara Y,et al.Antimetastatic activity of acteoside,a phenylethanoid glycoside[J].Biolog Pharm Bull,2002,25(5):666-668
6 Chen RC,Su JH,Yang SM,et al.Effect of isoverbascoside,a phenylpropanoid glycoside antioxidant,on proliferation and differentiation of human gastric cancer cell[J].Acta Pharmacol Sin,2002,23(11):997-1001
7 Backhouse N,Rosales L,Apablaza LC.GöltyAnalgesic,anti-inflammatory and antioxidant properties of Buddleja globosa[J].Buddlejaceae J Ethnopharmacol,2008,116(2):263-269
8 Yerra KR,Shih HF,Shih CH,et al.The constituents of anisomeles indica and their anti-inflammatory activities[J].Journal of Ethnopharamacology,2009,121(2):292-296
9 Hossein NM,Mukhlesur R,Simon G.Assessment of the antibacterial activity of phenylethanoid glycosides from Phlomis lanceolata against multiple-drug-resistant strains of staphylococcus aureus[J].J Nat Med,2008,62:91-95
10 Hongquan W,Yuxia X,Jie Y,et al.Acteoside protects human neuroblastoma SH-SY5Y cells against beta-amyloid-induced cell injury[J].Brain Res,2009,1283:139-147
11 Kyung AK,Seung HK,Tae HO,et al.Acteoside and its aglycones protect primary cultures of rat cortical cells from glutamate-induced excitotoxicity[J].Life Sci,2006,79(7):709-716
12 Tognolini M,Barocelli E,Ballabeni V,et al.Comparative screening of plant essential oils:phenylpropanoid moiety as basic core for antiplatelet activity[J].Life Sci,2006,78(13):1419-1432
13 Kang DG,Lee YS,Kim,et al.Angiotensin converting enzyme inhibitory phenylpropanoid glycosides from Clerodendron trichotomum[J].J Ethnopharmacol,2003,89(1):151-154
14 Fang G,Li Y,Guixin C,et al.Bioguided isolation of angiotensinconverting enzyme inhibitors from the seeds of Plantago asiatica L[J].Phytotherapy Res,2010,24(7):1088-1094
15 Kris-Etherton PM,Hecker KD,Bonanome A,et al.Bioactive compounds in foods:their role in the prevention of cardiovascular disease and cancer[J].Am J Med,2002,113(9):71-88
16 Jun Z,Tao L,Long M,et al.Protective effect of acteoside on immunological liver injury induced by Bacillus Calmette-Guerin plus lipopolysaccharide[J].Planta medica,2009,75(14):1463-1469
17 Ming JL,Jing XL,Hong ZG,et al.The effects of verbascoside on plasma lipid peroxidation level and erythrocyte membrane fluidity during immobilization in rabbits a time course study[J].Life Sci,2003,73(7):883-892
18 Li JX,Dong X.Effect of verbascoside on decreasing concentration of oxygen free radicals and lipid peroxidation in skeletal muscle[J].Acta Pharmacol Sin,1999,20(2):126-130
19 Wen FC,Lie CL,Chieh FC.Acteoside protects endothelial cells against free radical-induced oxidative stress[J].J Pharm Pharmacol,2004,56(6):743-748
20 Emanuela E,Roberto DT,Giovanna P,et al.Protective effect of verbascoside in activated C6 glioma cells:possible molecular mechanisms[J].Arch Pharmacol,2010,381(1):93-105
21 Zheng Q,Zhang Y.Effects of verbascoside and luteolin on oxidative damage in brain of heroin treated mice[J].Pharmazie,2005,60(7):539-543
22 Raneva V,Shimasaki H,Ishida T,et al.Antioxidative activity of 3,4-dihydroxyphenylacetic acid and caffeic acid in rat plasma[J].Lipids,2001,36(10):1111-1116
23 Martin NF,Sahpaz S,Furman C,et al.Natural phenylpropanoids protect endothelial cells against oxidized LDL-induced cytotoxicity[J].Planta Medica,2003,69(3):207-211
24 Guo QS,Jin RZ,Xiao PP,et al.Protective effect of verbascoside on 1-methyl-4-phenylpyridinium ion-induced neurotoxicity in PC12 cells[J].Eur J of Pharmacol,2002,451(2):119-124
25 Cuzzocrea S,Pisano B,Dugo L,et al.Superoxide-related signaling cascade mediates nuclear factor-kappa B activation in acute inflammation[J].Antioxid Redox Signal,2004,6(4):699-704
26 Emanuela M,Emanuela E.Effects of verbascoside biotechnologically produced by Syringa vulgaris plant cell cultures in a rodent model of colitis[J].Naunyn-Schmied Arch Pharmacol,2009,380(1):79-94