反胶束体系中固定化胃蛋白酶的催化性质研究
伏振宇,李志光,何纯莲
(1.湖南农业大学理学院,湖南 长沙 410128;2.湖南师范大学医学院,湖南 长沙 410006)
反胶束酶反应系统是胶体界面化学与生物技术交叉领域的研究内容[1]。在非水有机介质中,对反胶束体系酶催化性能的研究已受到广泛关注[2~6]。反胶束体系包括3个组成部分:表面活性剂、水和非极性有机溶剂。表面活性剂的极性头部指向含水微球的内部,脂肪族的尾部指向非极性有机溶剂。在反胶束体系中水结构的形成可能与生物膜类似[7],有资料指出,当酶处在细胞内的环境中时,反胶束体系能够与周围的微环境相适应[2,8]。
反胶束介质在宏观上为均一透明的热力学稳定体系,在微观上则可视为由高度分散的单个反胶束聚集体构成的非均一溶液,可为反应提供受纳米尺度调控的介观环境,因而被视为纳米反应器的一种类型[1]。近年来,随着纳米科学技术的迅速发展,反胶束作为纳米反应器的优点也不断凸现[9,10],被视为很容易改变酶的物理性质的微型反应器。人们通过改变这种环境的物理性质,有可能在发生反应的“水池”里定制各种性质的模型。
胃蛋白酶在监测分析和食品工业中具有重要价值。作者在此用CTAB(十六烷基三甲基溴化铵)/环己烷/正辛醇反胶束体系固定胃蛋白酶,讨论了反胶束体系含水率、乙醇体积分数对固定化胃蛋白酶活力的影响,并对固定化胃蛋白酶与游离胃蛋白酶的催化性质进行了比较,拟为反胶束中胃蛋白酶用于酶法测定提供参考。
1 实验
1.1 试剂与仪器
胃蛋白酶,上海泛柯生物科技有限公司;酪蛋白,杭州微生物试剂有限公司;L-酪氨酸,西安沃尔森生物技术有限公司;CTAB,湖南湘中化学试剂有限公司;其它试剂均为分析纯。
WFZ800-D3B型紫外可见分光光度计,北京瑞利分析仪器公司;空气摇床,上海智城分析仪器制造有限公司;TDL-4ZB型台式低速自动平衡离心机,湖南星科科学仪器有限公司;ZSD-2型卡尔费休水分测定仪,上海易友仪器有限公司;JY88-IIN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司。
1.2 方法
1.2.1 胃蛋白酶溶液的制备
准确称量25 mg胃蛋白酶,用pH=3的磷酸氢二钠-柠檬酸缓冲溶液溶解并定容至50 mL,即得0.5 mg·mL-1的胃蛋白酶溶液。
1.2.2 固定化胃蛋白酶的制备
CTAB反胶束体系的制备:称量9.0 g CTAB,加入30 mL环己烷和120 mL正辛醇,置于超声波细胞粉碎机中溶解至无色透明,冷却后于4 ℃冰箱中保存。
取10 μL 0.5 mg·mL-1的胃蛋白酶溶液和80 μL pH=3的缓冲溶液加至2.0 mL CTAB反胶束体系中,用力振荡,置于恒温摇床中180 r·min-1振荡20 min至无色透明,即制得胃蛋白酶反胶束。取90 μL 8.0 mg·mL-1的酪蛋白,加至2.0 mL CTAB反胶束体系中,用力振荡,置于恒温摇床中180 r·min-1振荡20 min至无色透明,即制得酪蛋白反胶束。
改变注入反胶束体系中缓冲溶液的体积,可以获得不同含水率的胃蛋白酶反胶束和酪蛋白反胶束。为测定助溶剂乙醇对固定化胃蛋白酶的影响,制备了不同乙醇体积分数的胃蛋白酶反胶束和酪蛋白反胶束。
1.2.3 固定化胃蛋白酶催化性质研究
为了避免胃蛋白酶与表面活性剂或有机溶剂接触可能导致的酶变性,将胃蛋白酶反胶束和酪蛋白反胶束进行混合,引发固定化酶的催化反应,以研究反胶束体系中固定化胃蛋白酶的催化性质。
1.3 分析测试
1.3.1 酶活力的测定[11]
酶活力定义:在一定条件下,每分钟催化水解酪蛋白生成1 μmol酪氨酸的酶量为一个蛋白酶活力单位。
在25 °C,用紫外可见分光光度计检测275 nm水解酪蛋白的吸光度增加量。
1.3.2 酶动力学参数的测定
酶动力学参数可由米氏方程测定:
式中:v为酶促反应速率;vmax为酶被底物饱和时的反应速度;c为底物浓度;Km为米氏常数,表示v=(1/2)vmax时的底物浓度。
2 结果与讨论
2.1 含水率对固定化胃蛋白酶活力的影响
25 ℃下,改变注入反胶束体系中缓冲溶液的体积,获得含水率为7%~18%的胃蛋白酶反胶束和酪蛋白反胶束,混合,引发酶促反应,然后用紫外可见分光光度计检测275 nm水解酪蛋白的吸光度增加量,考察含水率对固定化胃蛋白酶活力的影响,结果见图1。
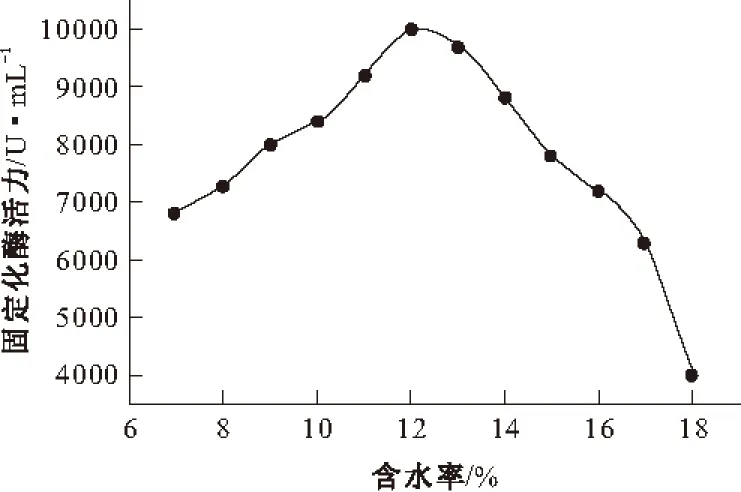
图1 含水率对固定化胃蛋白酶活力的影响
由图1可知,反胶束含水率为12%时固定化胃蛋白酶有最大的催化效率。当含水率低于12%时,酶活力随着含水率的增加而上升;当含水率高于12%时,酶活力随着含水率的增加呈现下降的趋势。这是因为,在反胶束内,可能存在不同水结构的区域[12],一个区域的周围有表面活性剂的极性头部,而另一个区域则是“水池”中间的自由水。在低含水率下,所有的水被结构化,酶的稳定性较高;当含水率增加时,反胶束的水结构会改变,固定化酶的活力相应升高,直至达到最高;当含水率继续增加时,自由水的含量会增加,固定化酶的活力和稳定性均会降低;在更高的含水率下,由于反胶束体系的不稳定性导致固定化酶活力急剧下降。
2.2 乙醇体积分数对固定化胃蛋白酶活力的影响
25 ℃下,将乙醇体积分数为0%、10%、20%、30%、40%、50%的胃蛋白酶反胶束和乙醇体积分数为0%、10%、20%、30%、40%、50%的酪蛋白反胶束混合,引发酶促反应,然后用紫外可见分光光度计检测275 nm水解酪蛋白的吸光度增加量,考察乙醇体积分数对固定化胃蛋白酶活力的影响,结果见图2。
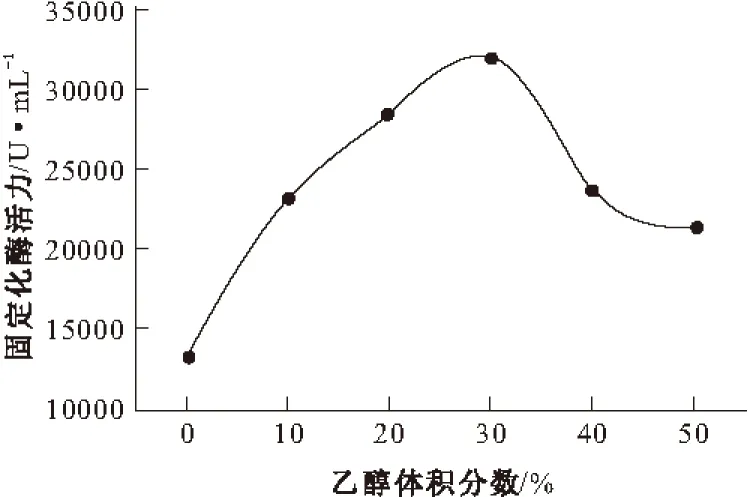
图2 乙醇体积分数对固定化胃蛋白酶活力的影响
由图2可知,反胶束的乙醇体积分数为30%时固定化胃蛋白酶有最大的催化效率。当乙醇体积分数低于30%时,酶活力随着乙醇体积分数的增加而上升;当乙醇体积分数高于30%时,酶活力随着乙醇体积分数的增加呈现下降的趋势。这是因为,在较低乙醇体积分数下,乙醇的助溶作用使胃蛋白酶进入到“水池”中,从而避免了有机溶剂和表面活性剂对其活性位点的抑制作用[13],胃蛋白酶活力随乙醇体积分数的增加而上升;而在较高乙醇体积分数下,由于反胶束体系的不稳定性导致固定化胃蛋白酶活力下降。
2.3 游离酶和固定化酶的最适温度
不同温度下游离胃蛋白酶和固定化胃蛋白酶的相对酶活力见图3。
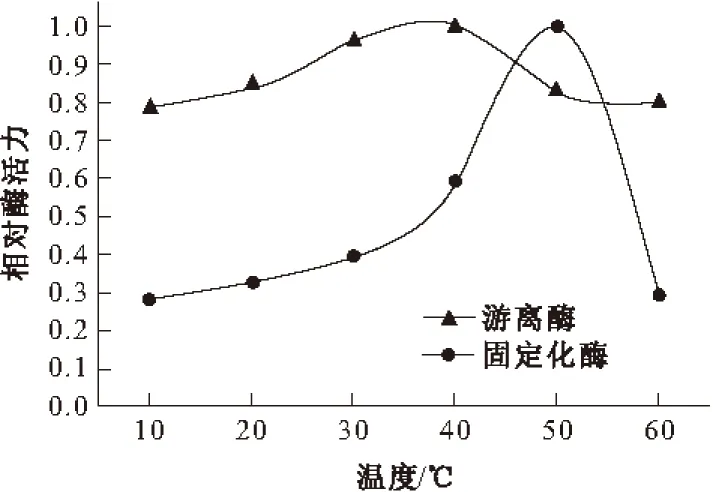
图3 温度对胃蛋白酶活力的影响
由图3可知,游离胃蛋白酶的最适温度为40 ℃,酶活力随温度的升高变化幅度较小;固定化胃蛋白酶的最适温度为50 ℃,酶活力随温度的升高变化幅度较大。这表明固定化胃蛋白酶对温度变化较明显、敏感。经固定化后,由于反胶束外层的非极性尾部对“水池”中的胃蛋白酶有保护作用,使胃蛋白酶的热稳定性增强,最适温度升高了10 ℃。
2.4 游离酶和固定化酶的最适Ca2+浓度
向缓冲溶液中加入不同浓度的Ca2+,配制成不同浓度的含胃蛋白酶的Ca2+溶液,进行酶促反应,测定酶活力,结果见图4。
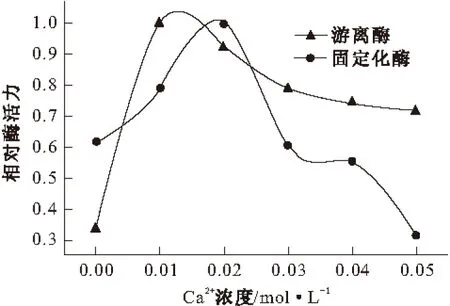
图4 Ca2+浓度对胃蛋白酶活力的影响
由图4可知,游离胃蛋白酶和固定化胃蛋白酶的最适Ca2+浓度分别为0.01 mol·L-1和0.02 mol·L-1。加入一定浓度的Ca2+能使游离胃蛋白酶活力上升,原因可能是在Ca2+存在下,酪蛋白的蛋白质结构变得疏松,增加了胃蛋白酶作用的接触位点,酶活力相应升高;但当Ca2+浓度超过0.01 mol·L-1时,酶活力反而呈现下降的趋势。而固定化胃蛋白酶活力只在一个较窄Ca2+浓度范围显著上升,当Ca2+浓度超过0.02 mol·L-1时酶活力反而降低。原因可能是CTAB是阳离子表面活性剂,当加入过量的Ca2+时,反胶束内酶所处的微水环境的离子强度过高,会抑制胃蛋白酶的活性[6]。
2.5 游离酶和固定化酶的动力学参数
分别配制不同浓度的酪蛋白溶液和酪蛋白反胶束,进行酶促反应,测定游离胃蛋白酶和固定化胃蛋白酶的动力学参数,采用双倒数法作图,结果见图5。
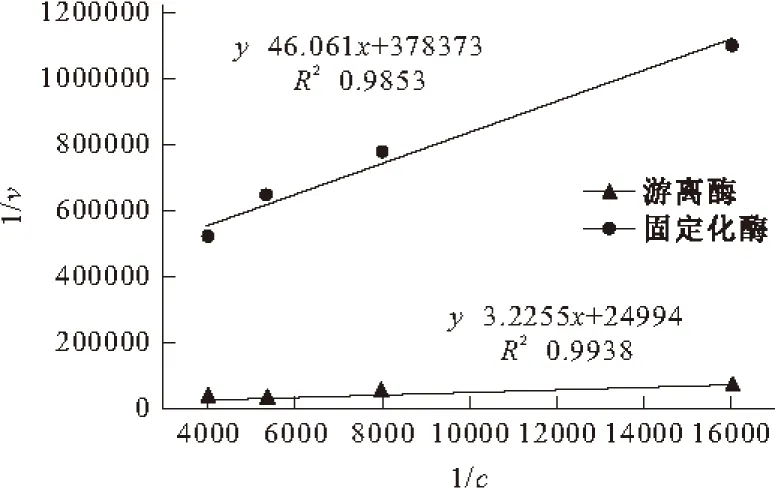
图5 胃蛋白酶的Lineweaver-Burk曲线
在25 ℃、pH值为3的条件下,游离胃蛋白酶的动力学参数为Km=1.29×10-4mol·L-1、vmax=4.00×10-5μmol·L-1·min-1;固定化胃蛋白酶的动力学参数为Km=1.22×10-4mol·L-1、vmax=2.64×10-6μmol·L-1·min-1。固定化胃蛋白酶的米氏常数Km比游离胃蛋白酶的小,说明反胶束体系中固定化胃蛋白酶与底物的亲和力有所增大。
2.6 游离酶和固定化酶的储存稳定性
25 ℃下,游离胃蛋白酶和固定化胃蛋白酶的储存稳定性见图6。
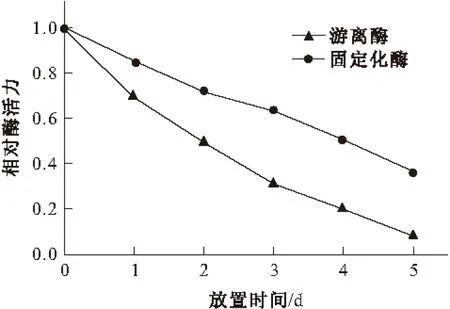
图6 胃蛋白酶的储存稳定性
由图6可知,固定化胃蛋白酶的储存稳定性比游离胃蛋白酶的要好。25 ℃放置5 d后,固定化胃蛋白酶保留37%的酶活力,而游离胃蛋白酶仅保留8%的酶活力。这是由于反胶束能提供酶的天然环境[6],能够更好地保持酶的活性。
3 结论
研究表明,利用CTAB/环己烷/正辛醇反胶束体系制备的固定化胃蛋白酶在反胶束含水率为12%、乙醇体积分数为30%时活力达到最佳。固定化胃蛋白酶和游离胃蛋白酶的最适温度分别为50 ℃和40 ℃、最适Ca2+浓度分别为0.02 mol·L-1和0.01 mol·L-1,对酪蛋白的米氏常数Km分别为1.22×10-4mol·L-1和1.29×10-4mol·L-1。固定化胃蛋白酶较游离胃蛋白酶具有更高的酶活力、更好的热稳定性和储存稳定性。
[1]梁运姗,袁兴中,曾光明,等.表面活性剂在逆胶束酶反应系统中的作用机制[J].中国科学:化学,2011,41(5):763-772.
[2]Luisi P L,Giomini M,Pileni M P,et al.Reverse micelles as hosts for proteins and small molecules[J].Biochim Biophys Acta,1988,947(1):209-246.
[3]Dordick J S,Khmelnitsky Y L,Sergeeva M V.The evolution of biotransformation technologies[J].Curr Opin Microbiol,1998,1(3):311-318.
[4]Tuena de Gómez-Puyou M,Gómez-Puyou A.Enzymes in low water systems[J].Crit Rev Biochem Mol,1998,33(1):53-89.
[5]Carvalho C M L,Cabral J M S.Reverse micelles as reaction media for lipases[J].Biochimie,2000,82(11):1063-1085.
[6]Tonova K,Lazarova Z.Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion[J].Biotechnology Advances,2008,26(6):516-532.
[7]Boicelli C A,Conti F,Giomini M,et al.The influence of phosphate buffers on the31P longitudinal relaxation time in inverted micelles[J].Spectrochim Acta Part A:Mol Spectrosc,1982,38(2):299-300.
[8]Nicot C,Vacher M,Vincent M,et al.Membrane proteins in reverse micelles:Myelin basic protein in a membrane-mimetic environment[J].Biochemistry,1985,24(24):7024-7032.
[9]冯绪胜,刘洪国,郝京诚.胶体化学[M].北京:化学工业出版社,2005:183-202.
[10]钟克利,尹炳柱,金龙一.胶束作为纳米反应器的研究进展[J].高分子通报,2009,(2):48-57.
[11]中国药典委员会.中华人民共和国药典[M].北京:科学出版社,2000:466-467.
[12]Bru R,Sánchez-Ferrer A,García-Carmona F.Kinetics models in reverse micelles[J].Biochem J,1995,310:721-739.
[13]Marhuenda-Egea Frutos C,Piera-Velázquez S, Cadenas C,et al.Reverse micelles in organic solvents:A medium for the biotechnological use of extreme halophilic enzymes at low salt concentration[J].Archaea,2002,1(2):105-111.

