钠替代钾下甜菜体内MDA含量、SOD和CAT活性的差异
郑翠兵,耿 贵,於丽华 ,邳 植
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.中国农业科学院甜菜研究所,哈尔滨150080)
黑龙江省的盐碱土分布范围广,面积近188万hm2,其中耕地盐碱化面积约57万hm2[1-3]。盐碱土属于中低产土壤,绝大多数农作物的耐盐性差,产量低。甜菜是糖料作物,又是能源作物,且耐盐性比玉米、大豆、马铃薯等农作物强,是适合于在盐碱地上种植发展的作物。植物吸收过多盐分(如Na+)要降低植物对养分(如K+)的吸收,影响植株的生长发育。而甜菜在非严重氯化钠胁迫下,大量吸收Na+虽降低了植株对K+的吸收,但通过钠替代钾功能,并未由于植物体内钾素含量降低而明显阻碍植株的生长发育。一般说来,钾在植物中的作用分为生理功能(钾的非专性作用如液泡中的渗透调节作用)和生化功能(细胞质中的钾专性和非专性作用)。依照目前的假说,在大多数作物中,K+非专性功能可以由Na+替代[4],特别是甜菜,因而甜菜表现出更耐氯化钠盐胁迫。
植物在逆境胁迫条件下,会产生活性氧胁迫,活性氧的累积主要是由大量的超氧自由基所致。对于清除超氧自由基起关键作用的是超氧化物歧化酶[5]。超氧化物歧化酶可使超氧自由基歧化生成H2O2和O2。H2O2可被过氧化氢酶或过氧化物酶进一步分解从而清除植物体内多余的H2O2,保护膜结构[6-8]。胁迫条件下细胞膜透性增强,细胞膜中脂质过氧化加强生成丙二醛,丙二醛含量的多少可以代表膜损伤程度的大小[9-10]。本试验研究了不同钠钾替代条件下不同耐盐性甜菜叶片中丙二醛含量、超氧化物岐化酶和过氧化氢酶活性的差异,为甜菜耐盐性机理研究提供理论依据。
1 材料与方法
1.1 供试材料
本试验选取两个耐盐性不同的甜菜品种25、ST13092为研究对象。所用营养液为Hoagland营养液,化学试剂均为分析纯级。
1.2 试验方法及测定项目
将选取的两份甜菜品种(25、13092;前者为耐盐性弱品种,后者为耐盐性强品种)分别在钾钠比为3∶0(CK)、1.5∶1.5、0.75∶2.25、0.15∶2.85、0.03∶2.97 的营养液中培养,培养室内条件为:光照强度为 240~250μmol,光照时间为14h。培养过程中每天测定营养液中钾钠含量,根据不同钾钠比补加钾钠,以保证营养液中钾钠含量相对稳定。培养20d后收获并按李合生等[11]的方法测定叶片中CAT和SOD活性及MDA含量。
2 结果与分析
2.1 不同钠替代钾条件下甜菜体内丙二醛含量的差异
钠替代钾下耐盐性强与弱品种丙二醛含量变化不同 (见表1)。经测定钠替代钾下耐盐性强品种叶片中的丙二醛含量未出现明显变化。说明在低浓度钾条件下耐盐性强样品细胞膜中脂质未受到明显过氧化损伤。原因可能是耐盐性强品种钠替代钾效应强,在钾钠比低的环境下可通过钠替代钾的部分功能,间接保证甜菜抗过氧化等生理调节所需的钾离子。

表1 不同钾钠比条件下丙二醛含量/(µmol/g)
耐盐性弱甜菜品种叶片中的丙二醛含量在钾钠比0.75∶2.25~0.03∶2.97中随钾钠比降低呈逐渐上升趋势,说明耐盐性弱品种钠替代钾效应弱,钾钠比低的条件下细胞膜出现过氧化损伤。
2.2 钠替代钾条件下,不同耐盐性甜菜体内超氧化物歧化酶活性的差异
2.2.1 不同耐盐性甜菜品种间超氧化物歧化酶活性差异 在不同钾钠比例培养条件下耐盐性强品种超氧化物歧化酶活性低于耐盐性弱品种超氧化物岐化酶活性(图1)。其中钾钠比(K+/Na+)3∶0组、1.5∶1.5组、0.03∶2.97组中差异比较明显,耐盐性强品种酶活性仅为耐盐性弱品种酶活性的50.4%、53.8%、47.7%,0.15∶2.85组、0.75∶2.25组中差异较小,分别为82.2%、72.2%。其原因可能为耐盐性弱品种钠替代钾效应弱于耐盐性强品种,生长过程中易受胁迫导致体内堆积更多超氧阴离子自由基,故为维持自身生长产生更多超氧化物岐化酶。
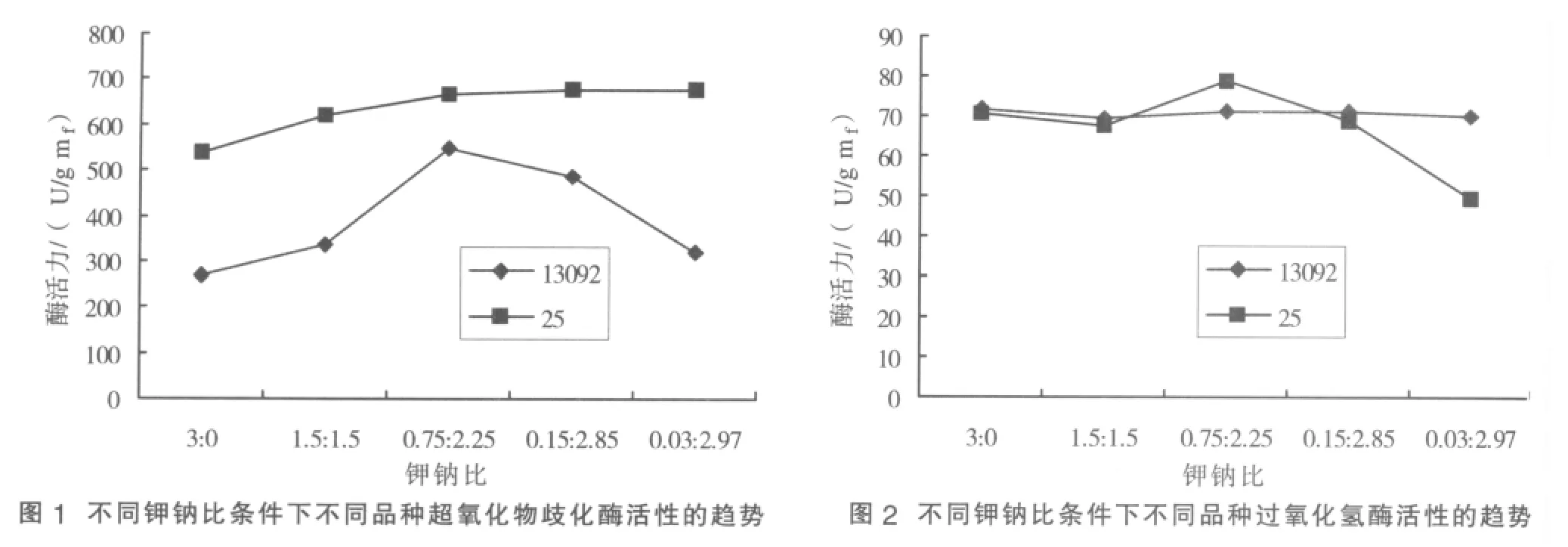
2.2.2 不同钠钾替代条件下甜菜体内超氧化物歧化酶活性的差异 发现耐盐性强品种在钾钠比3∶0~0.75∶2.25中随钾钠比的降低,超氧化物歧化酶活性提高,由269.8U/g mf上升至545.64U/g mf。其原因是随着钾的含量降低,生长受胁迫导致体内超氧阴离子自由基堆积。由于耐盐性品种自身钠替代钾效应强能间接保证自身体内用于产生酶所需的钾离子,为自身提供更多的超氧化物岐化酶以除去因胁迫堆积的超氧阴离子自由基。但在钾钠比0.75∶2.25~0.03∶2.97中超氧化物岐化酶活性随钾钠比的提高而降低,由545.64U/g mf下降至321.5U/g mf。其原因可能是在高钠低钾的情况下虽然耐盐性强品种能用钠部分替代钾但不能为自身提供足够生产酶所必须的钾离子,故超氧化物岐化酶活性降低。耐盐性弱品种在钾钠比3∶0~0.75∶2.25中变化趋势与耐盐性强品种相似。在钾钠比0.75∶2.25~0.03∶2.97中超氧化物歧化酶活性变化趋于平稳。
2.3 钠替代钾条件下,不同耐盐性甜菜体内过氧化氢酶活性的差异
2.3.1 不同耐盐性甜菜品种间过氧化氢酶活性差异 经测定在钾钠比3∶0、1.5∶1.5、0.15∶2.85条件下耐盐性强品种与耐盐性弱品种过氧化氢酶活性无明显差异 (图2),0.75∶2.25条件下耐盐性弱品种过氧化氢酶活性比耐盐性强品种酶活性略高,约10.9%。0.03∶2.97条件下耐盐性弱品种过氧化氢酶活性比耐盐性强品种酶活性略低,为耐盐性强品种酶活性的70.2%。各钾钠比条件下耐盐性强弱品种之间过氧化氢酶活性差异不大。
2.3.2 不同钠钾替代条件下甜菜体内过氧化氢酶活性的差异 经测定在钾钠比3∶0~0.03∶2.97的营养液中,耐盐性强品种过氧化氢酶活性无明显变化,酶活性在70U/g mf小幅波动。耐盐性弱品种在钾钠比3∶0~1.5∶1.5营养液中,耐盐性弱品种过氧化氢酶活性无明显变化,且与耐盐性强品种活性相当。在钾钠比1.5∶1.5~0.75∶2.25 营养液中,过氧化氢酶活性呈上升趋势,上升至 78.7U/g mf,在钾钠比 0.75∶2.25~0.03∶2.97 中呈下降趋势,由78.7U/g mf下降至49.4U/g mf。
3 讨论
钾的生理功能分为专性生理功能和非专性生理功能,钾参与各种酶的合成属于专性生理功能,钠不能替代钾直接参与酶的合成[12-13]。但在低钾环境中钠可以通过其他途径仍能为植物间接提供足量钾离子保证自身酶合成。如钠部分替代钾行使钾非专性生理功能能降低植物生长所需钾的总量、提高钾在植物体内的再利用效率[14]、提高植物对钾选择性吸收的能力等。
在钾钠比3∶0~0.03∶2.97范围内随着钾钠比的降低,耐盐性强品种丙二醛含量未出现明显变化且丙二醛含量较低,说明耐盐性强品种在钾钠比3∶0~0.03∶2.97范围中膜损伤程度小。在钾钠比3∶0~0.03∶2.97范围内耐盐性弱品种丙二醛含量呈上升趋势,说明耐盐性弱品种耐受低钾胁迫能力较弱。耐盐性强与耐盐性弱品种间丙二醛变化趋势不同,原因可能是耐盐性强品种钾钠替代效果强所致。由超氧化物歧化酶活性和过氧化氢酶活性的测定结果发现,在钾钠比3∶0~0.75∶2.25范围中样品抗氧化酶活性随钾钠比下降而上升,在钾钠比0.75∶2.25~0.03∶2.97范围中样品抗氧化酶活性随钾钠比下降而下降。说明甜菜在钾钠比3∶0~0.75∶2.25范围中能通过钠部分替代钾保证抗氧化酶合成,在钾钠比0.75∶2.25~0.03∶2.97范围中钾钠替代效应无力继续保证抗氧化酶合成所需的全部钾离子故酶活性部分受到抑制。耐盐性强品种在低钾条件超氧化物歧化酶活性受影响明显,耐盐性弱品种在低钾条件受影响不明显。耐盐性强品种过氧化氢酶活性受影响不明显,而耐盐性弱品种受影响明显。可能由于耐盐性不同、钠替代钾能力不同、自身对钾离子分配优先顺序不同导致。
在钾钠比0.75∶2.25~0.03∶2.97范围中耐盐性强品种抗氧化酶活性部分受抑制而膜中脂质过氧化产物丙二醛含量未出现明显上升,可能耐盐性强品种有其他机制保护细胞膜不受损伤。将在今后试验中做进一步研究。
4 结论
在钾钠浓度比由3∶0降至0.03∶2.97,耐盐性强品种叶片丙二醛含量未有明显变化,说明细胞膜未受过氧化损伤;而耐盐性弱品种叶片丙二醛含量逐渐提高,说明细胞膜受过氧化损伤程度增加。
在钾钠浓度比由3∶0降至0.03∶2.97,耐盐性强品种叶片超氧化物歧化酶活性先升高(钾钠浓度比0.75∶2.25时最高),然后降低;耐盐性弱品种叶片超氧化物歧化酶活性逐渐略微升高。耐盐性强品种叶片超氧化物歧化酶活性明显低于耐盐性弱品种。在钾钠浓度比由3∶0降至0.03∶2.97时,耐盐性强品种叶片过氧化氢酶活性趋于稳定;耐盐性弱品种叶片过氧化氢酶活性先升高(钾钠浓度比0.75∶2.25时最高),然后降低。耐盐性强品种叶片超氧化物歧化酶活性只有在钾钠浓度比0.03∶2.97时明显高于耐盐性弱品种。由此可以看出,不同耐盐性品种受抑制的抗氧化酶种类不同。
[1]刘功,李锐,王连敏,等.浅谈黑龙江省盐碱地利用[J].黑龙江农业科学,2007(2):108-109.
[2]刘云峰,郝永鸿,肖辉江.浅论黑龙江省的土地盐碱化[J].黑龙江国土资源,2007(6):64.
[3]王逊,尹喜霖,张杜芬,等.黑龙江省环境地质调查报告[R].黑龙江省第二水文地质工程地质勘察院,2001.
[4]张彦才,周晓芬,李巧云,等.钠替代部分钾对棉花生长和养分吸收的影响[J].植物营养与肥料学报,2006,12(1):115-118,132
[5]田敏,饶龙兵,李纪元.植物细胞中的活性氧及其生理作用[J].植物生理学通讯,2005,41(2):235-241.
[6]黄玉山,罗广华,关棨文.镉诱导植物的自由基过氧化损伤[J].植物学报,1997,39(6):522-526.
[7]罗广华,王爱国,邵从本,等.超氧物歧化酶(SOD)在大豆下胚轴线粒体内的定位[J].植物学报//英文版,1987(2):57-63.
[8]李彦,张英鹏,孙明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008(1):258-265.
[9]郭艳茹,詹亚光.植物耐盐性生理生化指标的综合评价[J].黑龙江农业科学,2006(1):66-70.
[10]费伟,陈火英,曹忠,等.盐胁迫对番茄幼苗生理特性的影响[J].上海交通大学学报//农业科学版,2005,23(1):5-9,30.
[11]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]姜理英,杨肖娥,石伟勇.钾钠替代作用及对作物的生理效应[J].土壤通报,2001(1):28-31.
[13]Figdore Scotts,GC Gerloff,WH Gabelman.The effect of increasing sodium chloride levels on potassium utilization efficiency of tomato grown under low potassium stress[J].Plant and soil,1989,119 (2):295-303.
[14]Schubert S.And Lauchi A.Na+exclusion,H+release,and growth of two different maize cultivars under NaCl Salinity[J].J Plant Physiol,1986,26:145-154.

