甜菜航天诱变SP3代育种材料不同时期同工酶差异性研究
张 辉 ,王华忠 ,2,3
(1.中国农业科学院甜菜研究所,哈尔滨150080;2.黑龙江省普通高等学校甜菜遗传育种重点实验室/黑龙江大学农作物研究院,哈尔滨 150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨 150080)
甜菜是我国主要的糖料作物之一,长期以来通过常规育种在产量、质量及抗病性方面并没有取得突破性的进展。航天诱变育种是近些年来新发展起来的一种新的诱变育种方法,大大提高了作物突变的频率,使作物在形态特征、经济性状、生育性状方面发生较大变异。刘华君、王燕飞等(1996)研究发现不同倍性的甜菜种子通过卫星搭载诱变处理后,会表现出不同的敏感性,与对照相比,四倍体材料部分性状在生长过程中受到抑制,生育期延迟,对二倍体材料的生长有明显的促进作用,生长势增强,初步说明外层空间环境不仅影响植物的生理状态,也影响植物的遗传基因[1]。王华忠等对8个甜菜航天育种材料及其对照进行田间观察及叶绿素含量分析,研究结果表明一年生航天材料与对照比较,在整个期间叶绿素含量均表现出较高的趋势,说明对于增强光合作用,提高生物产量具有较好的效果。二年生材料在叶丛生长期表现生长迟缓,有的少数植株叶片变窄,个别生长畸形,而到了抽薹期,则表现为抽薹率低[2]。刘乃新等以航天诱变的3个不同甜菜品系及其对照为材料,对生殖生长阶段的甜菜叶片的4种激素(IAA、GA、ABA和ZR)含量进行了测定,结果表明航天诱变材料发生了很大的变化[3]。但对于甜菜航天诱变材料同工酶谱分析方面还未有相关报道。同工酶一词是Markert和Moller于1957年提出来的[4],可用于研究物种进化、遗传变异、杂交育种和个体发育、组织分化等,同工酶能在一定程度上反映蛋白质水平上的信息[5-7],植物体内不同酶的同工酶谱随着细胞分化、组织器官及植株的生长、成熟发生规律性的变化,这种变化在一定程度上反映了植物在发育过程中基因表达的时空顺序性,因而同工酶的酶谱特征可以作为植物生长发育和遗传转化的一种生理生化指标[8-9]。该试验利用同工酶酶谱分析的方法研究航天诱变后的SP3代材料在生理生化水平上的变异,旨在为下一步探讨分子水平的变异性及研究变异对甜菜田间性状的影响提供参考依据。
1 材料和方法
1.1 试验材料
试验材料为搭载我国第一颗航天育种卫星“实践八号”的甜研202、甜研207、甜研212、甜研425、甜研单粒-86的SP3代衍生材料及其对照。其中甜研202、甜研207、甜研212为二倍体材料;甜研425为四倍体材料;甜研单粒-86为单粒种材料。试验用甜菜二年生材料母根栽植时期为2010年4月27日,于2010年6月20日、7月14日取样,分别为甜菜的盛花期、抽薹期。
1.2 试验方法
1.2.1 酶液提取 取预处理的甜菜叶片1.0g放入预冷的研钵中,加入预冷的1.5mL 0.02mol/L KH2PO4和0.1g PVP(聚乙烯吡咯烷酮),快速研磨成匀浆后,于离心机上5000r/min 4℃离心15min,取上清液加入等体积的10%甘油混匀,放置于4℃冰箱保存备用。
1.2.2 电泳 该试验采用不连续聚丙烯酰胺凝胶电泳,分离胶浓度为10%,浓缩胶浓度为2.4%。
1.2.3 染色 POD同工酶染色利用联苯胺染色[10];EST同工酶染色采用醋酸萘酯-坚牢蓝染色法[11]。
2 结果与分析
2.1 甜菜航天诱变SP3代二年生材料盛花期同工酶谱分析
2.1.1 二年生材料盛花期POD同工酶谱分析 为了研究方便,按同工酶谱带迁移率和颜色的不同分别将POD、EST酶谱分为A、B、C三个区域。表1为SP3代二年生育种材料各品系与盛花期POD、EST电泳图谱中序号对应表格。由SP3代二年生育种材料盛花期POD同工酶电泳(图1)可知,该图谱中总条带数为8条酶带,四倍体衍生材料HT2-425-1和HT2-425-2条带间无差异性,二者较对照在B区多出两条带;单粒种衍生材料HT8-86较对照在A区多出1条带;二倍体衍生材料不同品系:HT6-212-2较对照在B区多出1条酶带,HT6-212-1、HT6-212-4较对照分别在A、B区域各多出1条酶带,但二者在B区多出的条带位置不一致。HT6-212-3与对照相比在A区多出 1 条 带。 HT5-207、HT5-207-1、HT5-207-2-1、HT5-207-2-5较对照均在B区多出两条带,但HT5-207较对照在C区缺失1条带。HT5-207-2-3、HT5-207-3、HT5-207-2-4、较对照在B区多出 1条带,HT4-202较对照在各区均多出1条带。
2.1.2 二年生材料盛花期EST同工酶谱分析 由SP3代二年生育种材料盛花期EST同工酶电泳 (图2)可知,该电泳酶谱总条带数为8条。单粒品系HT8-86较对照在B区缺失1条酶带;四倍体品系HT2-425-1、HT2-425-2较对照无条带差异性;二倍体品系中:HT6-212-4、HT6-212-1较对照条带无差异性,而HT6-212-3、HT6-212-2较对照分别在C区多出1条酶带,在B区少了1条酶带。HT4-202较对照在B区多出 1 条酶带。HT5-207、HT5-207-2-1、HT5-207-1、HT5-207-2-4较对照分别在B区多出1条酶带,HT5-207-2-2、HT5-207-2-3较对照无差异性,HT5-207-3较对照在C区缺失1条带,HT5-207-2-5较对照在B、C区各缺失1条酶带。
2.2 甜菜航天诱变SP3代二年生材料抽薹期同工酶谱分析
2.2.1 二年生材料抽薹期POD同工酶谱分析 表2为SP3代二年生育种材料各品系与抽薹期POD、EST电泳图谱中序号对应表格,图3为二年生材料抽薹期POD同工酶谱。由该图谱分析可知,该电泳图谱总条带数为8条。单粒种材料HT8-86较对照在B区多出1条酶带;多倍体材料HT2-425-1、HT2-425-2较对照分别在B、C区缺失了1条带,且各个条带区域颜色均要浅于对照;二倍体品系材料中:HT6-212-1与HT6-212-2带型一致,较对照分别在B、C区多出1条带。HT6-212-4较对照均在B区多出1条酶带,且各区酶带的颜色均要深于对照。而HT6-212-3同对照相比在B区缺失1条带,而在C区多出1条带。HT5-207-1、HT5-207-2-4、HT5-207-2-5、HT5-207-2-3、HT5-207-2-2较对照分别在B、C区多出1条带。HT5-207-2-1较对照在B区缺失了1条带,而在C区多出1条酶带,HT5-207较对照在B区缺失了1条酶带。HT5-207-3较对照无条带差异性。HT4-202-3较对照无条带差异性。HT4-202较对照分别在B、C缺失1条带。
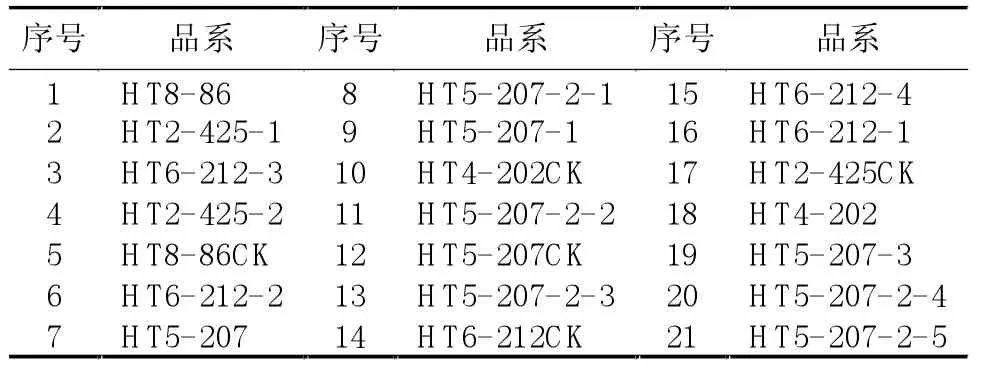
表1 盛花期POD、EST电泳图谱中各品系对应序号

图1 SP3代二年生育种材料盛花期POD同工酶图谱(上端为正极,下端为负极)

图2 SP3代二年生育种材料盛花期EST同工酶图谱(上端为正极,下端为负极)
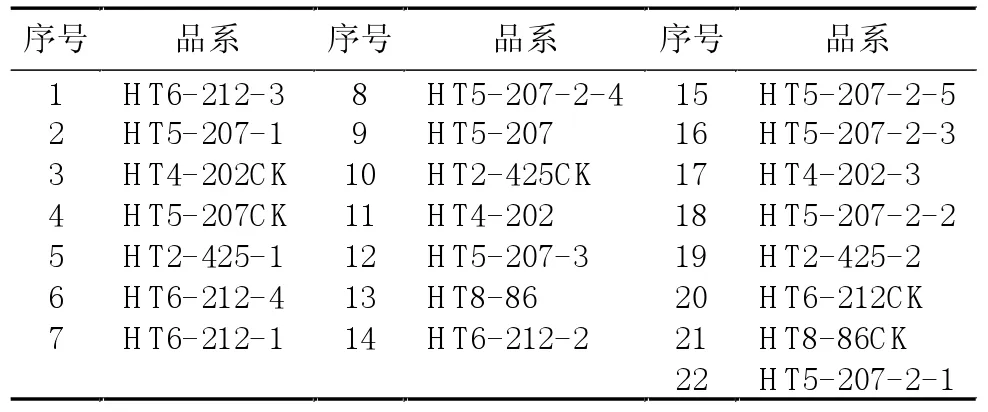
表2 抽薹期POD、EST电泳图谱中各品系对应序号
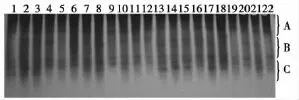
图3 SP3代二年生育种材料抽薹期POD同工酶图谱(上端为正极,下端为负极)
2.2.2 二年生材料抽薹期EST同工酶谱分析 由SP3代二年生材料抽薹期EST同工酶图谱 (图4)分析可知,该电泳图谱总条带数为9条。单粒种材料HT8-86较对照在B区缺失1条酶带;四倍体材料HT2-425-1、HT2-425-2较对照带间无差异性;二倍体材料中HT6-212-3、HT6-212-4较对照条带间无差异性,HT6-212-2较对照在B区缺失了1条带,HT6-212-1较对照分别在B、C区多出1条酶带。HT4-202较对照在B区多出两条酶带,HT4-202-3较对照在B区多出1条酶带,HT5-207-1、HT5-207-2-4、HT5-207-2-1、HT5-207、HT5-207-2-2较对照在B区多出1条酶带,但HT5-207-1、HT5-207-2-2、HT5-207-2-1与HT5-207-2-4、HT5-207在B区多出的条带位置不同,其中HT5-207较对照在A区缺失了1条带。HT5-207-3较对照在C区缺失1条带。HT5-207-2-5、HT5-207-2-3较对照条带间无差异性。

图4 SP3代二年生育种材料抽薹期EST同工酶图谱(上端为正极,下端为负极)
3 讨论与结论
同工酶在一定程度上能反映蛋白质水平上的信息,植物体内不同酶的同工酶谱随着细胞分化、组织器官及植株的生长、成熟发生规律性的变化,这种变化在一定程度上反映了植物在发育过程中基因表达的时空顺序性,因而同工酶的酶谱特征可以作为植物生长发育和遗传转化的一种生理生化指标。该试验以SP3代衍生育种材料及其对照为试验材料,对不同倍性材料各品系进行了同工酶酶谱的差异性研究分析,结果表明:(1)甜菜航天诱变SP3代二年生材料在盛花期、抽薹期的EST、POD同工酶谱分析中,各个品系材料间表现出一定的差异性,航天诱变材料较对照条带数基本呈增多趋势,且酶活性高于对照;(2)两个时期的同工酶谱图相比较分析表明,EST、POD同工酶谱在这两个时期总条带数基本没有太大变化;(3)航天诱变后不同倍性材料之间,二倍体材料变异率明显高于四倍体材料、单粒种材料。导致出现以上结果的原因可能是太空辐射诱变是一个很复杂的过程,射线的能量沉积在物质上,引起物质的原子和分子的激发与电离,电离过程可以形成自由基,自由基与DNA相互作用可以引起DNA多种类型的损伤,包括碱基变化、脱落、氢键的断裂、单双键的断裂、DNA及蛋白质分子内和分子之间的交联[12-13],从而导致航天诱变后材料在同工酶水平发生变化。航天过程的条件极为复杂,能够使植物遗传性发生变异常常是以微重力和强辐射为主要因素的多因素的综合效应。该试验研究结果表明诱变后SP3代衍生材料较对照在生理生化水平上表现出一定的差异性,说明在空间复杂的环境条件下,不同个体变异是多样的。但该变异在甜菜育种工作的具体应用有待于进一步研究确定。
[1]刘华君,王燕飞,于伯成,等.甜菜种子卫星搭载诱变效应分析[J].新疆农业科学,2000(5):203-204.
[2]王华忠,吴则东,韩英,等.甜菜航天育种材料的叶绿素含量及某些形态特征研究初报[J].中国农业科学,2008,41(4):1134-1141.
[3]刘乃新,吴则东,王华忠.航天诱变对甜菜生殖生长期几种激素含量的影响[J].中国糖料,2010(2):20-22.
[4]Markert C L,Miller F.Multiple forms of enzymes:tissue,ontogenetic,and species specific patterns[J].Proc.Nat.Acad.Sci.,1959,45:753-763.
[5]赖德CC,泰勒CB//范培昌译.同工酶[M].北京:科学技术出版社,1987.
[6]雷泞菲,苏智先,陈劲松.同工酶技术在植物研究中的应用[J].四川师范学院学报//自然科学版,2000,21(4):321-324.
[7]程家胜.同工酶分析在果树种质资源分类遗传研究中的应用[J].中国果树,1986(3):19-22.
[8]Tacchini P,Fink A,Xue G.Xing,GasparT.Analysis of proteins of a fully habituated nonorganogenic sugarbeet callus and a hormone-dependent one by high-performance 2-D gel electrophoresis[J].Plant Physiol Biochem.,1995,33:361-366.
[9]Sandra Aparecida de Oliveira Collet,Marcos Andre'Collet,Maria de Fa'timaP.S.Machado.Differential gene expression for isozymes in somatic mutants of Vitis vinifera L.(Vitaceae)[J].Biochemical Systematics and Ecology,2005,33:691-703.
[10]Rasol Marijana Krsnik,Cipcic Hana,Hagege Daniel.Isoesterases related to cell differentiation in plant tissue culture[J].Chemico-Biological Interactions,1999,119/120:587-592.
[11]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000:77.
[12]钟波,朱列书,贺鹏,等.浅谈航天诱变育种[J].作物研究,2007,21(5):511-516.
[13]王乃彦.开展航天育种的科学研究工作,为我国农业科学技术的发展做贡献[J].核农学报,2002,16(5):257-260.

