莲子心总黄酮的微波辅助提取研究
余其凤,周文富
(三明学院化学与生物工程系,福建 三明 365004)
莲子心为睡莲科多年生水生草本植物莲(NelumbonuciferaGaertn)的成熟种子莲子的青嫩胚芽,古名薏,味苦,性寒[1,2]。我国有着丰富的莲子心资源,质优价廉。现代药理分析证明,莲子心具有清心安神、交通心肾、抗心律失常、保护心肌、降血压、止血抗炎、止咳化痰、治疗目赤肿痛等功效[1~6],其主要成分为莲心碱、异莲心碱、甲基莲心碱、荷叶碱等多种生物碱和木犀草甙、金丝桃甙、芦丁等黄酮类化合物[1~12]。
黄酮类化合物的传统提取方法有冷浸法、渗漉法、煎煮法、回流提取法、碱性水或碱性稀醇提取法等。近年来,微波技术发展很快,不仅可缩短萃取时间、提高萃取效率,还可降低萃取温度,最大限度地保证萃取目标产物的生物活性和质量[11~28]。
作者在此采用单因素实验和正交实验优化了莲子心总黄酮的微波辅助提取工艺,拟为莲子心的综合开发利用提供依据[7,8,17]。
1 实验
1.1 原料、试剂与仪器
莲子心,产自福建建宁地区。
芦丁标准品,中国药品生物制品检定所;95%乙醇;亚硝酸钠固体;硝酸铝固体;氢氧化钠固体;石油醚。所用试剂均为分析纯。
LWMC-205型可调功率微波化学反应器,南京陵江科技开发有限责任公司;FA1604N型电子天平、722型可见分光光度计,上海精密科学仪器有限公司;SHB-3型循环水式多用真空泵,郑州杜甫仪器厂;DHG-9070A型电热恒温鼓风干燥箱,上海基玮试验仪器设备有限公司;2K-82B型真空干燥箱,上海实验仪器总厂;800型离心沉淀机(最大转速4000 r·min-1),上海手术器械五厂;H.H.S型电热恒温水浴锅,上海医疗器械五厂;RE-52D型旋转蒸发仪,上海博经经贸公司;UV-2550型紫外可见分光光度计,厦门精艺兴业科技有限公司;360型FTIR红外光谱仪,美国Nicolet公司。
1.2 微波提取莲子心总黄酮方法及供试品溶液的制备
准确称取1 g莲子心粉末(过60目筛)于锥形瓶中,按要求加入一定量不同质量浓度的乙醇,摇匀,将瓶口用保鲜膜封住,40℃水浴浸泡30 min后,在一定功率下微波提取一定时间,减压抽滤,滤液定容至50 mL,摇匀,即得供试品溶液。
单因素实验:乙醇质量浓度为65%、固液比为1∶25(g∶mL)、微波辐射功率为320 W、微波辐射时间为30 s、微波提取次数为3次,固定其它条件不变,依次考察上述各个因素对莲子心总黄酮提取率的影响。
正交实验:在单因素实验的基础上,选择乙醇质量浓度、固液比、微波辐射时间和微波辐射功率作为考察因素,以提取率为考核指标,进行L9(34)正交实验,以进一步优化微波辅助提取莲子心总黄酮的工艺条件。正交实验的因素与水平见表1。
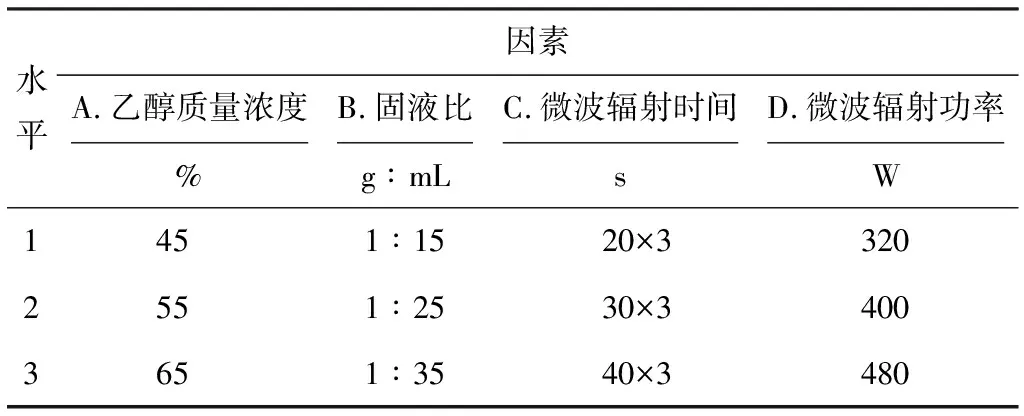
表1 微波辅助提取正交实验的因素与水平
1.3 分析与检测
以芦丁为基准物,采用硝酸铝-亚硝酸钠为显色剂,根据黄酮化合物母核中含有碱性氧原子,能与游离的铝离子生成黄色络合物,在亚硝酸钠的碱性溶液中呈红橙色的特性进行比色测定,方法简便、准确、灵敏度高。
1.3.1 标准溶液的制备
精密称取真空干燥至恒重的芦丁标准品10.2 mg,加入适量的65%乙醇在超声波清洗器上超声10 min使之溶解完全后定容于100 mL容量瓶中,摇匀,得0.102 mg·mL-1的芦丁标准溶液,置于冰箱贮存,备用。
1.3.2 最大吸收波长的确定
对芦丁标准溶液和供试品溶液显色后(以不加标准溶液和供试品溶液的试液为参比溶液),用紫外可见分光光度计在200~600 nm波长范围进行扫描。结果表明,芦丁标准溶液和供试品溶液均在500 nm 处有最大吸收峰,因此选择500 nm 为测定波长。
1.3.3 标准曲线的绘制
精密量取芦丁标准溶液0.0 mL、0.5 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL分别置于10 mL容量瓶中,各加65%乙醇至5 mL;分别加入5%亚硝酸钠溶液0.3 mL,摇匀,放置6 min;再分别加入10%硝酸铝溶液0.3 mL,摇匀,放置6 min;然后分别加入4%氢氧化钠溶液4.0 mL,并分别用65%乙醇稀释至刻度,摇匀,静置15 min,在500 nm处测定吸光度。
以芦丁含量为横坐标、吸光度为纵坐标绘制标准曲线(见图1),并进行线性拟合,得到线性回归方程为:A=-2.6280×10-4+ 0.01346c,R=0.9999。

图1 芦丁标准溶液标准曲线
1.3.4 莲子心总黄酮提取率的测定
精密吸取供试品溶液1 mL,置于10 mL容量瓶,按1.3.3方法测定吸光度。由于75%、85%的乙醇提取液中有一定量的色素存在,测吸光度时应先除色素,否则会影响吸光度的测定。根据回归方程,按下式计算莲子心总黄酮提取率。
2 结果与讨论
2.1 单因素实验结果与分析
2.1.1 乙醇质量浓度对莲子心总黄酮提取率的影响(图2)
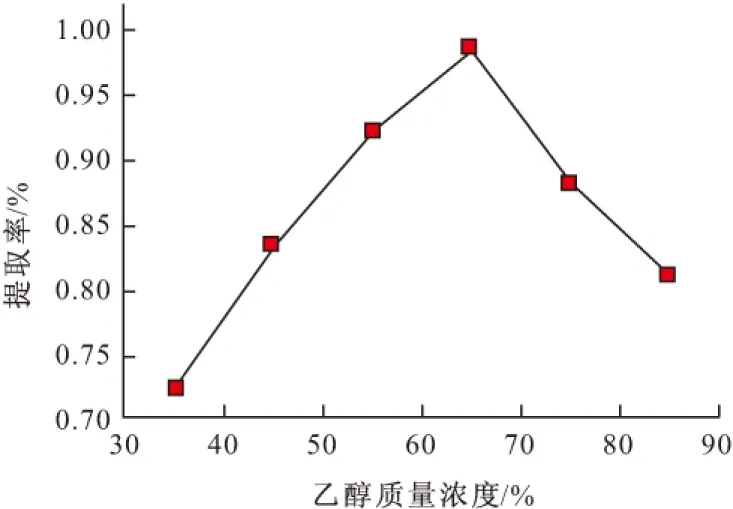
图2 乙醇质量浓度对莲子心总黄酮提取率的影响
由图2可知,随着乙醇质量浓度的增大,莲子心总黄酮提取率不断升高;当乙醇质量浓度增大到65%时,提取率达到最高;继续增大乙醇质量浓度,提取率反而降低。其原因可能与黄酮类化合物的极性有关,不同质量浓度的乙醇极性不同,莲子心总黄酮的极性可能和65%乙醇的极性相当,根据相似相溶原理,乙醇质量浓度为65%时总黄酮的提取率最高;当乙醇质量浓度大于65%时,提取液中会带入色素和其它脂溶性成分,这些杂质与黄酮类化合物竞争与乙醇-水分子溶液体系结合,导致总黄酮提取率下降。
2.1.2 微波辐射功率对莲子心总黄酮提取率的影响(图3)
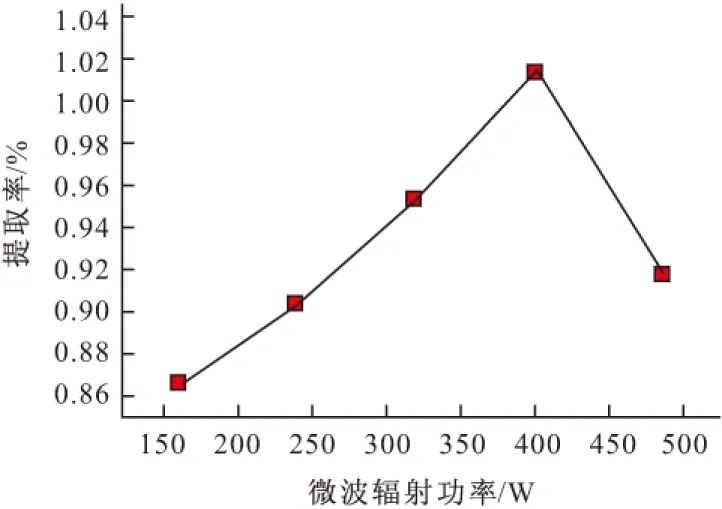
图3 微波辐射功率对莲子心总黄酮提取率的影响
由图3可知,当微波辐射功率小于400 W时,莲子心总黄酮提取率随微波辐射功率的增大而升高。这可能是因为当微波辐射功率较低时,微波辐射对细胞膜的破坏作用较小,分子运动也不剧烈,故总黄酮提取率不高;随着微波辐射功率不断增大,分子运动加剧,细胞膜破碎程度加大,另外,微波的选择性加热性能也起到了一定的作用,总黄酮提取率逐渐升高;但微波辐射功率太大时,细胞膜并不会无限制破碎,而微波对细胞内物质的选择性加热性能差异则减小,一些易溶于水的物质先被溶出,从而造成总黄酮提取率降低;此外大功率所产生的强热效应也可能使一些黄酮类化合物的结构遭到破坏,导致总黄酮提取率降低。
2.1.3 固液比对莲子心总黄酮提取率的影响(图4)
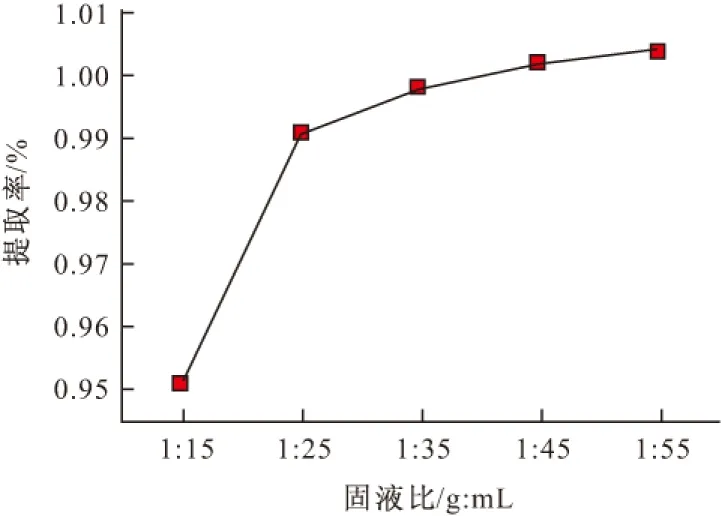
图4 固液比对莲子心总黄酮提取率的影响
由图4可知,随着溶剂量的增大,莲子心总黄酮提取率逐渐升高;固液比达到1∶25后,总黄酮提取率增加缓慢,逐渐趋于稳定。这是因为,溶剂量较小时,莲子心总黄酮尚未完全溶出而体系已达到饱和,因此总黄酮提取率比较低;随着溶剂量的增大,莲子心总黄酮不断溶出,直至达到饱和,因此总黄酮提取率也逐渐升高;但溶剂用量过大会造成浪费,并给提取液蒸发浓缩带来不便。因此,溶剂用量不宜过大。
2.1.4 微波辐射时间对莲子心总黄酮提取率的影响(图5)

图5 微波辐射时间对莲子心总黄酮提取率的影响
由图5可知,随着微波辐射时间的延长,莲子心总黄酮提取率不断升高;但每次辐射时间超过30 s后提取率开始下降。这是因为,微波辐射时间过短,黄酮类物质还未充分溶出;随着微波辐射时间的延长,总黄酮溶出量逐渐增大,提取率逐渐升高;继续延长微波辐射时间,未溶出的黄酮类物质量很少,其它杂质可能增多,导致提取率下降。
2.1.5 提取次数对莲子心总黄酮提取率的影响(图6)

图6 提取次数对莲子心总黄酮提取率的影响
由图6可知,提取次数对莲子心总黄酮的提取率影响不大。从经济效益考虑,提取1次即可。
2.2 正交实验结果与分析[15](表2)
由表2可看出,各因素对莲子心总黄酮提取率的影响大小依次为:乙醇质量浓度>微波辐射时间>微波辐射功率>固液比;较优工艺参数组合为A3B3C2D2,即乙醇质量浓度65%、固液比1∶35(g∶mL)、微波辐射功率400 W、微波辐射时间30 s×3。
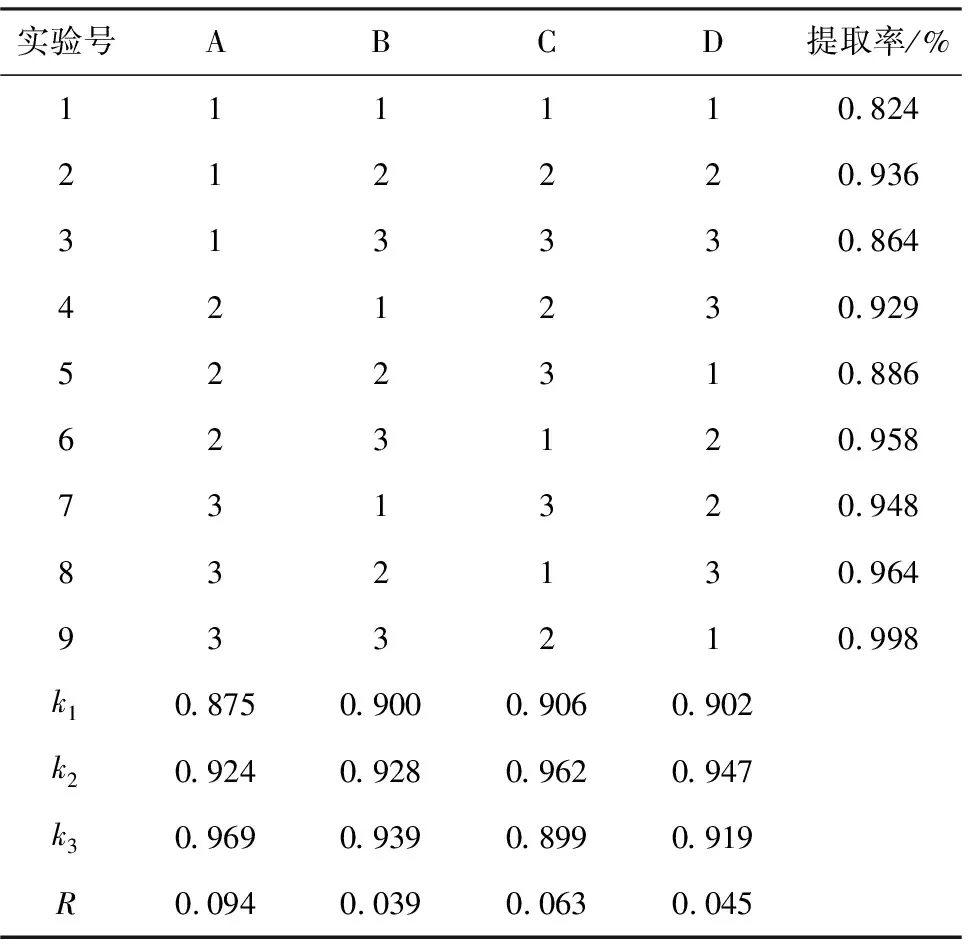
表2 微波辅助提取正交实验的结果与分析
根据单因素实验和正交实验结果,综合考虑提取效率及成本等,确定最优工艺条件为:乙醇质量浓度65%、固液比1∶25、微波辐射功率400 W、微波辐射时间30 s×3。在上述条件下进行8次验证实验,莲子心总黄酮的平均提取率为1.021%。
此外,用石油醚萃取莲子心提取液时,石油醚层仍呈无色透明状态,表明65%乙醇所提取的提取液中无脂溶性色素存在。
2.3 同产地不同批号(日期)莲子心总黄酮含量的比较
准确称取3种不同批号的莲子心粉末1 g分别置于锥形瓶中,在最佳工艺条件下微波提取,测定总黄酮含量,结果见表3。
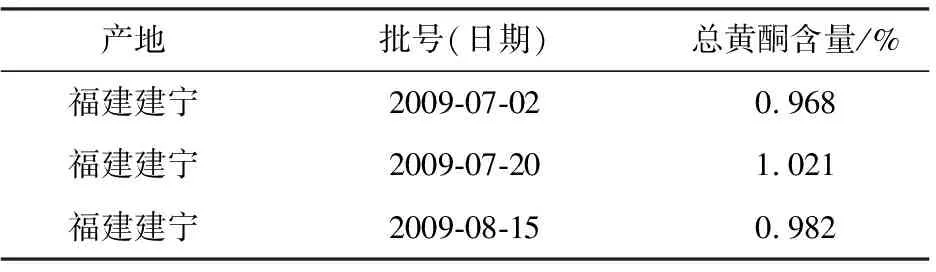
表3 同产地不同批号莲子心的总黄酮含量
由表3可看出,3种同产地不同批号莲子心的总黄酮含量略有差异,具体原因有待进一步探讨。
2.4 不同提取方法提取效果的比较
对微波辅助提取法与乙醇浸提法、水浸提法的工艺条件及提取率进行对比,结果见表4。
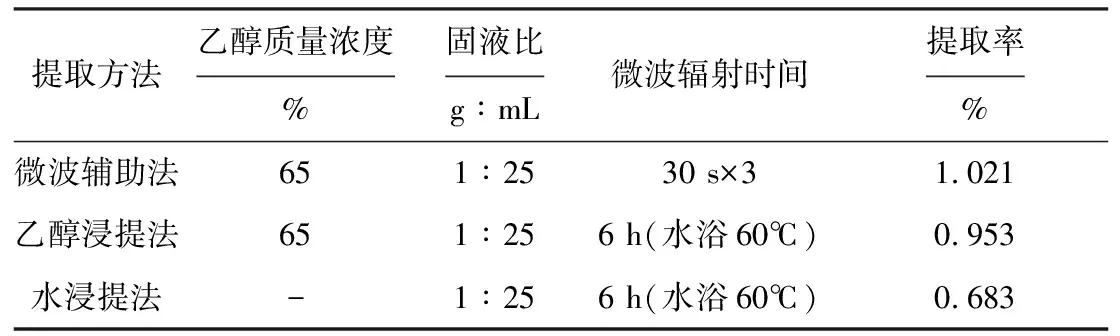
表4 3种提取方法提取效果的比较
由表4可看出,与传统乙醇浸提法和水浸提法相比,微波辅助法提取莲子心总黄酮的提取率高、耗时短[9]。
2.5 结构表征
2.5.1 紫外光谱分析[24~27](图7)
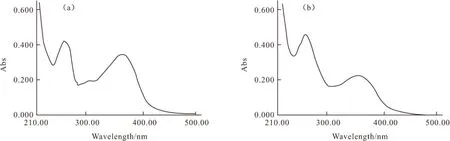
图7 芦丁标准品(a)与莲子心提取物(b)的紫外吸收光谱
由图7可知,芦丁标准品在240~280 nm和300~400 nm两波带各有一个吸收峰,莲子心提取物在这两个谱峰带也有吸收且吸收带的位置、强度和形状与芦丁标准品非常相似,表明莲子心提取物的骨架和官能团结构与芦丁相似。
2.5.2 红外光谱分析[19~28](图8)

图8 芦丁标准品(a)和莲子心提取物(b)的红外光谱
由图8可知,芦丁标准品与莲子心提取物的红外光谱图的特征吸收峰一致:3400 cm-1为-OH的伸缩振动吸收峰,峰形宽大,吸收峰极强,证明有酚羟基或糖上的羟基存在;1600~1500 cm-1范围有若干吸收峰,为苯环C-C骨架伸缩振动吸收峰,说明有苯环存在;2930 cm-1为C-H的伸缩振动吸收峰,吸收峰的强度较小,说明饱和碳上的氢较少;1660 cm-1左右有较强的吸收峰,为C=O的伸缩振动吸收峰;1050 cm-1左右为C-O的伸缩振动吸收峰,峰较强。这些表明莲子心提取物含有与芦丁相似的成分,属于黄酮类化合物。
3 结论
(1)通过单因素实验和正交实验确定微波辅助提取莲子心总黄酮的最优工艺条件为:乙醇质量浓度65%、固液比1∶25(g∶mL)、微波辐射功率400 W、微波辐射时间30 s×3,此时莲子心总黄酮提取率达到1.021%。
(2)同产地不同批号莲子心总黄酮的含量不同。
(3)微波辅助提取法与传统乙醇浸提法、水浸提法相比,耗时短、提取率高,具有较好的发展前景和应用潜力。
[1] 黄先菊,罗顺德,杨健.莲子心有效成分及其药理作用研究进展[J].湖北省卫生职工医学院学报,2002,15(2):50-52.
[2] 刘大群,冯启利.莲子心中保健成分的研究概况[J].江西食品工业,2005,(1):20-23.
[3] 靳素荣,姚礼峰,李辉,等.微波法提取荷叶黄酮及抗氧化作用研究[J].安徽农学通报,2006,12(18):44-45,140.
[4] 延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[5] 黄阿根,施洪飞,韦红,等.荷叶黄酮和生物碱的提纯及调节血脂作用比较[J].扬州大学烹饪学报,2006,23(3):23-25.
[6] 蔡为荣.微波提取荷叶黄酮及其清除羟基自由基的研究[J].食品科学,2004,25(9):91-94.
[7] 夏稼红,陶冉,范乃兵,等.紫外分光光度法测定莲子心总黄酮的含量[J].南京中医药大学学报(自然科学版),2008,24(2):50-52.
[8] 邓胜国,邓泽元,范亚苇.紫外分光光度法测定荷叶总黄酮含量[J].南昌大学学报(理科版),2008,32(2):50-52.
[9] 张岩,曹国杰,张燕,等.黄酮类化合物的提取以及检测方法的研究进展[J].食品研究与开发,2008,29(1):154-158.
[10] 杨明,刘晓辉,黄剑波.微波提取莲不同部位黄酮含量的探讨[J].安徽农业科学,2008,36(7):63-66.
[11] 欧阳明.微波协同萃取及纯化荷叶黄酮的初步研究[J].现代食品科技,2006,22(2):118-120.
[12] 张纪宁,欧阳艳.黄酮类化合物的提取工艺研究进展[J].伊犁师范学院学报(自然科学版),2008,(2):27-30.
[13] 李彩侠,张赟彬,吴亚卿.荷叶中黄酮类化合物的提取工艺研究[J].上海理工大学学报,2006,28(1):9-12.
[14] 袁小红.莲子心4种提取方法的比较研究[J].中国药房,2006,17(8):78-79.
[15] 雷鹏,刘韶,李新中,等.正交实验优选莲子心提取工艺[J].中国医学工程,2005,13(3):255-256,267.
[16] 杨明,刘晓辉,黄剑波.乙醇与微波技术提取荷叶黄酮类物质的工艺研究[J].保鲜与加工,2008,8(3):36-38.
[17] 张丽珍,周之荣.聚酰胺柱层析-分光光度法测定莲子心药材中的总黄酮含量[J].中国卫生检验杂志,2009,19(6):1299-1300,1303.
[18] Iwashina T. The structure and distribution of the flavonoids in plants[J]. J Plant Res,2000,113(3):287-299.
[19] Martens S,Mithöfer A. Flavones and flavone synthases[J]. Phytochemistry,2005,66(20):2399-2407.
[20] Peres V,Nagem T J,Oliveira F F.Tetraoxygenated naturally occurring xanthones[J].Phytochemistry,2000,55(7):683-710.
[21] Na Zhi,Xiang Wei,LI Chao-Ming,et al. Flavonoids fromIsodonenanderianus[J].云南植物研究,2002,24(1):121-124.
[22] She Bai-rong,Qin Da-nian,She Yun-chu. Method for extracting and purifying total flavones fromHerbaepimedii[J].中国现代医学杂志,2004,14(16):27-29,34.
[23] Shen Tong,Jin Zhong-jian,Zheng Shang-zhen. Studies on the flavonoid inPolygonumperiginatorisPauls[J].天然产物研究与开发,2005,17(1):4-6.
[24] Zheng Min-yan,Wei Yong-sheng. Studies on the content of flavonoids inJasminumnudiflorumLindl.[J].天然产物研究与开发,2003,15(6):494-497.
[25] Zhang Hai-de,Zhang Shui-hua,Xiao Kai- jun,et al.Structure identification and antioxidative activity study on flavonoids in soy sauce[J].华南理工大学学报(自然科学版),2001,29(9):86-89.
[26] Labuda J,Buckova M,Heilerova L,et al. Evaluation of the redox properties and anti/pro-oxidant effects of selected flavonoids by means of a DNA-based electrochemical biosensor[J].Anal Bioanal Chem,2003,376(2):168-173.
[27] Jeong Mi Kim,Hye Sook Yun-Choi. Anti-platelet effects of flavonoids and flavonoid-glycosides fromSophorajaponica[J]. Arch Pharm Res,2008,31(7):886-890.
[28] Choi Y J,Kim H M,Kim H D. Synthesis and cytotoxic activities of C-benzylated flavonoids[J].Arch Pharm Res,2009,32(1):59-63.

