六甲基二硅胺烷作为锂离子电池电解液稳定剂的研究
胡立新,王 超,陈晓琴,程 乾
(湖北工业大学化学与环境工程学院,湖北 武汉 430068)
锂离子电池作为新能源具有比能量高、工作电压高、应用范围宽、自放电率低、循环寿命长、无污染、安全性能好等独特的优势,现已在多个领域中逐步取代传统的电池,应用广泛。因此,锂离子电池在现代电化学中备受关注[1~4]。
非水电解液是锂离子二次电池的重要组成部分,在电池中承担着正负极之间传输电荷的作用,对电池的比容量、工作温度范围、循环效率及安全性能等至关重要[5]。在锂离子电池电解液的生产、储存过程中,由于以下许多原因,会导致电解液中水分、游离酸偏高,影响电池的性能[6]:(1)干燥环境劣化;(2)储存设备密封性能差;(3)使用溶剂水分偏高;(4)锂盐水分和游离酸偏高;(5)其它原因。非水电解液对游离酸、水分含量的要求较高,由于锂离子电池的电压高达3~4 V,而水的分解电压仅为1.23 V[7],若电解液中含有较多水分,在高电压充放电下分解,会造成电池性能劣化;而电解液中游离酸过高,也会影响电池性能,如氢氟酸会与锂离子形成LiF,导致充放电过程中负极界面形成阻隔,电池内阻增大,影响到负极材料锂离子的正常嵌入和脱嵌。Xu[8]报道,LiPF6溶于电解液后会发生如下反应:
(1)
未电离的LiPF6不稳定,继续分解产生LiF和PF5,PF5与电解液中的H2O发生反应:
LiPF6→LiF+PF5
(2)
PF5+H2O→POF3+2HF
(3)
研究表明,用六甲基二硅胺烷(HMDS)吸收电解液中微量的水,能有效抑制LiPF6的分解[9]。
作者在锂离子电池电解液中添加HMDS作为稳定剂,考察了HMDS对电解液物理指标及电池电化学性能的影响。
1 实验
1.1 电解液的配制
电解液在充满高纯氩气的手套箱中进行配制,其有机溶剂、锂盐均为电池级,HMDS含量>99.9%,所有材料均由东莞市杉杉电池材料有限公司提供。电解液配方如下:
电解液1:1.0 mol·L-1LiPF6/EC+DEC(1∶2,质量比);
电解液2:1.0 mol·L-1LiPF6/EC+DEC(1∶2,质量比)+0.5%HMDS。
1.2 电极的制备
正极的制备:将定量的聚偏二氟乙烯(PVDF)溶解在定量的N-甲基吡咯烷酮(NMP)溶剂中,制得粘合剂溶液,将事先混合均匀的LiCoO2和乙炔黑粉末加入到粘合剂溶液中,置于超声波振荡仪中振荡10 min,固定于磁力搅拌器充分搅拌混合均匀,制得正极浆料。用拉浆机将该正极浆料均匀涂敷到厚度25 μm的铝箔两面,经过150℃真空加热干燥1 h,辊压,裁片制得正极极片。正极材料组成比例为LiCoO2∶乙炔黑∶PVDF=90∶5∶5(质量比)。
负极的制备:将定量的人造石墨、碳纤维和丁苯橡胶(SBR)混合,添加1500 mL去离子水充分搅拌混合均匀,配成负极浆料。用拉浆机均匀涂敷到18 μm的铜箔两面,经过125℃真空加热干燥1 h,辊压、裁片制得负极极片。负极材料组成比例为人造石墨∶碳纤维∶SBR=95∶2 ∶3(质量比)。
1.3 电池的组装
将正极、复合隔膜、负极焊接上极耳后依次叠加,卷绕成一个方型锂离子的电极组,并将该电极组纳入5.5 mm×34 mm×36 mm的方型电池铝壳中。操作在高纯氩气环境的手套箱中进行。
1.4 测试方法
1.4.1 电解液物理指标检测
水分含量的测定:用Metrohm KF-831型(瑞士万通)库仑水分测试仪对电解液进行水分含量的测定。
游离酸含量的测定:用Metrohm 877型(瑞士万通)电位滴定仪对电解液进行游离酸含量(以HF计)的测定。
1.4.2 电化学性能检测
用两种电解液分别制作15只553436的铝壳电池,用BTS-5V3A型电池测试柜(深圳市新威尔电子有限公司)对电池进行预充、化成、分容的测试,记录首次效率、容量和循环、平台的变化;用电池测试柜(广州擎天)对电池进行充放电性能测试。
高温储存测试(85℃/4 h)操作程序:室温下,以1C恒流充电至4.2 V,再在4.2 V恒压充电到I≤0.02C时停止,静置5 min;然后以1C恒流放电到3.0 V,静置5 min;再次以1C恒流充电至4.2 V,再在4.2 V恒压充电到I≤0.02C时停止,测试此时电池的电压、内阻及厚度;放入高低温箱(重庆汉巴)中,调节温度至85℃,待温度稳定后计时,将电池在85℃条件下储存4 h后取出迅速测试电池厚度(热测),将电池室温下冷却2 h后测试厚度、电压及内阻。用电池测试柜测试储存过的电池的剩余容量及可恢复容量,操作程序为:室温下以1C恒流放电到3.0 V,记录此时的剩余容量,静置5 min;以1C恒流充电至4.2 V,再在4.2 V恒压充电到I≤0.02C时停止,静置5 min;再以1C恒流放电到3.0 V,记录电池的可恢复容量,静置5 min,结束测试。
室温循环测试操作程序:室温下,以1C恒流充电至4.2 V,再在4.2 V恒压充电到I≤0.02C时停止,静置5 min,然后以1C恒流放电到3.0 V,静置5 min,根据要求设置循环次数N,从第1次循环开始;以1C恒流充电至3.8 V,静置5 min,结束循环测试。
实验中,电压上限为4.25 V、下限为2.95 V,电池标称容量为700 mAh。
2 结果与讨论
2.1 电解液的稳定性
将两种不同电解液储存在60℃烘箱中,24 h后检测H2O和HF的含量,结果见表1。
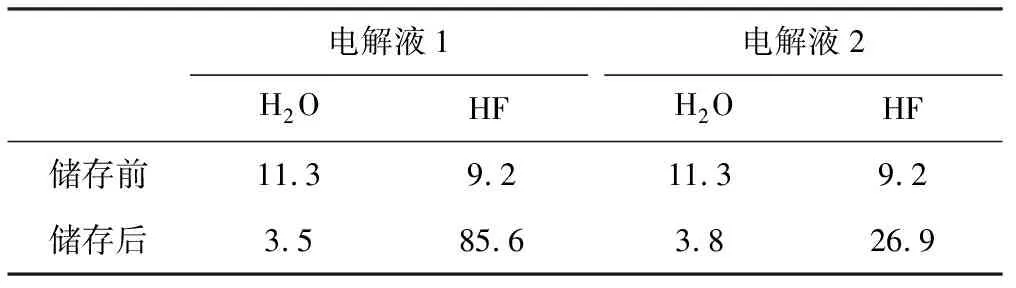
表1 不同电解液中H2O和HF含量的测定结果/×10-6
从表1可以看出,经过60℃/24 h高温储存后,电解液2的稳定性明显好于电解液1,表明在电解液中加入HMDS提高了电解液的高温储存能力。这是因为,未添加HMDS的电解液中,LiPF6与H2O反应完全,使得HF的含量大大增加;而添加0.5%HMDS的电解液中,HMDS类物质的结构中含有Si-N键,既可以和H2O发生反应,又可以和HF发生反应[见式(4)、(5)],生成的NH3又能与HF继续反应[10],从而抑制了LiPF6与H2O的反应,使电解液中HF的含量减少,电解液的稳定性得以提高。
(4)
(5)
2.2 高温储存测试(85℃/4 h)
不同电解液制作的电池在85℃高温环境下储存4 h后进行性能测试,结果见表2。
从表2可以看出,以HMDS作为锂离子电池电解液的稳定剂,经高温储存后电池各项性能明显好于不含HMDS的电解液制作的电池。从电解液方面来看,电池性能的恶化主要有以下两个因素[11]:(1)水和游离酸等杂质的影响;(2)电解液中有机溶剂的不可逆氧化反应的影响。尽管水和游离酸等杂质在电解液使用之前经过严格的控制,但是在电池的充放电过程中还是会产生,尤其是在电池偶尔过充的情况下。可能的机理是[12~14]:

表2 不同电解液制作的电池在85℃下储存4 h后的性能/%
LiPF6→LiF+PF5
(6)
LiPF6+H2O→LiF+POF3+2HF
(7)
除此之外,还存在10-6级与制备相关的酸含量,例如:LiPF6中HF的含量至少有50×10-6;反应所形成的酸进一步与电化学电池中的组分发生反应,并且能够腐蚀电化学电极表层。加入HMDS后,通过与PF5间的弱结合而降低PF5的反应活性,就能起到稳定六氟磷酸锂基电解液的作用。
从负极方面来看,就石墨而言,HF会与其表面上电解质膜(SEI膜)中的主要成分Li2CO3、LiOH、Li2O等发生反应,生成LiF并在负极表面发生沉积,原始膜因而被含有LiF的膜置换,而与原始膜相比,后者能减少或阻止Li+通过,结果导致电池内阻增大,并因此降低电池性能。
2.3 循环性能测试
以两种电解液分别制作15只553436的铝壳电池,在室温下进行循环测试,结果见图1。

图1 不同电解液制作的电池的循环性能
从图1可以看出,电池循环100次之后,以电解液1、电解液2制作的电池的容量保持率分别为90.3%和93.1%,说明加入HMDS可抑制LiPF6的水解,提高电解液的稳定性,改善电池的循环性能。这可能是因为,HMDS的加入抑制了LiPF6与H2O、游离酸等发生反应,提高了电解液的稳定性[15],电池在长循环后仍然维持较高的充放电容量。
3 结论
在电解液中加入微量(0.5%)的六甲基二硅胺烷(HMDS),可以抑制电解液在储存过程中LiPF6的水解及热解,减少电解液中H2O和HF的含量,明显提高锂离子电解液的储存稳定性及热稳定性,同时可以改善锂离子电池的电化学性能和循环性能。
(致谢:感谢东莞市杉杉电池材料有限公司总工程师陈柏源先生和研发部经理侯涛先生对本实验的指导与帮助。)
[1] 郑洪河.锂离子电池电解质[M].北京:化学工业出版社2006:1-3.
[2] 吴宇平,戴晓兵,马军旗,等.锂离子电池——应用与实践[M].北京:化学工业出版社,2004:373-384.
[3] 吴宇平,万春荣,姜长印.锂离子二次电池[M].北京:化学工业出版社,2002:336-349.
[4] 郭炳焜,徐徽,王先友,等.锂离子电池[M].长沙:中南大学出版社,2002:17-32.
[5] 庄全超,武山,刘文元.锂离子电池电解液杂质的影响及去除技术[J].电池工业,2006,11(1):48-52.
[6] 冯锐,孙新华,赵庆云.锂离子二次电池的精制方法[P].CN 1 339 845A,2001-09-25.
[7] Goodenough J B,Kim Y. Challenges for rechargeable Li batteries[J]. Chem Mater,2010,22(3):587-603.
[8] Xu Kang. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chem Rev,2004,104(10):4303-4417.
[9] 李永坤,张若昕,刘建生.六甲基二硅氮烷对LiMn2O4电极性能的影响[J].电池,2009,39(2):83-84.
[10] Kensuke Takechi,Shiga T. Non-aqueous electrolyte solutions and non-aqueous electrolyte cells comprising the same[P]. USP 6 235 431 B1,2001-05-22.
[11] Zhang Sheng-shui. A review on electrolyte additives for lithium-ion batteries[J]. Power Sources,2006,162(2):1379-1394.
[12] 琼戈尼兹 M,施密德特 M,库纳 A,等.在电化学电池中用作添加剂的有机胺类[P].CN 1 343 024A,2002-04-03.
[13] Wang E,Ofer D,Bowden W,et al. Cheminform abstract:Stability of lithium ion spinel cells. Part 3. Improved life of charged cell[J]. Electrochem Soc,2001,32(6):4023-4028.
[14] 郭亚菊,杨立,王保峰.LiPF6电解液对水的稳定性研究[J].电源技术,2007,31(2):136-138.
[15] Yamane H, Inoue T, Fujita M, et al. A causal study of the capacity fading of Li1.01Mn1.99O4cathode at 80℃and the suppressing substances of its fading[J]. Power Sources,2001,99(1-2):60-65.

