从 Ksp 角度对“Mg2+、Al3+混和溶液中滴加NaOH溶液”的再思考
顾 晔
(江宁高级中学 江苏 南京 211100)
一、第一种认识
高中阶段在学习金属及其化合物性质时,为强调Al(OH)3的两性,常用以下试题强化教学效果。
例1:向等浓度的MgCl2、AlCl3混合溶液中逐滴加入NaOH溶液,实验现象如何?试作出沉淀的物质的量与NaOH物质的量的关系图。
一般情况下,该问题作如下解答:
第一步:分析反应。
(1)沉淀的生成:Mg2++2OH-=Mg(OH)2↓ Al3++3OH-=Al(OH)3↓;
(2)沉淀的溶解:Al(OH)3+OH-=AlO2-+2H2O。
第二步:描述现象。滴加NaOH溶液后先产生白色沉淀,随着NaOH溶液的不断加入沉淀量有所减少,最终保持不变。
第三步:作图。设混合溶液中MgCl2、AlCl3的物质的量均为 1mol。根据方程式:Mg2+、Al3+沉淀完全需要 NaOH 5mol,Al(OH)3沉淀的溶解需要 NaOH 1mol,沉淀的最大量为2mol,最终沉淀的物质的量为1mol。(图1)
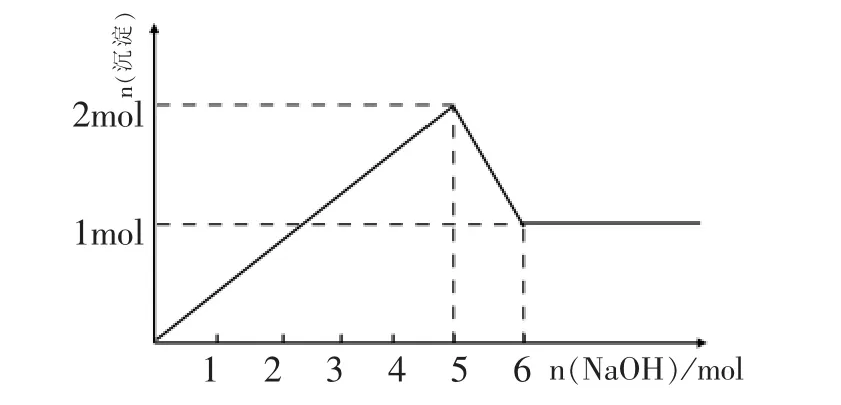
图1
然而,上述分析结果成立的前提是Al(OH)3的溶解必须在Mg2+、Al3+沉淀完全之后,事实上是这样吗?人教版新教材选修4模块《化学反应原理》在“难溶电解质溶解平衡”一节中介绍了难溶物的溶度积常数,我们可以应用氢氧化物的Ksp计算一定浓度Mg2+、Al3+沉淀开始和沉淀完全的 pH。 以 1.0mol/L 的 MgCl2、AlCl3混合溶液为例:查表[1]得 Ksp[Al(OH)3]=1.3×1033,Ksp[Mg(OH)2]=1.8×1011, 易得 Mg2+、Al3+开始沉淀的 pH 分别为 3.28 和9.63,同理可得它们沉淀完全时的pH。计算发现Mg2+、Al3+是分步沉淀的,图1描述的结果是不正确的。例2就是以此为背景的“老题新做”,也是对此类问题的第二种认识。
二、第二种认识
例2:Mg2+和 Al3+的混和溶液中逐滴加入 NaOH溶液,形成沉淀情况出现两种图示,图2为小杨同学绘制,图3是小周根据实验结果绘制,结合下表,下列说法正确的是( )
该马尔可夫过程在第tj(tj=0,T0,2T0, …,nT0)秒时过程元A(tj)(tj=0,T0,2T0,…,nT0)之间存在着依赖关系

氢氧化物沉淀完全溶解A l(O H)3 3.3 5.2 7.8 1 2.8 M g(O H)2 9.4 1 2.4 — —溶液p H开始沉淀 沉淀完全 沉淀开始溶解
A.据图计算得 n(Mg2+): n(Al3+)=2∶1
B.小周实验中,OA段生成两种沉淀
C.图 3 中 OA 段表示仅生成 Al(OH)3沉淀,AB 段仅生成 Mg(OH)2
D.结合表中数据和图3分析,AB段可能发生:Al(OH)3+OH-=AlO2-+2H2O
1.命题意图
该题借助镁、铝氢氧化物开始沉淀和沉淀完全时的pH及Al(OH)3溶解的pH重新绘制沉淀形成的图象,创设了新的情境,考查学生提取、应用图表信息的能力。通过表格中的数据得到Al3+、Mg2+分步沉淀等关键信息,通过图2、图3的比较发现各段曲线的意义。
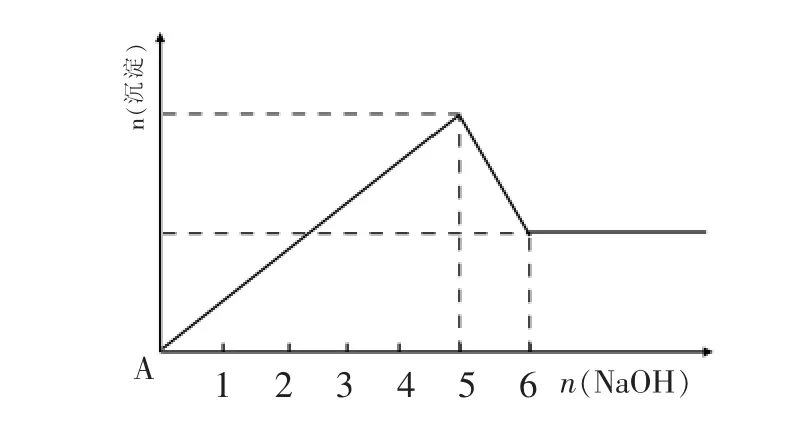
图2
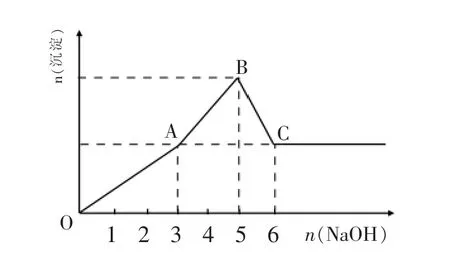
图3
2.解题分析
该题给出的表格提供了以下几个关键信息:
(1)Al3+比 Mg2+先沉淀,pH=5.2 时 Al3+已沉淀完全而Mg2+还没有开始沉淀。
(3)Mg2+沉淀完全之后(pH=12.4),Al(OH)3还没有完全溶解(pH=12.8)。
由此可以判断:图2中先沉淀后溶解的分析肯定错误,但从中可以看出 n(Mg2+): n(Al3+)=1∶1。图 3 中 OA 段应是 Al3+沉淀:Al3++3OH-=Al(OH)3↓;AB 段则是 Al(OH)3开始溶解和 Mg2+开始沉淀:Al (OH)3+OH-=AlO2-+2H2O,Mg2++2OH-=Mg (OH)2↓;BC 段仍是 Al (OH)3在溶解和Mg2+在沉淀,不难选出D答案。但若稍加思考,该题的表格和图象均有值得商榷的地方。
三、对该问题的再思考
1.例2中值得商榷之处
(1)信息的给出。表格给出的pH数值都是根据溶度积常数 Ksp 数值计算得出:Ksp [Al (OH)3]=c (Al3+)·c3(OH-),Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-),可见沉淀开始和沉淀完全的pH与Mg2+、Al3+的起始浓度有关,该条件不给出会让学生误以为任何情况下Mg2+、Al3+沉淀的pH都是表中数据。
(2)图象的作法。题中图3是“小周根据实验结果绘制”,图中有几处疑问。
①AB段曲线。根据命题者意图,AB段曲线应是Mg2+被沉淀和 Al(OH)3不断溶解的过程,而 pH=7.8~9.4之间,不仅没有沉淀形成Al(OH)3还在溶解,沉淀的物质的量不会是单调直线上升。
②B点位置。根据分步沉淀的先后顺序,1molAl3+首先消耗 3molOH-,然后先发生 Al(OH)3部分溶解,则后面2mol(3mol~5mol)不全用来沉淀 Mg2+,即 B 点 Mg2+没有完全沉淀,B点的纵坐标达不到2mol,即低于图2中B点位置。
[如果考虑Mg2+、Al3+之间的相互影响,上述情况可能并非如此。——编者注]
2.修改建议
(1)指明实验条件。例如:室温下,向100mL浓度各为 0.1mol/L 的 Mg2+、Al3+的混和溶液中逐滴加入 NaOH溶液。
(2)变量修改。以NaOH的物质的量为变量与反应物的关系很易确定,但由于溶液对应pH很难从图中看出,一些细节不易在图中表达出来,尤其是pH=7.8~9.4之间的沉淀量变化,所以建议将图象横坐标改为混合液的pH,由pH计测定。
(3)作图方法。由于以pH为变量,很难得到pH与n(沉淀)或m(沉淀)的线形关系,建议通过描点作图的方法予以实现, 尤其是几个特殊点:pH=3.3、5.2、7.8、9.4、12.4等与沉淀量的关系。
建议步骤(根据实验条件选择pH计,最好用传感器将结果直接呈现在计算机上):
a.准确配制 100mL 浓度均为 0.1mol/L 的 MgCl2、AlCl3混合溶液;
b.取10mL上述混合液置于锥形瓶中,用碱式滴定管逐滴加入0.10mol/L的NaOH溶液,边振荡边用pH计测混合液pH;
c.当 pH=3.3 时,将锥形瓶中混合物过滤、洗涤、低温干燥、称量并记录结果;
d.另取10mL混合液,按照 c步骤操作,研究 pH=5.2、7.8、9.4、12.4 等情况下沉淀质量(经分析,不存在沉淀是混合物的情况);
e.根据5个特殊点描点作图(用传感器则直接得到图像)。
四、小结
沉淀溶解平衡是高中化学新教材的新增知识点,通过该节内容的学习,学生对沉淀的生成、溶解及转化有了更加理性的认识。一些原来只能定性分析的问题可以进行定量层次的深入思考,对问题的认识也更加透彻。图象是定量分析的一个重要载体,“Mg2+、Al3+混和溶液中滴加NaOH溶液”的图象问题就可以使得学生对Mg2+、Al3+的沉淀认识更加透彻。教学过程中用好这个例子,可以让学生更好地理解如何通过调节pH使不同金属阳离子分布沉淀的问题,事实上在分析化学中常用氨水和氯化铵混合溶液作为缓冲溶液[2],保持溶液 pH 在 9 左右分离 Mg2+、Al3+。
[1]武汉大学.吉林大学等校编.无机化学(第三版)[M].北京:高等教育出版社,2002:404~405
[2]华彤文等编.普通化学原理(第3版)[M].北京:北京大学出版社,2005:174

