灰树花母种培养基的筛选及不同碳、氮源对菌丝生长的影响
孟翔鹏,马 琳,吕斯琦,孙 静
灰树花(Grifola frondosa)又名栗(子)蘑、贝叶多孔菌、莲花菌、千(手)佛菌、云蕈、舞茸等。在分类学上隶属于真菌门,担子菌亚门,层菌纲,非褶菌目,多孔菌科,树花属。是近年来开发的珍奇药食两用菌之一,灰树花因其均衡丰富的营养价值,显著的医疗保健作用,而被誉为“食用菌王”,是极具发展前景的高档食用菌。中国、欧美、日本等许多国家对灰树花药理作用的研究表明,灰树花具有抗艾滋病病毒、抗癌、提高机体免疫、降血糖、刺激骨细胞生长和修复等多种药理活性[1-5]。笔者对不同母种培养基上灰树花菌丝的生长情况以及不同碳、氮源对灰树花菌丝生长的影响进行分析比较,优选出适宜菌种扩种繁殖的培养基和固体培养所需碳源、氮源等营养条件。
1 材料与仪器
1.1 菌种 灰树花(Grifola frondosa)购自中国微生物菌种保藏管理委员会普通微生物中心。
1.2 试剂 葡萄糖、蔗糖、乳糖、麦芽糖、果糖、蛋白胨、牛肉膏、酵母粉、硝酸氨(NH4NO3)、氯化氨(NH4Cl)、硝酸钠(NaNO3)、亚硝酸钠(NaNO2)、磷酸二氢钾(KH2PO4)、硫酸镁(MgSO4)、琼脂均为国产分析纯;马铃薯、麦麸、玉米粉为食品级。
1.3 仪器 CLIN-250C型生化培养箱(天津市华北实验仪器有限公司);JB-CJ-2FXS洁净工作台(苏州佳宝净化工程设备有限公司);YXQ-LS-SⅡ型高压灭菌锅(上海博讯实业有限公司);YS2-H Nikon生物显微镜(上海蔡康光学仪器有限公司);AB204N万分之一电子天平(上海精密仪器有限公司);DSC-W570型数码照相机(索尼数字产品有限公司)。
2 方法
2.1 供试培养基
2.1.1 试管母种培养基 配方A(g/L):马铃薯葡萄糖琼脂(PDA)培养基;配方 B(g/L):综合 PDA 培养基[7];配方 C(g/L):玉米粉 200,葡萄糖 20,琼脂 20,水 1 000 mL;配方 D(g/L):麦麸 200,葡萄糖 20,琼脂 20,水 1 000 mL;配方 E(g/L):葡萄糖 20,蛋白胨6,酵母粉 2,琼脂 20,水 1 000 mL;配方 F(g/L):板栗木屑 200,葡萄糖 20,琼脂 20,水 1 000 mL;配方G(g/L):马铃薯 200,板栗木屑 200,琼脂 20,水1 000 mL;配方 H(g/L):马铃薯 200,麦麸 100,琼脂20,水 1 000 mL;配方 I(g/L):葡萄糖 20,硝酸铵 4,磷酸二氢钾2,硫酸镁0.5,琼脂20,水1 000 mL。
2.1.2 母种平板培养基 基础培养基(g/L):磷酸二氢钾1,硫酸镁0.5,琼脂20,水1 000 mL;以上培养基pH值约为6.0。
2.2 平板培养基碳源实验 在基础培养基中添加浓度为2g/L的蛋白胨,再分别添加20g/L的葡萄糖、蔗糖、乳糖、麦芽糖、果糖、阳性对照(PDA)和空白对照(不加碳源),制成平板,无菌接种0.5 cm2大小的菌丝块,25℃黑暗培养,观测其生长状态。
2.3 平板培养基氮源实验 在基础培养基中添加浓度为20g/L的蔗糖,再分别添加蛋白胨、酵母粉、牛肉膏、NH4NO3、NH4Cl、NaNO3、NaNO2,空白(不加氮源)为对照,制成平板,其余操作同上。
2.4 验证实验 将优选出的碳源和氮源组合成新的培养基,加入基础培养基中,按上述操作,观测其生长状态,以上各组分别做5次重复。
2.5 数据处理与统计分析 菌丝日生长速度(mm/d)=菌落平均半径(mm)/生长天数(d),实验结果进行统计分析,用最小显著差数法(LSD)进行比较。
3 结果与分析
3.1 灰树花菌丝在9种不同的母种试管培养基上的生长情况 菌丝在9种试管培养基中均能生长,但表现各有差异,结果见表1。
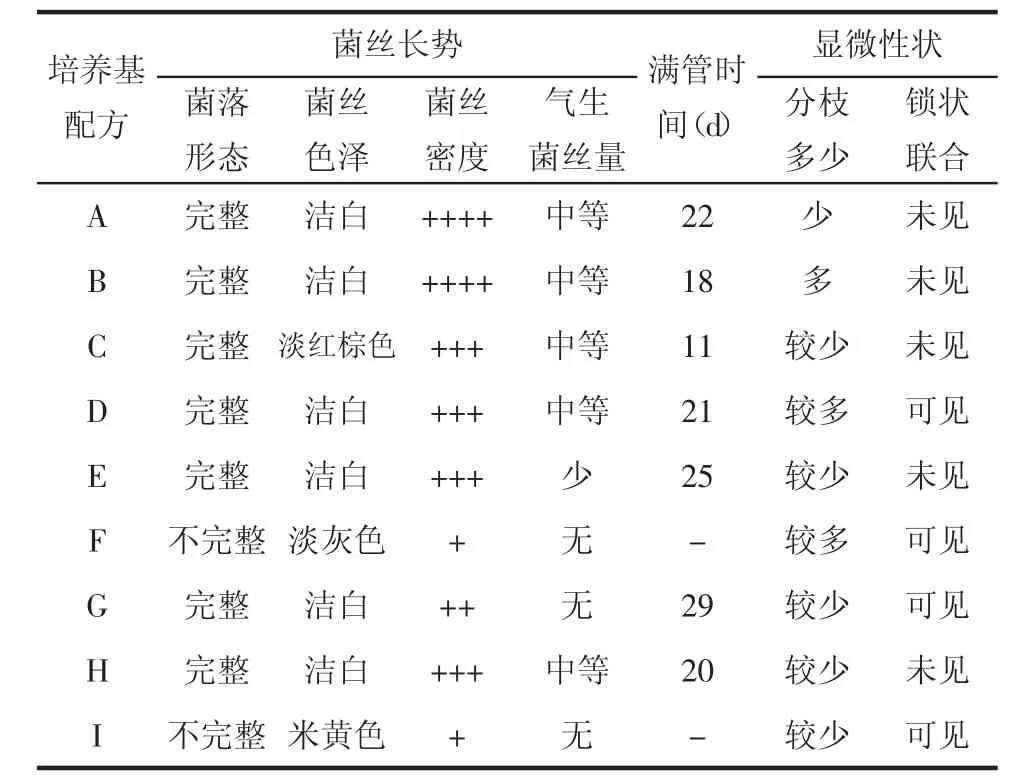
表1 菌丝在9种不同的母种试管培养基上的生长情况
衡量菌种质量优劣的两个重要指标是菌丝长势强弱和生长速度(满管时间)。灰树花菌丝长势特征中,菌落形态完整、色泽洁白、密度浓密、气生菌丝量中等、菌丝粗壮、分支较多、可见锁状联合等特征为菌种优良特征,符合以上特征的培养基为灰树花最佳筛选培养基[8]。由表1可见,培养基C满管时间最短,但是菌丝色泽为淡红棕色,表明老化严重,不利于其作为后续液体发酵或栽培的母种使用,弃去不选。培养基B满管时间为18 d,除了C之外,为生长速度最快的。除了未观察到锁状联合之外,其他特征均符合优良菌种特征,因此,选择B配方,即综合PDA培养基为灰树花母种最佳培养基。
3.2 不同碳源对平板培养基中菌丝生长的影响灰树花菌丝在5种碳源平板培养基中均能生长,但表现各有差异,结果见表2。果糖作为碳源时,菌丝生长速度最快,与阳性对照(PDA)没有差异,平均日生长速度为2.46 mm/d,其次依次为葡萄糖、麦芽糖、蔗糖和乳糖。果糖与葡萄糖相比,差异有极显著意义,因此选择果糖作为最佳碳源。
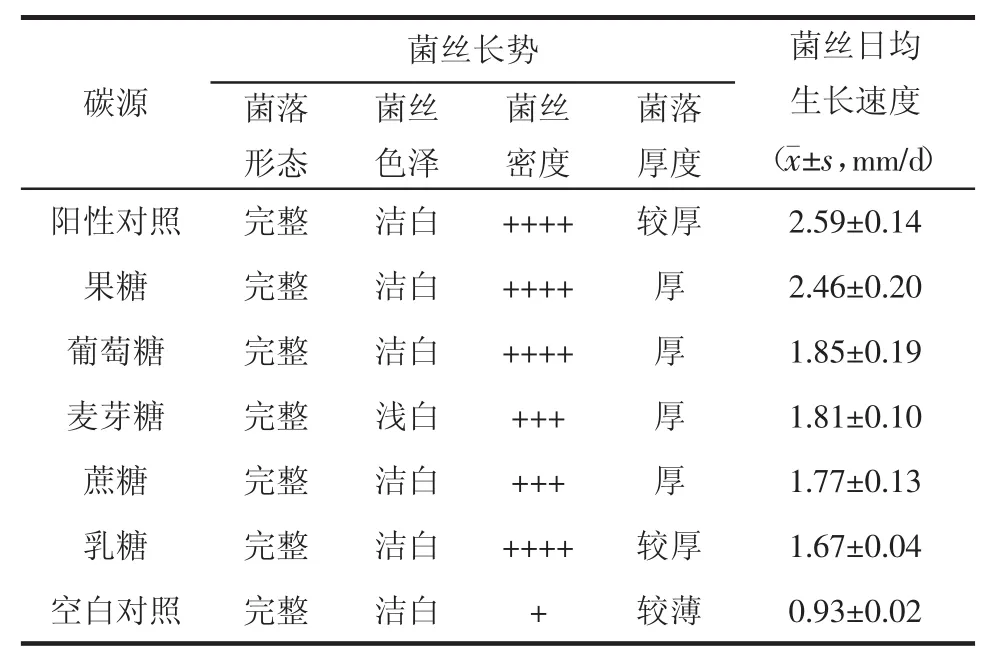
表2 不同碳源对灰树花菌丝生长的影响
3.3 不同氮源对平板培养基中菌丝生长的影响由表3可以看出,灰树花菌丝利用氮源的能力不尽相同,对有机氮源(牛肉膏、蛋白胨和酵母粉)的利用能力显著高于无机氮源,最适氮源为牛肉膏,菌丝日均生长速度2.09 mm/d,其次为生长速度没有显著差异的蛋白胨和酵母粉;无机氮源中,利用铵态氮(NH4Cl和NH4NO3)的能力明显高于硝态氮(NaNO2和NaNO3),相比较差异具有显著性。
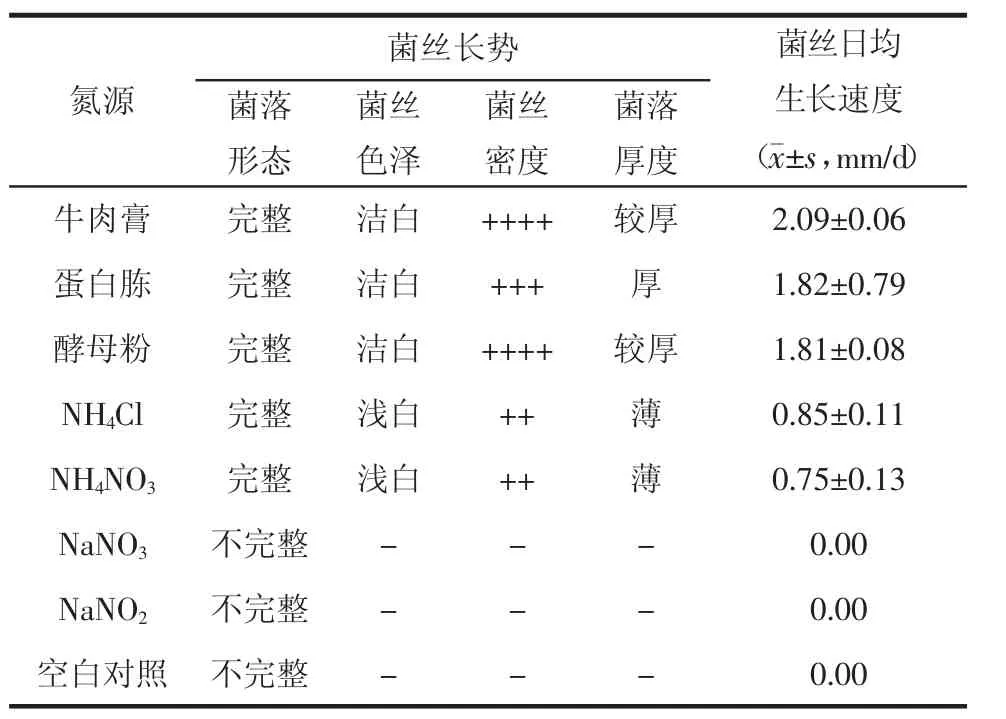
表3 不同氮源对灰树花菌丝生长的影响
3.4 最优碳、氮源对平板培养基中菌丝生长的影响 灰树花菌丝在由果糖和牛肉膏组成的最优培养基中无论菌丝生长速度还是长势,均表现良好:菌丝日均生长速度为3.0 mm/d,菌落形态完整,菌丝洁白,密度为++++,菌落较厚。
4 讨论
通过灰树花母种培养基配方的研究,结果表明:不同配方的培养基对灰树花菌丝生长速度以及长势都有较大影响,在供试的9种不同母种培养基中,筛选出最适合灰树花母种生长的培养基是B配方,即PDA综合培养基,满管时间短、生长速度快、长势强且不易老化。通过灰树花平板培养基碳、氮源筛选的研究,结果表明:葡萄糖、蔗糖、乳糖、麦芽糖、果糖都可以作为灰树花菌丝生长的碳源,但对菌丝生长速度和长势表现有所不同,以果糖为碳源时日均生长速度最快(2.46 mm/d),菌落完整、菌丝洁白、密度最厚,为最佳碳源。蛋白胨、酵母粉、牛肉膏、NH4NO3、NH4Cl、NaNO3、NaNO2作为氮源时,对灰树花菌丝生长速度和长势表现有所差异,以有机氮源最好,其中牛肉膏为氮源时日均生长速度最快(2.09 mm/d),菌落完整、菌丝洁白、密度较厚为最佳氮源,无机氮源利用较差,其中以铵态氮为氮源明显好于硝态氮。在以筛选出的最佳碳源(果糖)和最佳氮源(牛肉膏)组合成的新的培养基进行验证实验时,结果表明:菌丝长势良好,日均生长速度为3.0 mm/d,快于实验结果3.2中以果糖为碳源时的速度(2.46 mm/d),也快于实验结果3.3中以牛肉膏为氮源时的速度(2.09 mm/d)。
从差异显著性上来说,有碳源组明显优于无碳源组;果糖组明显优于其他碳源组,原因可能是果糖在分子结构上是一种酮糖,而葡萄糖、蔗糖、乳糖、麦芽糖都含有葡萄糖分子,即都含有醛糖结构,灰树花体内代谢的酮糖酶多于醛糖酶,导致利用含有酮糖结构的碳源速度较快。另外一个原因可能是由于在步骤2.2碳源实验中20g/L的果糖与2g/L的蛋白胨的碳/氮(C/N)相比其他4种糖的C/N更接近灰树花最适C/N。
[1]Hiroaki Nanba,Noriko Kodama,Douglas Schar.Effect of Maitake(Grifolafrondosa)glucanin HIV-infected patients[J].Mycoscience,2000,41(2):293-295.
[2]Yuki Masuda,Noriko Kodama,Hiroaki Nanba.Macrophage J774.1cellisactivatedbyMZ-Fraction(Klasma-MZ)polysaccharide in Grifola frondosa[J].Mycoscience,2006,47(3):360-366.
[3]李海花.灰树花多糖的免疫作用实验研究[J].中华中医药学刊,2007,25(2):365-366.
[4]周 伟,奚清丽,石根勇.灰树花多糖对糖尿病小鼠的降血糖作用[J].江苏预防医学,2009,20(4):17-20.
[5]Ashraf Saif,Ulrike Lindequist,Kristian Wende.Stimulating effects of Grifola frondosa on human osteoblastic cell cultures[J].J Nat Med,2007,61(1):231-238.

