高压氧治疗对正常及SIRS大鼠脾细胞凋亡的影响
中国医科大学附属第一医院急诊科(110001) 葛百平 赵宝宝 冯 芳 王 钢
作者:葛百平,中国医科大学急诊科研究生在读,现工作单位沈阳急救中心。
导致系统性炎症反应综合征(SIRS)和多器官功能衰竭(MODS)发生的主要诱因几乎能诱发所有类型细胞的凋亡[1-2],免疫炎症细胞凋亡紊乱及靶器官细胞大量凋亡的结果也可能是SIRS/MODS发生发展的因素之一[3-7]。SIRS的发生发展过程中有多种因素可以启动细胞凋亡。目前的研究认为,免疫细胞的大量凋亡是SIRS状态下免疫功能低下的重要原因。高压氧(HBO)治疗应用于SIRS状态下的研究目前主要集中于炎症、缺血/再灌注损伤等方面。而HBO对SIRS状态免疫功能影响方面的研究比较少见。HBO治疗指的是在2~3ATA(1ATA=101.325kPa)下给 100%的 O2,使动脉血氧分压(PaO2)达2000mmHg(1mmHg=0.133kPa),组织血氧分压达400mmHg。HBO是一氧化碳中毒、减压病和动脉气体栓塞首选治疗方法,在放射性骨病、梭状芽孢杆菌性肌坏死、难治性骨髓炎等疾病和皮肤移植中的疗效也被充分肯定[8],目前关于其在严重创伤或感染导致的SIRS状态下的应用也逐步探索。脾脏作为机体最大的免疫器官,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨噬细胞,是机体细胞免疫和体液免疫的中心,在对临床患者的研究中表明,SIRS患者存在明显的脾脏淋巴细胞凋亡的增加[9]。本实验就正常及SIRS状态下的大鼠脾细胞凋亡为对象,研究HBO治疗对于正常及SIRS状态下机体的免疫功能的影响。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠50只,购自中国医科大学实验动物中心,体重约140~180g,随机分为5组,每组10只。A组:腹腔注射等量生理盐水;B组:腹腔注射等量生理盐水,做3次HBO;C组:腹腔注射酵母多糖-石蜡悬液(500mg/kg);D组:腹腔注射酵母多糖-石蜡悬液(500mg/kg),做1次HBO;E组:腹腔注射酵母多糖-石蜡悬液(500mg/kg),做3次HBO。
1.2 主要试剂、仪器 酵母多糖-A(Sigma公司);AnnexinV-FITC凋亡检测试剂/试剂盒(Biovison公司);流式细胞仪,DWC400A/02-1型动物HBO舱。
1.3 大鼠SIRS模型建立 将酵母多糖粉剂和无菌液体石蜡混合,高频振荡15分钟,100℃水浴80分钟灭菌,制成浓度为100mg/mL的酵母多糖A-石蜡混悬液,存放于4℃备用。临用前40℃ 水浴复温,高频振荡15分钟后供注射。大鼠实验前18小时开始禁食,不禁水。C、D、E组以500mg/kg体重予大鼠腹腔注射酵母多糖A-石蜡悬液,A、B组注射等量生理盐水。
1.4 HBO治疗方案 1次HBO的时间为腹腔注射后4小时,3次HBO的时间分别为腹腔注射后4小时、10小时、18小时。每次 HBO都遵循以下方案:100%纯氧洗舱5分钟,以清除舱内原有空气。匀速加压至2ATA(15分钟),用已校对的测氧仪测舱内氧浓度达90%以上,期间以4L/min的速度持续通O2避免CO2蓄积,并将压力维持在2ATA。1小时后以同样速度匀速减至常压,出舱。
1.5 标本采集及检测 腹腔注射24小时后,标记大鼠顺序杀鼠取脾、标号,脾脏剪至糊状,100目筛滤过(加PBS),离心1000rpm10分钟,弃上清,低渗休克法溶解红细胞,RPMI1640调整细胞浓度1×106/mL,取上述液体0.1mL进行如下步骤:4℃离心10分钟,弃上清,加入冷PBS1mL,轻轻震荡,于4℃下1000rpm离心10分钟,弃上清,重复2次,加200μL Buffer,加 10μLAnnexinV-FITC,加 PI10μL,置于25℃,15 分钟,加300μLBuffer,30 分钟内上机检测,以上按照AnnexinV-FITC凋亡检测试剂/试剂盒说明书操作。
1.6 统计方法 用SPSS18.0forWindows软件分析数据。各组数值用均数±标准差表示,采用One-WayANOVA方法,P<0.05为差异有显著性。
2 结果
2.1 大鼠SIRS模型建立效果 腹腔注射酵母多糖-石蜡溶液组大鼠呼吸急促,伴有明显喘鸣,皮肤黏膜发绀,出汗,毛色灰暗,部分大鼠有鼻出血,腹胀,腹泻。大鼠进食明显减少,活动差,对外界刺激无反抗。杀鼠后,见SIRS组大鼠腹腔渗出增多,肠管扩张,程度不一。肝脏呈暗红色或暗紫色。肺脏可见不同程度肿胀,部分可见充血出血点。心脏、肾脏、脾脏、胰腺无明显大体改变。
2.2 HBO治疗的影响
2.2.1 HBO对正常脾细胞凋亡的影响 在本次实验中,经过HBO治疗的大鼠脾细胞凋亡有增加,但与正常组相比较,差异无显著性(P>0.05)。
2.2.2 SIRS状态对大鼠脾细胞凋亡的影响 在本实验中,SIRS状态下大鼠脾细胞的凋亡率比对照组有明显升高(P <0.05)。
2.2.3 HBO对 SIRS大鼠脾细胞凋亡的影响 在SIRS组中,HBO显示了明显的作用,无论是1次HBO组,还是3次HBO组,凋亡率均明显减少(P<0.05),但此实验中,1次 HBO组和3次HBO组并未发现有明显差异(P>0.05)。各组脾细胞凋亡比例分别是A组(13.30±8.94)%;B组为(16.25±11.24)%;C 组为(25.40 ±4.17)%;D 组为(12.91 ±3.67);E 组为(15.97 ±4.27)%。各组间比较,B组与A组比较,P >0.05;C组与A、B组比较,P<0.05;D组、E组与C组比较,P<0.05;D组与E组比较,P >0.05。
各组脾细胞凋亡比例的比较,见图1。
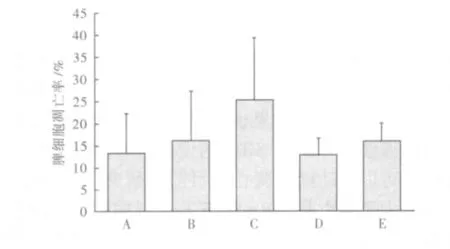
图1 各组脾细胞凋亡比例的比较
3 讨论
SIRS概念是上世纪90年代提出,经10余年的研究探索,发现从感染、创伤等病因发展到MODS的过程中,都存在着一条共同通路,即SIRS。SIRS具有以下特征:1)体温>38℃或<36℃。2)心率>90次/分。3)呼吸 >20次/分或 PaCO2<32.33mmHg。4)血白细胞 >12×109/L或<4 109/L,或未成熟粒细胞>103。具备上述表现2种或以上可确认为SIRS,上述标准后于2001年增加了炎症指标及高排低阻的血液动力学指标,白细胞介素-6(IL-6)达 279 ~ 5979pg/L 被 认为 存 在 SIRS[10]。Bone将典型的SIRS分成5个时期:第1期为局部炎症反应期,炎症反应局限于感染或损伤局部;第2期为全身炎症反应始动期,早期的促炎及随后的抗炎介质进入体循环;第3期为全身炎症反应期,机体出现失去控制的,自我持续放大和自我破坏的炎症,表现为播散性炎细胞活化、炎症介质泛滥形成瀑布效应,并由此引起远隔部位的炎症反应,引起组织损伤。第4期为代偿性抗炎反应综合征(CARS)期,抗炎反应过度,导致免疫功能抑制及对感染的控制和抵抗能力下降;第5期为免疫不协调期,表现为多脏器功能失调,病死率高,即MODS[11-12]。失控的炎症反应导致的免疫功能失调是SIRS状态的特点。
细胞凋亡又被称为程序性细胞死亡(PCD),是一种重要的生命现象,不仅出现在生理情况下,更与肿瘤、自身免疫性疾病及退行性神经病变等多种疾病密切相关。在近年来的研究中,细胞凋亡在SIRS到MODS的发生发展的过程中备受关注[13]。
SIRS状态下,机体处于强烈应激状态,全身血流重新分布,胃肠、肝胆系统、肾脏甚至肺脏血管强烈收缩,内脏缺血缺氧。持续的缺氧,长时间的高浓度儿茶酚胺刺激,内源性阿片肰对肾上腺能受体(AR)的抑制等原因,使全身的AR敏感性降低甚至失敏,此时内脏血管重新开放,造成内脏组织的缺血再灌注损伤(IR),自由基、炎症介质及细胞因子并大量释放,内脏瘀血缺氧,微循环障碍,细胞能量代谢障碍[14]。众所周知,这些因素都可以导致免疫细胞和实质细胞凋亡,免疫细胞大量凋亡的结果会导致免疫功能低下[7,15],实质细胞的凋亡则产生器官功能障碍[16]。
有研究证实,线粒体是缺血、缺氧损害的核心靶细胞器,线粒体损害是全身性缺血、缺氧损害的最关键环节。近年来的研究表明,细胞凋亡过程中,线粒体起到了至关重要的作用。线粒体是细胞生命活动控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡调控中心,与凋亡相关的很多关键事件都发生于线粒体,在凋亡的线粒体途径中,线粒体上的线粒体通透性转变孔道(PT孔道)被认为是细胞的生死开关,PT孔开放会引起线粒体跨膜电位ΔΨm下降和细胞色素C释放,一旦线粒体跨膜电位因能量代谢障碍而耗散,细胞将进入不可逆的凋亡[17-18]。
HBO对机体SIRS状态的治疗作用是系统而不是局部的增加氧张力,提高氧分压,可以改变血流携氧方式,以物理溶解的方式向缺血组织供氧,增加氧的弥散距离,甚至能够到达因微循环阻塞而红细胞不能到达的组织,从而改善微循环,改善缺血、缺氧组织血供,甚至可以使组织达到无血存活。研究显示,HBO治疗可以减少致炎介质的数量,有明显的抗炎作用。HBO治疗酵母多糖诱导休克的大鼠实验研究证实,HBO治疗减少SIRS状态下TNF-alpha分泌[19]。创伤失血性休克复苏后大鼠肠道组织TNF-alpha水平明显升高,HBO治疗显著降低TNF-alpha水平,抑制过度炎症反应[20]。Kaelin等在鼠游离皮瓣移植应用HBO处理的研究中发现,SOD活性明显升高,从而减少氧自由基。HBO治疗能够改善缺血、缺氧组织的供氧,阻断细胞能量代谢障碍,稳定线粒体跨膜电位 ΔΨm[21]。
本实验结果显示,SIRS状态下脾细胞凋亡明显增加(P <0.05),而HBO治疗显著降低了SIRS状态下大鼠脾细胞凋亡(P<0.05)。HBO治疗1次与3次组并未有明显差异(P >0.05),这说明HBO治疗能减少SIRS状态下的脾细胞凋亡,且这种作用不依赖于暴露的剂量和时间。HBO治疗减少脾细胞凋亡可能的机制,首先是HBO治疗能改善机体缺血缺氧,改善微循环,保证能量代谢,维持 ATP水平,阻止线粒体损伤,防止细胞凋亡;其次HBO治疗有抑制过度的炎症反应作用,减少TNF-alpha等炎症介质,从而抑制脾细胞凋亡;再次,HBO治疗可能通过减少自由基的产生,抑制生物膜的脂质过氧化,从而阻断细胞的凋亡过程。
研究结果[23-25],给予HBO治疗,可以导致自由基产生,随后SOD活性反应性的升高,结果导致总体上自由基减少,但随着治疗剂量的增加,SOD的耗尽,自由基产生会再次增加。因此,HBO治疗应用于临床,其治疗时机、剂量,以及治疗中抗氧化剂的应用等都需要进一步研究。目前关于HBO治疗能否阻断SIRS状态发展到MODS的研究已经有所开展,本实验表明HBO治疗在这方面有广阔的前景。
[22]
[1] 许永华,杨兴易.危重病的细胞凋亡发生机制及其治疗前景[J].急救医学杂志,2003,23(6):407
[2] 许国根,王弋,缪群,等.全身炎症反应综合征患者抗炎因子对T淋巴细胞凋亡的影响[J].中华急诊医学杂志,2002,11(4):249
[3] Cantaluppi V,Assenzio B,Pasero D,et al.Polymyxin-B hemoperfusion inactivates circulating proapoptotic factors[J].Intensive Care Med,2008,34(9):1638
[4] Mariano F,Cantaluppi V,Stella M,et al.Circulating plasma factors induce tubular and glomerular alterations in septic burns patients[J].Crit Care,2008,12(2):42
[5] Kucklebrug CJ,Tiwari R,Czuprynski CJ.Endothelial cell apoptosis induced by bacteria-activated platelets requires caspase-8 and-9 and generation of reactive oxygen species[J].Thromb Haemost,2008,99(2):363
[6] Gambim MH,Carmo Ade O,Marti L,et al.Platelet-derived exosomes induce endothelial cell apoptosis through peroxynitrite generation:experimental evidence for a novel mechanism of septic vascular dysfunction[J].Crit Care,2007,11(5):107
[7] Hotchkis RS,Chang KC,Gmyson MH,et al.Adoptive transfer of apoptotic splenocytes worsens survival,whereas adoptive transfer of necrotic splenoeytes improves survival in sepsis[J].Proc Natl Acad Sci USA,2003,100(11):6724
[8] Al-Waili NS,Butler GJ,Petrillo RL,et al.Hyperbaric oxygen and lymphoid system function:A review supporting possible intervention in tissue transplantation[J].Technol Health Care,2006,14(6):489
[9] Hotchkiss RS,Tinsley KW,Swanson PE,et al.Sepsis-induced apoptosis causes progressive profound depletion of B and CD4+T lymphocytes in humans[J].J Immunol,2001,166(11):6952
[10] Levy MM,Fink MP,Marshall JC,et al.2001 SCCM/ESICM/ACCP/ATS/SIS international sepsis definitions conference[J].Crit Care Med,2003,31(4):1250
[11] Martignoni A,Tschep J,Goetzman HS,et al.CD4-expressing cells are early mediators of the innate immune system during sepsis[J].Shock,2008,29(5):591
[12] 黄志英.感染性休克研究进展[J].中国卫生检验杂志,2009,19(3):709
[13] Hotchkiss RS,Swanson PE.Apoptotic cell death in patients with sepsis,shock and multiple organ dysfunction[J].Crit Care Med,1999,27(7):1230
[14] 龙晓弘,赵晓琴.多器官功能障碍综合征发病机制研究进展[J].蛇志,2007,19(2):145
[15] Wesche DE,Lomas-Neira JL,Perl M,et al.Leukocyte apoptosis and its significance in sepsis and shock[J].J Leukoc Biol,2005,78(2):325
[16] Hori Y,Takeyama Y,Ueda T,et al.Macrophage-derived transforming growth factor-beta1 induces hepatocellular injury via apoptosis in rat severe acute pancreatitis[J].Surgery,2000,127(6):641
[17] 梁晚益,黄跃生,杨宗城.严重烧伤早期心肌线粒体磷脂变化及其机制[J].中华创伤杂志,2001,17(7):416
[18] 谢燕,朱光旭,江海洪,等.缺氧-复氧对心肌细胞NRF1与mt2TFR表达的影响[J].第三军医大学学报,2001,23(12):1399
[19] Yamada T,Taguchi T,Hirata Y,et al.The protective effect of hyperbaric oxygenation on the small intestine in ischemia-reperfusion injury[J].J Pediatr Surg,1995,30(6):786
[20] 金立方,王为成,王钢.HBO防止创伤/失血性休克复苏后大鼠肠道缺血-再灌注损伤[J].中华急诊医学杂志,2009,18(11):1183
[21] Kaelin CM,Im MJ,Myers Ra,et al.The effects of hyperbaric oxygen on free flaps in rats[J].Arch Surg,1990,125(5):607
[22] Kudchodkar B,Jones H,Simecka J,et al.Hyperbaric oxygen treatment attenuates the pro-inflammatory and immune responses in apolipoprotein E knockout mice[J].Clin Immunol,2008,128(3):435
[23] Buras JA,Holt D,Orlow D,et al.Hyperbaric oxygen protects from sepsis mortality via an IL-10-dependent mechanism[J].Crit Care Med,2006,34(10):2624
[24] Chen MF,Chen HM,Ueng SWN,et al.Hyperbaric oxygen pretreatment attenuates hepatic reperfusion injury[J].Liver,1998,18(2):110
[25] G Thom S.Functional inhibition of leukocyte b2 integrins by hyperbaric oxygen in carbon monoxide-mediated brain injury in rats[J].Toxicol Appl Pharmacol,1993,123(2):248

