鲜生地对大鼠肠源性内毒素血症防治作用的实验研究
天津南开医院 (天津 300100)房 杰 孙兰菊 陈明慧
肠源性内毒素血症[1]在临床疾病的发生发展过程中起着非常重要的作用,目前被越来越多的人重视,已成为临床及科研热点问题。肠缺血再灌注损伤(Ischemia-reperfusion injury,I/R)不仅可导致肠道粘膜局部组织坏死,产生肠源性内毒素血症,还可导致肠道菌群移位和肠吸收功能的改变,以及远处器官的损害,甚至发生多系统器官功能不全综合征。本研究拟通过肠缺血再灌注建立大鼠肠源性内毒素血症模型,观察鲜生地治疗对肠源性内毒素血症的影响,探讨其作用机制,为肠源性内毒素血症的治疗提供思路。
材料与方法
1 材 料 鲜生地来源于河南武陟县,经鉴定为玄参科植物地黄的根状茎,采购后真空冻存保鲜[2],去皮后榨汁使用。乳果糖口服液由苏威制药生产。内毒素测定试剂盒由上海医学实验所提供。
2 方 法
2.1 实验动物与分组:健康成年 SD大鼠 180只,体质量 200~ 220g,由军事医学科学院四所动物中心提供,实验前适应性喂养 3d。随机分为 5组,即正常组、肠缺血再灌注(I/R)组、I/R+鲜生地大剂量组(15ml/kg体质量)、I/R+鲜生地小剂量组(7.5ml/kg体质量)和 I/R+乳果糖组(7.5ml/kg体质量),每组36只,雌雄各半。正常组、I/R模型组按 7.5ml/kg体质量生理盐水灌胃,用药组给予相应剂量药物灌胃。提前给药 3d后造模,术前禁食 12h,自由饮水。
2.2 大鼠模型的建立:参照 Koike等方法复制肠I/R模型。大鼠腹腔注射 10%水合氯醛(30ml/kg体质量)麻醉,经腹正中切口,分离肠系膜上动脉,微动脉夹夹闭其根部,30min后取出动脉夹,恢复血供,进行腹部切口缝合,再灌注 24h、48h、72h时麻醉下腹腔切开,留取门静脉血液,肠组织标本。
2.3 显微镜观察:距十二指肠球部 10cm处相同部位取约 1cm肠管,4℃生理盐水洗去肠内容物,除去外膜脂肪组织,固定于 4%多聚甲醛 12h。常规石蜡切片,HE染色,在光镜下观察。肠粘膜病理损伤程度分 5级。光镜下阅片由两人分别独立进行,取均值,按照分级进行评分。
2.4 内毒素测定:血液肝素抗凝后,在 4℃低温离心机,500r/min离心 10min后,分离血浆,采用合成基质偶氮显色法鲎试验测定血浆内毒素。
2.5 统计学方法:数据处理采用 SPSS11.5软件,结果以(±s)表示。组内治疗前后比较用方差分析,组间比较采用 t检验。
结 果
1 各组大鼠血浆内毒素含量变化:I/R组血浆各时点 ET含量明显高于正常组,鲜生地大、小剂量组及乳果糖组与 I/R组相比,各时点血浆 ET含量均明显降低。而鲜生地汁大、小剂量组与乳果糖组各时点血浆ET水平无显著差异,见表 1。
表1 各组大鼠门静脉血内毒素含量比较(±s,Eu/ml)
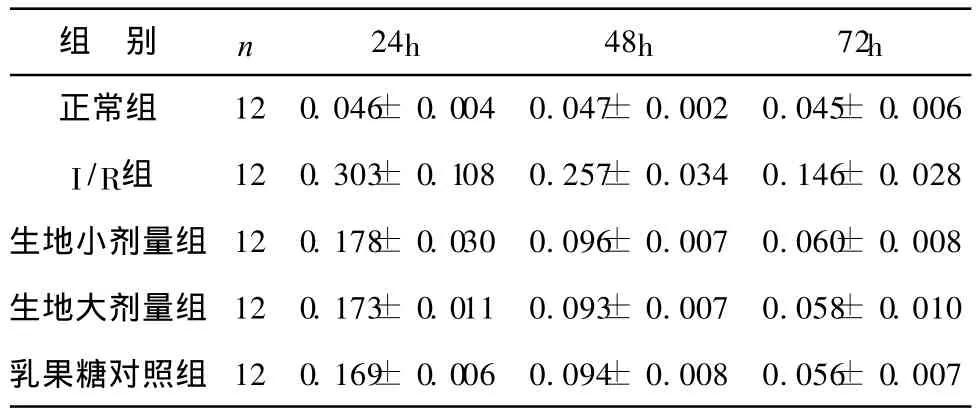
表1 各组大鼠门静脉血内毒素含量比较(±s,Eu/ml)
注:I/R组与正常组比较,各时点 P<0.01;I/R组与鲜生地大、小剂量组,乳果糖组相比,各时点 P<0.05;鲜生地汁大、小剂量组与乳果糖组相比,各时点 P> 0.05。组内比较,鲜生地大、小剂量组,乳果糖组不同时点 P<0.01
组 别 n 24h 48h 72h正常组 12 0.046± 0.004 0.047± 0.002 0.045± 0.006 I/R组 12 0.303± 0.108 0.257± 0.034 0.146± 0.028生地小剂量组 12 0.178± 0.030 0.096±0.007 0.060±0.008生地大剂量组 12 0.173± 0.011 0.093±0.007 0.058±0.010乳果糖对照组 12 0.169± 0.006 0.094±0.008 0.056±0.007
2 各组肠粘膜病理损伤情况及评分:正常组小肠粘膜结构完整,无毛细血管淤血和炎症细胞浸润(图A)。 I/R组小肠粘膜明显损伤,随 I/R时间的延长,肠粘膜损伤加重,肠绒毛排列紊乱,至粘膜脱落和出血(图 B)。炎症细胞浸润增多且逐渐扩散,由充血进而出血且范围扩大,以至造成为中重度损伤,甚至累及浆膜层。鲜生地大、小剂量组及乳果糖组各时点肠粘膜损伤程度较 I/R组有明显改善,见表 2。
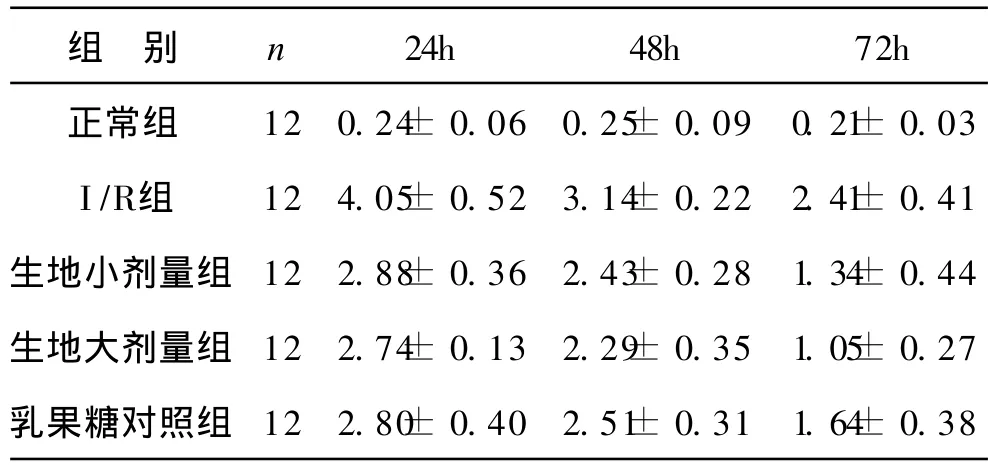
表2 各组大鼠肠粘膜损伤评分表

图 A 正常组(HE× 100)

图 B I/R组 (HE×100)
讨 论
肠道作为人体的消化器官,在维持机体正常营养中起着极其重要的作用[3]。肠道依靠其屏障功能及正常的微生态环境等,有效阻止肠道细菌移位和内毒素血症的发生。但肠粘膜的缺血缺氧及再灌注损伤、应激性损伤、营养障碍等因素[4,5]均可直接或间接造成肠道屏障的破坏,从而使肠粘膜通透性升高。肠屏障功能减弱,就可使大量的细菌和内毒素经由门静脉和肠系膜淋巴系统侵入体循环,造成肠源性内毒素血症和细菌移位,并在一定条件下激发细胞因子和其它炎症介质反应,产生持续性全身炎症反应,导致多器官功能衰竭(MODS)。
我们的研究结果观察到 I/R组血浆各时点 ET含量明显高于正常组,鲜生地大、小剂量组及乳果糖组与I/R组相比,各时点血浆 ET含量均明显降低。而鲜生地汁大、小剂量组与乳果糖组各时点血浆 ET水平无显著差异,证实了鲜生地对肠源性内毒素血症具有治疗作用。同时鲜生地大、小剂量组及乳果糖组各时点肠粘膜损伤程度较 I/R组有明显改善。I/R组大鼠肠粘膜损伤评分明显高于正常组,鲜生地汁大、小剂量组及乳果糖组与 I/R组相比,肠粘膜损伤评分明显降低,提示鲜生地汁、乳果糖可使肠粘膜损伤降低,对肠粘膜有保护作用。
鲜生地偏于寒,具有清热生津之功效,味甘苦,性大寒,苦寒泄热,甘寒质润,以养阴润燥,入心肝血分,具有缓泻作用。肠源性内毒素血症可纳入中医热证范畴,应用鲜生地甘、苦、寒的特性治疗药对其证。赵润生等[6]研究表明生地黄能明显改善血瘀证大鼠血液流变学相关指标,具有改善微循环的作用。 Prieto JM等[7]研究了 15种中国抗炎的药用植物对白血球和血小板功能的影响,发现地黄能有选择的抑制完整白血球和血小板 12-(S)-HHT1E(一个有效的环加氧酶活性标志)产生,表明其具有一定的抗炎症作用。综上考虑鲜生地治疗对肠粘膜的保护作用可能与其改善微循环、抗炎作用以及富含多种氨基酸物质等有关。总之,应用鲜生地汁治疗对肠源性内毒素血症具有治疗作用,其机理可能与鲜生地缓泻及对肠粘膜的保护作用有关。
[1]陈炜萍.肠毒清颗粒治疗脾虚兼湿热内蕴型肝硬化肠源性内毒素血症 60例[J].陕西中医,2010,31(1):22-24.
[2]贾建伟,李俊萍,马 莹,等.鲜生地保鲜技术的研究 [J].中草药,2005,36(10):1569-1570.
[3]李秋伟,刘旭强,房 杰,等.鲜生地汁对大鼠肠缺血再灌注损伤保护作用的实验研究[J].陕西中医,2008,29(2):241-242.
[4]刘春峰,袁 壮.内脏缺血缺氧代谢障碍在 SIRS和MODS中的作用 [J].小儿急救医学,2000,7(4):180-182.
[5]Secchi A,Ortanderl JM,Schmidt W,et al.Effect of endotoxemia on hepatic portal and sinusoidal blood flow in rats[J].J Surg Res,2000,89(1):26-30.
[6]赵润生,张一昕,苗冬雪,等.生地黄对血瘀模型大鼠血液流变性的影响[J].中药药理与临床,2006,22(3、4):123.
[7]Prieto JM,Recio M C,Giner RiM,et al.Influence of traditional Chinese anti inflammatory medicinal plants on leukocyte and platelet functions[J].J Pharm Pharmacol,2003,55:1275-1282.

