蛋白激酶C对Bcl-2、Bax调控兔脊髓空洞前状态神经元凋亡的影响
李秀山 孙国柱 高晓伟 杨雷方 王目纲 刘性强 韩仰军
(河北省馆陶县人民医院神经外科,河北 馆陶 057750)
脊髓空洞前状态是脊髓空洞症形成的最初始病理变化,业已证实是脊髓空洞防治的最佳时间窗〔1〕。有证据表明,在神经系统发育和急慢性损伤中可见到凋亡发生〔2,3〕,本课题组前期研究也证实脊髓空洞前状态中存在神经细胞凋亡〔4〕。近年来,文献报道在细胞信号传导中起重要作用的蛋白激酶C(PKC)参与了神经元的缺血性损伤,特别是神经元凋亡〔5〕。但脊髓空洞前状态PKC的激活在神经细胞凋亡中所起的作用未见报道,为此,本研究通过测定动物模型上颈髓神经细胞胞质与胞膜 PKC的活性变化及Bcl-2、Bax表达变化,探讨PKC激活参与脊髓空洞前状态神经细胞凋亡的可能机制。
1 材料与方法
1.1 材料 健康、体重1.5~2.0 kg的新西兰白兔56只由河北医科大学实验动物中心提供,随机分为三组,其中高岭土(Kaolin)组40只,生理盐水组和假手术组各8只。Kaolin(分析纯)购于上海试剂四厂。Pep Tag非放射性PKC活性检测试剂盒购于美国Promega公司。鼠抗Bcl-2单克隆抗体、鼠抗Bax单克隆抗体,均为Santa Cruz公司产品。细胞凋亡检测试剂盒购于武汉博士德公司。
1.2 模型制作 应用氯胺酮(30 mg/kg)耳缘静脉麻醉,按文献方法制作动物模型〔6〕;生理盐水组动物枕大池仅注入37℃生理盐水0.6 ml;假手术组动物仅行枕大池假穿刺以作对照。术后分笼饲养,自由进水,连续7 d肌肉注射抗生素预防感染,必要时予以营养支持。模型成功的标志:枕大池穿刺抽出无色、透明脑脊液,Kaolin顺利注入枕大池且动物出现一过性四肢瘫。
1.3 术后神经功能判定 术后每日应用改良的Tarlov评分法对动物进行行为学评分,标准如下:0分:无自主活动;1分:仅限于髋膝关节的非反射性运动;2分:髋膝踝3个主要关节的活动;3分:能主动支持体重和不协调步态,或偶尔出现协调步态;4分:前后肢协调步态,行走时有趾间关节运动;5分:正常步态。
1.4 标本的制作和采集 对照组(生理盐水组和假手术组)在术后,Kaolin组动物分别在术后第1,3,7,14,21天各组随机选取8只,在氯胺酮过度麻醉下断头处死,取出上颈髓,其中10 mm颈髓在-70℃低温保存备PKC活性测定之用;剩余置入40 g/L多聚甲醛固定液中后固定24 h,常规脱水、透明、石蜡包埋、4μm切片,用于组织学观察和免疫组织化学染色观察。
1.5 底物磷酸化法测定脊髓PKC活性
1.5.1 胞膜/质蛋白提取 各实验操作均在4℃以下进行。切取100 mg标本,匀浆粉碎,100 000 g离心1 h,上清液为胞浆蛋白,移至另一管中;沉淀部分加入胞膜蛋白提取液,超声波助溶、过夜,100 000 g离心1 h,上清即为胞膜蛋白。
1.5.2 PKC活性测定 采用美国Promega公司的 Pep Tag非放射性PKC活性检测试剂盒。按说明书将提取的膜性和胞浆PKC蛋白分别与PepTag C1肽、PKC激活溶液共同孵育30 min,上样于0.8%琼脂糖凝胶,恒压(100 V)电泳约20 min,即有磷酸化部分的分离条带明显出现,用刀片快速从阴极取下包括磷酸化部分的条带(体积约250μl),加热融化。在凝胶溶解液中摇匀,置于570 nm波长下,读取吸光度,并按说明书计算PKC活性,用 pmol·min-1·mg protein-1表示。
1.6 Bcl-2和Bax免疫组化染色 采用链霉菌抗生物素蛋白-过氧化物酶免疫组织化学染色试剂盒进行染色。采用HPIAS-1000彩色病理图文分析系统,每张切片任取5个视野,高倍镜下记数总细胞数和阳性细胞数,计算阳性细胞百分比。
1.7 TUNEL法检测细胞凋亡 按试剂盒说明书操作。高倍视野(×400)下计算凋亡指数(AI),即每张片选取5个阳性细胞数最多的高倍视野,计算出平均阳性细胞百分数。
1.8 统计学分析 应用SPSS10.0统计软件,各组数据以x ±s表示,采用单因素方差分析(ANOVA)。
2 结 果
2.1 术后动物神经功能改变 Kaolin组动物除术后出现一过性四肢瘫外,于术后第3天出现进食减少、精神萎靡;第7天出现神经功能障碍,包括反应迟钝、四肢无力、行走不稳,甚至瘫痪,并随时间的延长而逐渐加重,甚至有的动物出现脊柱侧弯。与生理盐水组和假手术组比较差异显著 (P<0.05)。见表1。
2.2 光镜观察结果 Kaolin组动物于术后第3天神经细胞特别是神经元轻度肿胀。第7天细胞周围间隙明显较前增大,神经元水肿加重,核膜、核仁稍显模糊,管周组织略显疏松(图1A),Kaolin性肉芽肿与脊髓粘连较轻。第14天细胞周围间隙较前进一步增大,核膜、核仁模糊甚至消失,神经元胞体内尼氏体减少或消失 (图1B),中央管饱满,室管膜细胞受压变平,管周组织疏松,呈明显水肿改变;蛛网膜下腔可见Kaolin沉积,大量炎性细胞浸润。第21天脊髓组织结构明显紊乱,水肿稍显减轻,胞质出现空泡,前角神经元数量减少,胶质细胞增生 (图1C),中央管张力增加,室管膜上皮断裂、脱落,Kaolin性肉芽肿形成。生理盐水组和假手术组动物脊髓神经元轮廓正常,核及核仁清楚,胞质内尼氏体分布均匀,神经胶质细胞正常。
2.3 脊髓空洞前状态中细胞凋亡情况和Bcl-2、Bax表达变化Kaolin组动物术后各个时间点神经元均有凋亡发生。典型的凋亡细胞表现为染色质凝集、边集化,聚集于核膜下 (图2A)。Bcl-2、Bax阳性细胞为细胞内有棕黄色粗颗粒或棕黄色细腻颗粒弥漫分布 (图2B、2C)。神经元凋亡于术后第1天增加,7~14 d达高峰,以后逐渐降低,21 d仍可见到凋亡发生。Bax阳性表达趋势与神经元凋亡基本一致,且Bax阳性表达明显强于Bcl-2。正常对照组和假手术组仅见少量凋亡的少突胶质细胞,Bcl-2、Bax亦仅有少量弱阳性反应细胞。见表1。
2.4 胞膜、胞质PKC活性变化 Kaolin组动物术后第1天上颈髓神经细胞胞膜PKC活性就开始增高,第7~14天达到最高峰,21 d开始回落;胞质PKC活性则出现相反变化趋势,即术后第1天开始降低,7~14 d达到最低点,21 d有所回升。定量分析结果发现:Kaolin组动物术后1 d胞膜PKC活性增加70%;7~14 d达到最高点,增加3倍之多;21 d开始回落,但仍高于正常 (P<0.05)。胞质PKC活性呈相反趋势,术后1 d出现降低;7~14 d达到最低点,降幅达50%;21 d开始回升,但仍低于正常对照组 (P<0.05)。见表1。

表1 动物Tarlov评分、空洞前状态中上颈髓凋亡细胞、Bcl-2和Bax阳性细胞数百分比及胞质和胞膜PKC活性变化 (n=8,x ±s)
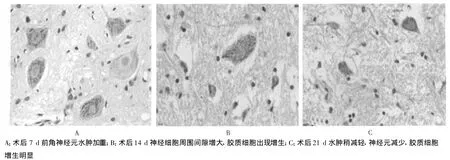
图1 不同时间点上颈髓水肿程度(HE,×400)

图2 术后7 d光镜下细胞改变(×400)
3 讨 论
凡与细胞增殖有关的原癌基因及抑癌基因都参与了对细胞凋亡的调控。研究较多的主要有 Bcl-2、c-myc、p53、fas/apo-1等。Bcl-2家族包括抑制凋亡的Bcl-2、Bcl-XL、Bcl-1、Bcl-X和促进凋亡的 Bax、Bak、Bcl-xs、Bik等,其中,Bcl-2是细胞凋亡的抑制基因,具有保护神经细胞抵抗多种损伤和抑制细胞凋亡的作用。Bax是与 Bcl-2密切相关但功能相反的一组基因,它与Bcl-2以同源或异源二聚体形式发挥作用,参与细胞凋亡的进程。本实验提示机体试图上调靶基因Bcl-2抑制凋亡发生,但随着病情进展,结果是Bcl-2上调能力有限,反而促进细胞凋亡的Bax表达大大增加,明显高于Bcl-2,最终导致细胞凋亡。
本研究结果还发现,胞膜PKC活性于术后第1天开始增高,第7~14天达到最高点,21 d有所回落,胞质PKC活性则出现相反变化趋势,即PKC出现了转位激活。众所周知,PKC激活主要由第二信使二酰基甘油(DG)、磷脂酶D(PLD)和磷脂酶A2(PLA2)完成,其中前者对PKC激活是短暂的,而后两者对PKC的激活是持续性的。因此推测脊髓空洞前状态脊髓组织的PKC激活可能是由于Kaolin注入枕大池后,直接压迫或(和)其导致的无菌性蛛网膜炎累及脊髓前后动脉、静脉,造成脊髓缺血、水肿、生物膜去极化:①引起多种神经递质如兴奋性氨基酸、乙酰胆碱的释放,这些递质与其相应的受体作用通过G蛋白介导机制,激活磷脂酶C(PLC),从而使DG增加,DG直接激活PKC,而 PKC的激活反过来又可激活 PLA2和 PLD,而PLA2和 PLD又参与 PKC持续激活,形成恶性循环〔7〕;②脊髓损伤后细胞内Ca2+积聚可激活PLA2和 PLD,参与PKC持续激活,后者还促使细胞外 Ca2+内流,进一步激活PKC。
PKC是一种广泛分布于哺乳动物真核细胞的钙/磷依赖性激酶,在静息状态下以无活性形式存在于胞质中,激活后转位于细胞膜,通过磷酸化作用,在信号传导过程中充当第二信使,具有促进神经递质释放、突触塑形、细胞增生、基因表达等作用。近年来,它在细胞凋亡中的作用日益突出。本研究提示PKC活化引起了一系列下游事件,可能通过信号转导过程而调节Bcl-2和Bax表达,参与了脊髓空洞前状态神经细胞的凋亡。Sitailo〔8〕在人类角化细胞的研究中证实PKC转位激活能够增加Bax表达,导致细胞凋亡。李云峰〔9〕在脑缺血再灌注模型中发现随着PKC活性持续增加,Bcl-2表达也增高,提示了机体的抗凋亡作用。PKC是一种磷酸化蛋白,BCl-2一级结构有7个丝氨酸残基,PKC可使之磷酸化,从而活化Bcl-2,使之发挥抑制凋亡的作用。然而,PKC作为第二信使和第三信使之间的桥梁,还可以通过核因子-κB将胞质的信号传入核内,从而促进Bax的表达,促使细胞凋亡。总之,在实验性脊髓空洞前状态发病过程中,由于PKC的转位激活,通过直接或间接途径,上调Bcl-2和Bax表达,但 Bax表达显著高于 Bcl-2,导致了神经细胞的凋亡。
1 孙国柱,张庆俊,李建峰,等.实验性脊髓空洞前状态病理学演变和意义〔J〕.中华实验外科杂志,2006;23(12):1444-6.
2 Sgado P,Alberi L,Gherbassi D.Slow progressive degeneration of nigral dopaminergic neurons in postnatal Engrailed mutant mice〔J〕.Proc Natl Acad Sci U S A,2006;103(41):15242-7.
3 Nakaya K,Hasegawa T,Flickinger JC,et al.Sensitivity to radiation-induced apoptosis and neuron loss declines rapidly in the postnatal mouse neocortex〔J〕.Int J Radiat Biol,2005;81(7):545-54.
4 孙国柱,张庆俊,张更申.实验性脊髓空洞前状态神经元凋亡及 NF-κB,Bcl-2和Bax的调控作用〔J〕.第四军医大学学报,2006;27(5):416-9.
5 Bright R,Mochly-Rosen D.The role of protein kinase Cin cerebral ischemic and reperfusion injury〔J〕.Stroke,2005;36(12):2781-90.
6 张庆俊,孙国柱,张更申.实验性家兔脊髓空洞症发病机制研究〔J〕.中华神经外科杂志,2000;16(6):364-6.
7 陈康宁,董为伟 .蛋白激酶C和脑缺血损害〔J〕.国外医学·内科学分册,1996;23(4):164-7.
8 Sitailo LA,Tibudan SS,Denning MF.Bax activation and induction of apoptosis in human keratinocytes by the protein kinase Cdelta catalytic domain〔J〕.J Invest Dermatol,2004;123(3):434-43.
9 李云峰,陈康宁,郑彩梅.大鼠脑缺血再灌注与蛋白激酶C活性变化及FOS、BCL-2的表达〔J〕.临床神经病学杂志,2000;13(1):3-6.

