vasostatin 在毕赤酵母中的表达及其抗血管生成的研究
林玉丽,华子春
(南京大学医药生物技术国家重点实验室,江苏南京 210093)
血管新生是实体肿瘤所必需的,对肿瘤的生长和增殖具有重要作用[1]。抗血管形成以肿瘤组织内部快速生长发展的微血管系统为靶点,由于血管内皮细胞在遗传上更加稳定,大量长时间给药情况下不易产生耐药性,因此抗血管形成治疗已成为极有前景的癌症治疗方法[2-3]。已有的实验证明,血管生成抑制剂如endostatin[4]、angiostatin[5]、vasostatin[6]和 tumstatin[7]能靶向抑制血管内皮细胞增殖,进而阻止肿瘤生长。
vasostatin为钙网蛋白calreticulin N端1-180氨基酸的结构域,是一种血管生成抑制剂,研究表明其在动物模型体内具有抗淋巴瘤效果[6]。它能特异地抑制bFGF诱导的血管内皮细胞增殖、抑制新生血管生成,能够阻止或减慢实验性肿瘤的生长[8]。大量实验证明,它是一种具有潜在药用价值的短肽[6,8-9]。vasostatin蛋白目前主要通过原核表达系统获得,由于它在大肠杆菌中表达时易形成无生物活性的、不溶性的包涵体产物,因而成为其基因工程生产的瓶颈环节[10-12]。本研究将vasostatin基因克隆在酵母诱导型表达载体pPIC9K中,在毕赤酵母中进行高效表达,并对表达产物进行分离纯化,对其抑制血管生成活性进行了初步鉴定。
1 材料与方法
1.1 材料
PET28a(+)质粒、大肠杆菌 E.coli Top10、A549细胞(本实验室保存),毕赤酵母菌株KM17、酵母诱导型表达质粒 pPIC9K(Invitrogen公司,Life science),PCR试剂、XhoⅠ、NotⅠ、SacⅠ、Taq DNA Polymerase、T4 DNA Ligase、Pyrobest DNA 聚合酶(TaKaRa 公司)。柱离心式质粒小提试剂盒、柱离心式胶回收小提试剂盒(上海申能博彩公司),Western Blotting化学发光试剂盒(PE公司),羊抗人calreticulin多抗、CD31多抗(Santa Cruz公司),MTT(Sigma公司),Agarose(GENE公司),DEAESepharose Fast Flow(GE公司),Tryptone、Yeast Extract、SDS、Tris、丙稀酰胺、亚甲叉丙稀酰胺(上海生工生物工程技术服务有限公司)。大肠杆菌用半盐LB培养基培养,酵母的培养筛选用YPD、MD、BMGY、BMMY 培养基,其配方见 Invirogen公司操作手册。
1.2 实验方法
1.2.1 毕赤酵母表达载体pPIC9K-vasostatin的构建
以原核表达载体pPET28a-vasostatin为模版,PCR扩增得到基因片段,所用的上下游引物分别为5'-CCGCTCGAGAAAAGAATGAGCAATGAACTTCATCAAGTTCC-3'和5'-CGGCGGCCGCTCATTAGTTGTCTGGACGAATCAG-3',在上游引物中有XhoⅠ酶切位点(斜体下划线),下游引物中有NotⅠ的酶切位点(斜体下划线)。PCR反应条件为:94℃热变性30 s,56℃退火30 s,72℃延伸30 s,共进行28个循环。纯化的PCR产物进行XhoⅠ和NotⅠ双酶切,然后插入酵母诱导型表达载体pPIC9K的多克隆位点。连接产物转化Top10感受态细胞,涂布于含有Amp+抗生素的半盐LB平板上,37℃倒置培养12 h。PCR筛选阳性克隆,酶切鉴定,使用pPIC9K上的引物进行测序验证,分析其阅读框和编码序列的正确性。
1.2.2 重组质粒转化毕赤酵母并鉴定重组子(电转化法转化P.pastoris) 制备酵母感受态、pPIC9K以及pPIC9K-vasostatin,取 20 μg(1 μg·μl-1)质粒用 Sac Ⅰ酶切线性化,将5~20 μg的线性化DNA溶解在10 μl TE溶液中,与 80 μl的上述所得菌体混匀,转至0.2 cm冰预冷的电转化杯中,将电转化杯冰浴5 min,按照优化的参数(电压 1.5 kV,电容 25 μF,电阻200 Ω,电击时间4.00 ms)电击完毕后,加入1 ml冰预冷的山梨醇溶液将菌体混匀,转至1.5 ml的EP管中,将菌体重悬液涂布 MD平板上,24 h后将菌体用300 μl DDW 重悬涂布于 200 μg·ml-1G418 抗性平板上,每200 μl涂布一块平板。平板上的菌落长到肉眼可见,在超净台用牙签挑取菌落,以1 μl菌液为模版,以基因上游引物和3'AOX1引物为引物,进行PCR鉴定阳性克隆,阳性克隆PCR产物大小理论为280 bp,鉴定所得阳性克隆保种备用。
1.2.3 蛋白表达筛选 Pichia pastoris KM17高表达外源蛋白菌株 先将4℃保存的酵母转化子pPIC9K-vasostatin接种于YPD平板上,28℃培养2 d进行活化;然后接种在25 ml BMGY培养液中,28℃ 250 r·min-1培养18 ~20 h,摇瓶至 OD600nm为2 ~6,室温下以4 000 r·min-1离心,弃去上清液后,用 BMMY 培养液重悬沉淀酵母转化子细胞至OD为1,在28℃ 250 r·min-1条件下培养,诱导外源蛋白表达,72 h后取1 ml培养液,每隔24 h补加5%(体积分数)甲醇至终含量为0.5%。取出的培养液 4 000 r·min-1离心 5 min,将发酵液用三氯乙酸(TCA)浓缩,进行十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳,检测外源蛋白的表达情况,用Western blotting鉴定蛋白。
1.2.4 vasostatin在毕赤酵母中的表达以及纯化 按以上蛋白表达条件扩大培养,将3 ml过夜菌用25 ml YPD 活化转接 400 ml BMGY,30 ℃ 300 r·min-1达条件扩培养,甲醇诱导 72 h 后,4 ℃,5 000 r·min-1离心15 min,上清液立即加入 1 mmol·L-1EDTA,防止蛋白酶的作用,将表达上清用75%硫酸铵沉淀浓缩,12 000 r·min-1离心 30 min 取沉淀,沉淀溶于 50 ~100 ml平衡盐缓冲液中,在透析液(20 mmol·L-1Tris-HCl,1 mmol·L-1EDTANa2,pH 8.0)中 4 ℃透析过夜;透析样品离心去少量沉淀,DEAE-Sepharose Fast Flow层析(柱参数:柱高 5 cm,直径 1 cm,流速 1 ml·min-1);用柱平衡液(20 mmol·L-1Tris-HCl,2 mmol·L-1EDTANa2,pH 8.0)平衡,150 mmol·L-1NaCl洗脱目的蛋白。将收集液进行18%SDS-PAGE电泳检验。
1.2.5 鸡胚尿囊膜血管生成抑制实验(chorioallantoic membrane assay,CAM实验) 为了确认vasostatin具有对新血管生成的抑制作用,我们进行鸡胚尿囊膜血管生成抑制实验。取7 d龄受精鸡卵,在照卵灯下寻找胚头右下方血管稀少区,划定1 cm×1 cm开窗位置,在鸡胚气室端钻1 mm小孔并穿透壳膜;用75%乙醇消毒开窗部位,用手术剪揭去蛋壳及壳膜暴露出鸡胚尿囊膜,将甲基纤维素膜放置于尿囊膜上血管较少的部位,用微量进样器将20 μl待测蛋白滴入甲基纤维素膜中,阴性对照组用等体积无菌PBS溶液;用无菌透明胶带封窗后放入孵化箱,37℃继续孵化;48 h后揭去透明胶带,加入2 ml甲醇、丙酮等体积混合固定液,在室温下固定15 min;待绒毛尿囊膜血管中的血液凝固后,以纤维素小碟为中心剪下直径约3 cm的尿囊膜,放入盛有水的平皿内展开,然后平铺悬浮于PBS中,观察给药区血管形成情况并拍照,无血管区域内径≥8 mm的实验结果确定为阳性。
2 结 果
2.1 毕赤酵母表达载体pPIC9K-vasostatin的构建
vasostatin基因经过PCR扩增、酶切,然后与经过酶切的毕赤酵母表达载体pPIC9K连接、转化大肠杆菌,经过PCR扩增、酶切鉴定筛选获得毕赤酵母表达载体 pPIC9K-vasostatin(图1)。pPIC9K-vasostatin质粒经DNA序列分析证明,vasostatin基因片段与信号肽编码基因阅读框保持一致。
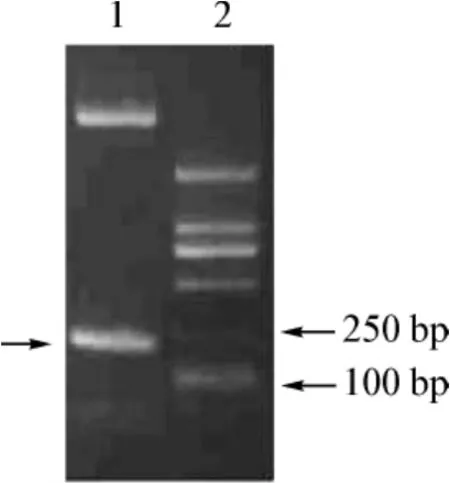
图1 pPIC9K-vasostatin酶切分析Fig 1 Analysis of recombinant plasmid pPIC9K-vasostatin
2.2 Pichia pastoris阳性重组子的PCR筛选
pPIC9K-vasostatin质粒经线性化、电转化Pichia pastoris KM17,在筛选培养基上获得阳性克隆。阳性克隆经PCR扩增进行进一步鉴定,PCR产物理论大小为280 bp,箭头所示为阳性条带(图2)。
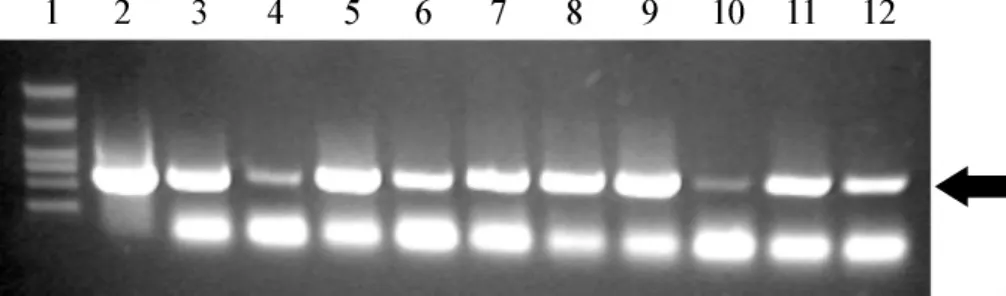
图2 PCR鉴定不同的酵母KM17 pPIC9K-vasostatin重组子Fig 2 PCR identification of transformed yeast KM17 pPIC9K-vasostatin
2.3 表达筛选阳性菌株
将这些阳性克隆转接25 ml BMMY培养基中,28℃诱导表达72 h,表达上清用三氯乙酸沉淀法浓缩30倍后,18%SDS-PAGE电泳检测表达上清中目的蛋白表达情况(图3)。表达产物确实以分泌形式表达于培养上清中。挑取表达量较高的菌株进行进一步表达和纯化,并作为工程菌保存。
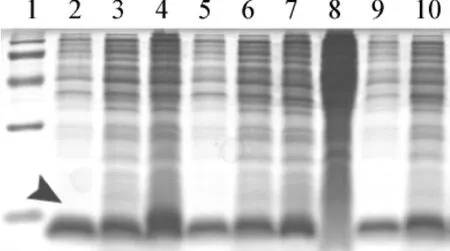
图3 SDS-PAGE分析不同的酵母KM17重组vasostatin片段培养基上清中的蛋白Fig 3 Screening of vasostatin expression strain from the culture supernatant of transformed yeast KM17 containing integrated vasostatin gene by SDS-PAGE
2.4 vasostatin的表达及纯化
筛选出的阳性单克隆接种YPD培养基培养活化后,转接BMGY培养基中,0.5%的甲醇诱导,72 h后将表达上清用75%硫酸铵沉淀进行浓缩,对浓缩后的产物用DEAE-Sepharose Fast Flow进行层析,纯化产物的相对分子质量为6 000,纯度经软件分析约为90%(图4)。

图4 SDS-PAGE分析纯化后的重组vasostatinFig 4 SDS-PAGE analysis of purified recombinant vasostatin protein
2.5 鸡胚尿囊膜血管生成抑制实验
在鸡胚尿囊膜血管生成抑制实验中,0.5 μg vasostatin可以显著抑制鸡胚尿囊膜新血管的生成(图5),并呈剂量依赖性。
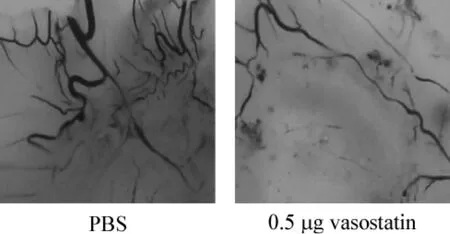
图5 vasostatin抑制鸡胚新血管生成Fig 5 Inhibitory effect of vasostatin on angiogenesis in chick CAM
3 讨 论
vasostatin作为一种抗血管生成药物,具有较好的应用前景;但是,其在大肠杆菌中表达时表达产物多为无生物活性的包涵体,包涵体表达产物需要通过复性才能具有抗新血管生成活性,复性难度大、工艺复杂,从而增加了表达纯化工艺的复杂程度[10]。本实验室在前期研究[11-12]中分别通过将 vasostatin 与 GST 或His-tag融合,然后在多个分子伴侣共表达和低温表达下才成功部分避免了包涵体产物的形成,获得了可溶性的vasostatin融合表达产物,融合表达产物再经过产物后加工、去除融合标签及分离纯化后,获得了vasostatin目标产物。生产过程复杂、得率不高,更重要的是生物活性不高。因此,如何重组表达具有高生物活性的vasostatin,仍然是vasostatin研究及应用中的一个瓶颈。
本研究中,我们尝试选择了毕赤酵母作为表达系统[13]。该表达系统具有许多优点:酵母营养要求低,细胞生长快,可高密度发酵培养;同时又具有强启动子,可以实现外源蛋白的高表达。该系统的载体与酵母转化受体菌的核基因组进行同源重组,构建的菌株稳定,外源基因一般不会丢失;同时该系统还具有高分泌、正确翻译和翻译后加工修饰的能力,如乙酞化糖基化修饰等[14]。我们在毕赤酵母中实现了vasostatin蛋白的诱导型胞外分泌表达。表达产物经两步简单的分离纯化,即可获得目标蛋白,其表达产量为12 mg·L-1,鸡胚尿囊膜血管生成抑制实验显示毕赤酵母表达的vasostatin蛋白具有很好的生物学活性,这为该蛋白的进一步研究以及临床应用奠定了基础。
[1]PANDYA M N,DHALLAN S,SANTANTANI D D.Angiogenesis—a new target for future therapy[J].Vascul Pharmacol,2006,44(5):265-274.
[2]FOLKMAN J.Angiogenesis medicine[M]//BRAUWALD E.Harrison's textbook of internal medicine.15th ed.New York:McGraw-Hill,2001:517-530.
[3]HANAHAN D,FOLKMAN J.The hallmarks of cancer[J].Cell,2000,100:57-70.
[4]O'REILLY M S,BOEHM T,SHING Y,et al.Endostatin:an endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88:277-285.
[5]O'REILLY M S,HOLMGREN L,SHING Y,et al.Angiostatin:a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma[J].Cell,1994,79:315-328.
[6]PIKE S E,YAO L,JONES K D,et al.vasostatin,a calreticμlin fragment,inhibits angiogenesis and suppresses tumor growth[J].J Exp Med,1998,188:2349-2356.
[7]MAESHIMA Y,SUDHAKAR A,LIVELY J C,et al.Tumstatin,an endothelial cell-specific inhibitor of protein synthesis[J].Science,2002,295:140-143.
[8]PIKE S E,YAO L,SETSUDA J,et al.Calreticulin and calreticulin fragments are endothelial cell inhibitors that suppress tumor growth[J].Blood,1999,94:2461-2468.
[9]YAO L,PIKE S E,STEFANIA J,et al.Anti-tumor activities of the angiogenesis inhibitors interferon-inducibleprotein-10 and the calreticulin fragment vasostatin[J].Cancer Immunol Immunother,2002,51:358-366.
[10]徐倩,孙启明,华子春.人血管内皮抑制素vasostatin120-180在大肠杆菌中的表达纯化及初步的抗血管生成活性研究[J].东南大学学报:医学版,2008,27(2):75-80.
[11]SUN Q M,CHEN L L,CAO L,et al.An improved strategy for high-level production of human vasostatin120-180[J].Biotechnol Prog,2005,21(4):1048-1052.
[12]SUN Q M,CAO L,FANG L,et al.Expression,purification of human vasostatin120-180 inEscherichia coli,and its antiangiogenic characterization[J].Protein Expression Purif,2005,39(2):288-295.
[13]CEREGHINO J L,CREGG J M.Heterologous protein expression in themethylotrophic yeastPichiapastoris[J].FEMS Microbiol Rev,2000,24(1):45-661.
[14]路蓉,安云庆.巴斯德毕赤酵母表达系统及其分泌型蛋白表达的研究进展[J].临床和实验医学杂志,2004,3(1):43-47.
东南大学学报(医学版)2011年5期
