高效液相色谱质谱联用法测定泪液葡萄糖浓度
汤佳莹,栾洁
(东南大学附属中大医院眼科,江苏南京 210009)
以泪液葡萄糖浓度作为一种反映糖尿病患者血糖变化情况的指标的可能性在近年受到关注[1],与传统的血样本相比,这一非刺激性监测方法有助于实时了解血糖情况,并且可减少消耗品的浪费、降低交叉感染的风险和减轻患者的痛苦。目前国内泪糖研究的相关报道较少,通常采用传统的葡萄糖氧化酶法[2-3],需要的泪液样本量较大、检测灵敏度亦较低。本研究采用高效液相色谱质谱联用(HPLC-MS)法测定泪液中的葡萄糖浓度,为泪糖浓度与血糖浓度相关性的研究提供依据。
1 仪器与试剂
1.1 仪器
Waters Quattro Micro三重四级杆质谱仪(电喷雾离子化接口),Waters 2695液相色谱仪(沃特斯中国有限公司),含在线真空脱气机、四元梯度泵、恒温自动进样器、柱温箱。工作站:Masslynx数据分析系统。
高速离心机(1612-1,上海医疗器械有限公司),混匀器(MS-3,IKA 公司),20 μl一次性微量采血管(南京晚晴化玻仪器公司),200 μl塑料离心管(南京赛研生物技术有限公司),电子天平(XS105DU,Mettler-Toledo公司),刻度吸管,定容瓶,Eppendorf移液器及对应吸头。
1.2 药品与试剂
D-无水葡萄糖(纯度98%,批号:110833-200503,中国药品生物制品检定所),6,6-脱氧D-葡萄糖(内标)(批号:282650,ISOTEC),乙腈(色谱纯,Tedia Company),甲酸(分析纯,国药集团化学试剂有限公司),0.9%生理盐水(南京小营药业有限公司),娃哈哈纯净水。
1.3 标本来源
正常对照组为经本院眼科门诊检查无外眼疾病、血糖正常及无有关血糖影响因素的健康人,共28例,28只眼。其中男15例,女13例。年龄24~78岁,平均(58.04±13.71)岁。糖尿病组是经本院内分泌科确诊为2型糖尿病的病人,无外眼疾病,共75例,75只眼。其中男35例,女40例。年龄38~83岁,平均(63.89 ±11.60)岁。
2 方法与结果
2.1 色谱条件
色谱柱为Waters Xbridge Amind柱(2.1 mm×100 mm,3.5 μm),流动相为 0.1%甲酸水-乙腈(15∶85),流速0.2 ml·min-1,进样量 20 μl,柱温 20 ℃。
2.2 质谱条件
检测方式:选择离子检测;离子极性:正离子;离子化方式:电喷雾离子化(ESI);检测对象:D-葡萄糖[M+Na]+m/z 203.1、6,6-脱氧 D-葡萄糖[M+Na]+m/z 205.1;毛细管电压 3.0 kV;锥孔电压 30 V;源温度:120℃;脱溶剂区温度:350℃;雾化气流速:400 L·h-1;气帘气流速:50 L·h-1。
2.3 样本的收集与保存
随机选择受检者的左眼或右眼为泪液样本采集眼,以20 μl一次性微量采血管置于受检眼外眦的泪膜处,收集泪液20 μl。收集过程中避免受检者揉拭眼睛并尽量避免接触和刺激结膜。收集所得泪液置于200 μl塑料离心管中密封,并立即保存于-20℃冷冻箱中待检测。
2.4 样品的预处理
待泪液标本在常温下解冻后,取泪液20 μl,分别加入 2 mg·ml-16,6-脱氧 D-葡萄糖溶液 10 μl和乙腈70 μl,在混匀器上以 2 000 r·min-1的速度混匀 3 min后,高速离心(10 000 r·min-1,10 min)取上清 20 μl进样。
2.5 泪样标准曲线样品的配置
用0.9%生理盐水作为空白对照配制标准曲线样品。精密称取D-葡萄糖对照品10 mg置于10.00 ml容量瓶中,流动相溶解并定容,摇匀,即得1.00 mg·ml-1D-葡萄糖贮备液。移取 D-葡萄糖贮备液5.00 ml,以0.9%生理盐水稀释成质量浓度分别为5、20、37.5、75、100 μg·ml-1的系列样品,按“2.4”项下条件处理分析。
2.6 质谱分析
D-葡萄糖和6,6-脱氧D-葡萄糖在本实验ESI离子化方式下,主要生成[M+Na]+离子峰,分别为m/z 203.1和m/z 205.1,将其作为定量分析时检测的产物离子,见图1。
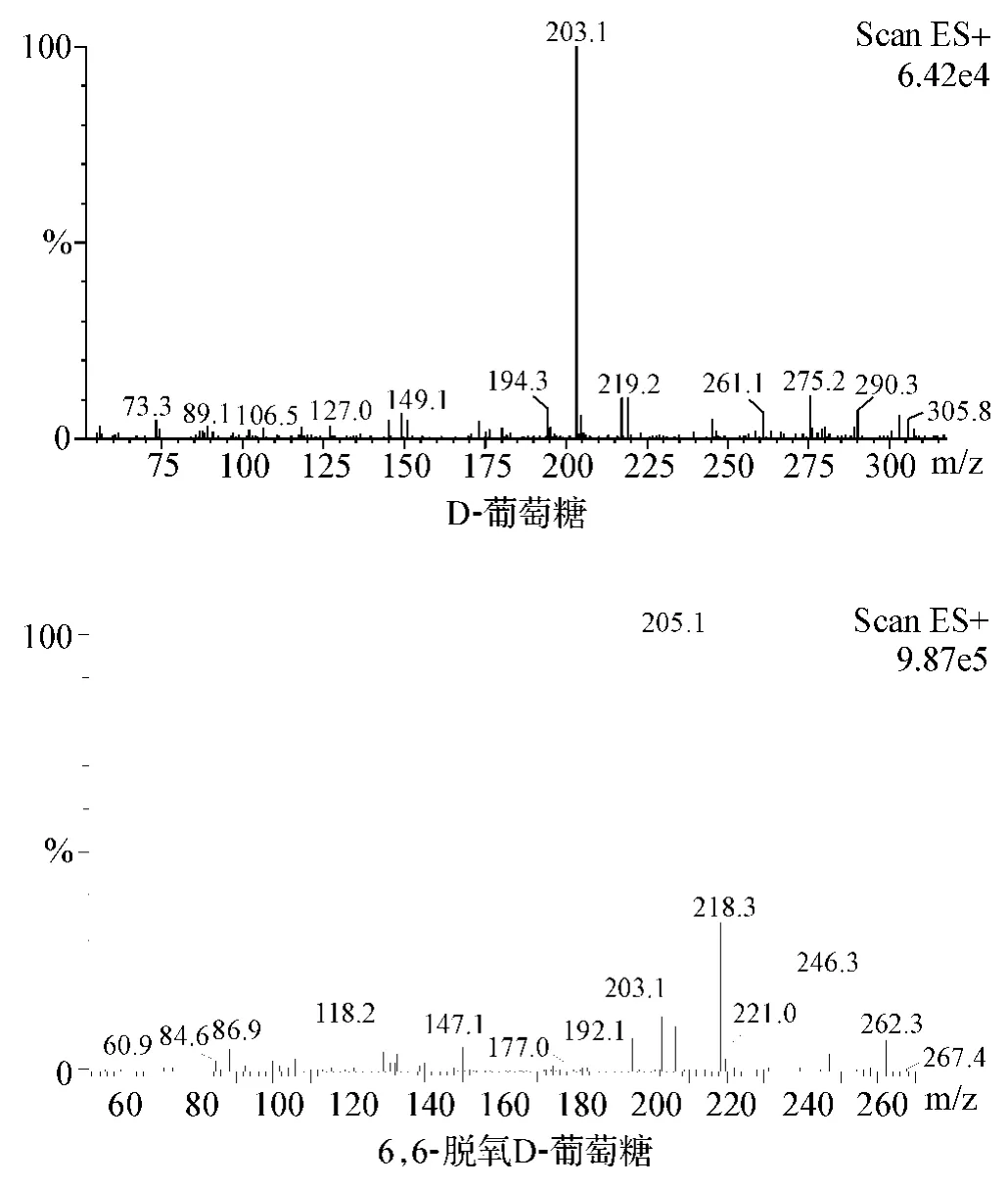
图1 离子扫描质谱图
2.7 系统适用性测定
精取 75 μg·ml-1D-葡萄糖 20 μl及 2 mg·ml-16,6-脱氧D-葡萄糖10 μl配成标准混合液。在本实验所采用的色谱条件下,D-葡萄糖和6,6-脱氧D-葡萄糖的保留时间分别为4.86 min和4.87 min,各色谱峰峰形良好。以流动相为空白对照,在本实验所采用的色谱条件下,空白对杂质的测定无干扰。见图2。
2.8 标准曲线的绘制
以 D-葡萄糖的质量浓度(ρ,μg·ml-1)为横坐标,以D-葡萄糖色谱峰面积(As)与6,6-脱氧D-葡萄糖色谱峰面积(Ar)比值为纵坐标进行回归分析,求得直线回归方程为 As/Ar=0.001 1 ρ+0.056 4(R2=0.998 2)。结果表明,D-葡萄糖质量浓度在 5 ~200 mg·ml-1范围内线性关系良好,定量下限为5 mg·ml-1。
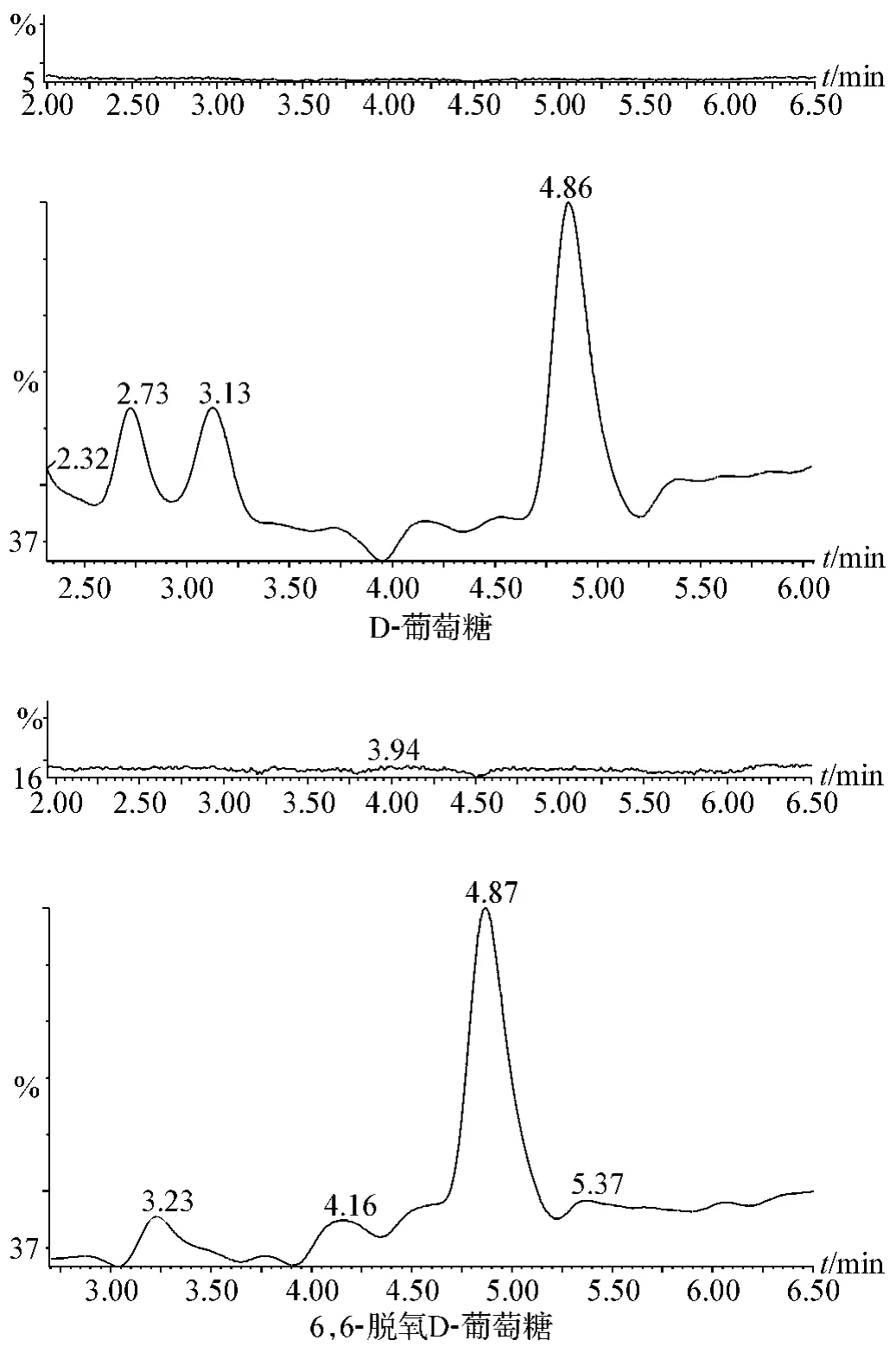
图2 系统适用性色谱分析图(各自上图为空白对照)
2.9 重现性实验
精取 75 μg·ml-1D-葡萄糖 20 μl及 2 mg·ml-16,6-脱氧 D-葡萄糖10 μl配成标准混合液,平行配置6份,测量D-葡萄糖色谱峰面积(As)与6,6-脱氧 D-葡萄糖色谱峰面积(Ar)的比值,考察其重现性。6份标本的 As/Ar分别为 0.120、0.119、0.121、0.122、0.120、0.122,平均相对标准偏差为 1.0%。结果显示,本实验条件重现性良好。
2.10 定量限
按信号/噪声(S/N)=10计算,得本法定量限为5 μg·ml-1,即在本实验条件下,且确保规定的准确度前提下,仪器所能检测到的泪液样本中的葡萄糖的最低质量浓度为 5 μg·ml-1。见图 3。
2.11 回收率实验
在生理盐水中精密加入D-葡萄糖标准工作贮备液适量,配制成D-葡萄糖质量浓度分别为100、120和150 μg·ml-1溶液,分别精密加入一定量 6,6-脱氧D-葡萄糖,测定D-葡萄糖As和Ar。每一浓度进行3个样本分析,与标准曲线同时测定,考察样品的回收率。结果见表1。在以上3种浓度下,D-葡萄糖的回收率分别为99.97%、96.30%和95.30%,符合回收率范围应控制在 80% ~120%(样品浓度 <200 μg·ml-1)的要求;相对标准偏差为2.88%,符合其应低于10%的要求。
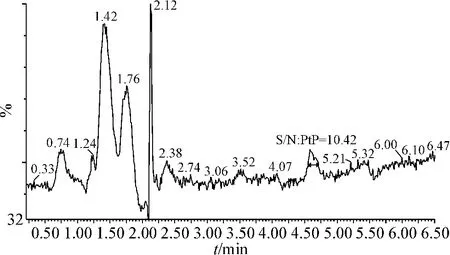
图3 定量限色谱图
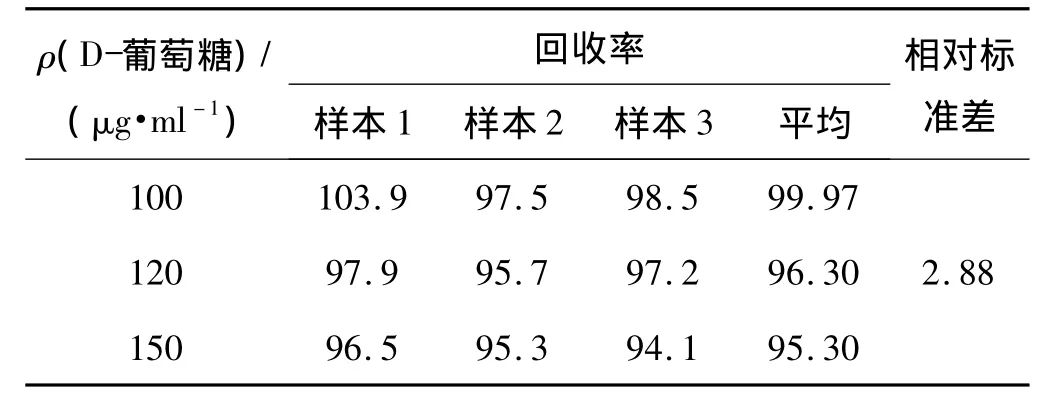
表1 不同质量浓度D-葡萄糖的回收率 %
2.12 方法应用
在本实验条件下,28例正常对照组泪糖浓度为(0.081 ± 0.027)mmol·L-1[(0.040 ~ 0.150)mmol·L-1],75 例糖尿病组泪糖浓度为(0.460 ± 0.204)mmol·L-1[(0.166 ~1.136)mmol·L-1],两者差异有统计学意义(t= -15.736,P <0.01)。
3 讨 论
泪液葡萄糖浓度的测定以往多采用葡萄糖氧化酶法,近年来其检测手段得到不断改进,目前根据国外文献报道,主要有HPLC-MS、HPLC-脉冲安培及ESI-MS等方法[4]。Taormina 等[5]报道,采用 ESI-MS、C18 柱处理样品。本研究初重复其方案发现出峰时间短(1.3 min)、色谱峰杂峰较多,经改进,采用 HPLC-MS、Xbridge Amind(Waters)(2.1 mm × 100 mm,3.5 μm)柱分析样品,出峰时间约为4.8 min,色谱峰峰型良好。
本实验方案中,20 μl样品中加入 10 μl 6,6-脱氧D-葡萄糖和70 μl乙腈混匀后再离心的处理,可完全萃取蛋白质以消除其对泪糖测定的干扰,同时亦可保证被6,6-脱氧D-葡萄糖和乙腈稀释后的样品中D-葡萄糖浓度仍在本实验方案的定量下限之上。
泪液是主要由泪腺分泌的一种水样液体,其主要成分为水和电解质[6]。由于在血糖正常人群的泪液样本中亦有少量葡萄糖存在[4],我们采用了0.9%生理盐水为空白对照,实验中证实其并不干扰D-葡萄糖和6,6-脱氧D-葡萄糖的测定。
与国内目前的泪糖检测方法相比,本实验所采用HPLC-MS的检测方法具有准确度和灵敏度高、重现性好的特点,定量下限可达5 mg·ml-1,并大大减少泪液样本需要量,可作为一种灵敏地分析泪液葡萄糖浓度的方法。
[1]LANE J D,KRUMHOLZ D M,SACK R A,et al.Tear glucose dynamics in diabetes mellitus[J].Curr Eye Res,2006,31(11):895-901.
[2]邱鸿士,蒋华震.泪液果糖胺含量的测定及临床意义[J].江南大学学报,2003,2(1):109-110.
[3]李桂荣,赵梅生,张美玉.泪液糖含量测定的临床意义探讨[J].白求恩医科大学学报,1996,22(4):375-376.
[4]BACA J T,FEINGOLD D N,ASHER S A.Tear glucose analysis for the noninvasive detection and monitoring of diabetes mellitus[J].Ocular Surface,2007,5(4):280-293.
[5]TAORMINA C R,BACA J T,DAVID N,et al.Analysis of tear glucose concentration with electrospray ionization mass spectrometry[J].J Am Soc Mass Spectrom,2007,18(2):332-336.
[6]阎慧.泪液的相关研究与进展[J].眼科研究,2009,27(7):633-636.
