两种骨髓间充质干细胞移植途径治疗急性心肌梗死的比较研究
黎叶飞,盛祖龙,姚玉宇,马根山,2
(1.东南大学医学院,江苏南京 210009;2.东南大学附属中大医院心血管内科,江苏 南京 210009)
急性心肌梗死是世界范围最主要致死性疾病之一[1]。然而,临床上对其行标准药物治疗及再灌注治疗的作用有限,梗死后心力衰竭的死亡率和致残率持续上升,大量的心肌细胞丢失是梗死后心衰的细胞学基础[2-3]。近年来研究者[4-6]认为,干细胞移植治疗似乎充满希望,其中骨髓间充质干细胞(BM-MSCs)是最早应用于动物实验和临床研究的细胞之一。BMMSCs能够分化为心肌细胞和血管细胞,最终修复受损心脏,改善心脏功能[7]。然而 Carr等[8]认为,干细胞治疗效果有限或无确切效果。这些结果的差异性可能与干细胞不同移植途径有关。本研究在建立小鼠心肌梗死模型基础上,分别心肌内和尾静脉移植体外扩增的BM-MSCs,观察不同移植途径对2周后小鼠心功能的影响,为临床治疗探求更为理想的干细胞移植途径。
1 材料与方法
1.1 BM-MSCs的分离与培养
取20~22 g清洁级雄性ICR小鼠(购于南京医科大学实验动物中心),脱颈椎处死后无菌条件下取股骨、胫骨,剪去两端骨骺,用含10%胎牛血清(Hyclone)的DMEM低糖培养基(Gibco公司,USA)冲冼骨髓腔,收集骨髓,离心10 min(1 000 r·min-1),去上清液,将骨髓细胞按2×105ml-1加全培接种于底面积为25 cm2的培养瓶,置于37℃、体积分数为0.05的 CO2、95%饱和湿度的培养箱中培养。48 h首次换液去除悬浮生长的细胞,以后每隔2~3 d换液1次,当细胞铺满瓶底时0.25%胰蛋白酶消化细胞传代,传至4代后干细胞已经比较纯净,制备成细胞浓度为5×107ml-1的悬液备用。
1.2 BM-MSCs的流式鉴定
4代BM-MSCs细胞分别加入抗Sca-1及CD45单抗(上海联科生物科技有限公司)、BSA后孵育30 min,洗涤后加FITC、PE标记的二抗、BSA后再孵育30 min,然后洗涤、离心、多聚甲醛固定,以表面标志含量鉴定细胞纯度。
1.3 心肌梗死动物模型的建立及干细胞移植
心肌梗死模型的建立参照文献[9]。清洁级ICR小鼠30只,体质量(24±1)g,以3.5%水合氯醛麻醉,24G静脉留置针气管插管连接呼吸机(频率170次·min-1、潮气量 300 μl;MiniVent,Harward Apparatus 公司,USA)机械通气;左胸3~4肋间切开暴露心脏,打开心包,在左心耳与肺动脉圆锥之间用8-0号丝线结扎前降支近端,逐层关胸,自然苏醒后撤除气管置管。实验前后进行心电图监测,结扎后观察到前壁心肌变白运动减弱、心电图ST段弓背向上抬高和异常Q波的小鼠(24 h后超声检测EF<40%)进入实验分组。造模成功的小鼠随机分为3组,每组10只。对照组(C):心肌梗死模型制备24 h后,经尾静脉注射20 μl PBS溶液;静脉移植组(IV组):心肌梗死模型制备24 h后,经尾静脉注射骨髓间质干细胞悬液20 μl(含1×106BM-MSCs);心肌内移植组(IM组):心肌梗死模型制备24 h后,再次麻醉及机械通气,开胸暴露心脏,于梗死周边区(心肌颜色苍白区周边)3-5点注射骨髓间充质干细胞悬液20 μl(共计1×106BM-MSCs)。
1.4 超声心动图检测心功能
2周后行经胸超声心动图检测心功能(Visualsonic vevo 770TMimaging system,Canada)。动物麻醉后置高频探头于胸骨旁乳头肌水平,测量左室舒张末期内径(LVIDD)、左室收缩末期内径(LVISD)、左室射血分数(LVEF),并计算左室短轴缩短率(LVFS)。
1.5 病理学检测
超声检测后脱颈椎处死动物,心腔内生理盐水灌注,离断心脏,送病理科行石蜡包埋、切片、Masson染色测梗死面积,梗死面积以胶原(蓝色)占整个左心室环周长百分比计算。
1.6 统计学处理
2 结 果
2.1 BM-MSCs的形态及鉴定
细胞培养至4代后形态单一,呈梭形、指纹样螺旋生长。流式细胞仪检测表型显示,Sca-1表达阳性,阳性比例高,而CD45基本阴性,符合BM-MSCs表型特征,表明培养的细胞传至4代时,基本都是BM-MSCs(图1)。
2.2 小鼠存活情况
2周结束时,对照组死亡2只,静脉移植组和心肌移植组各死亡1只,共26只小鼠进入数据分析。
2.3 评价心脏功能及梗死面积
2周后超声心动图心功能检测显示,与对照组和静脉移植组相比较,心肌内移植组心脏收缩功能(LVEF、LVFS)显著改善,心室腔(LVISD、LVIDD)扩大较轻;病理梗死面积检测显示,干细胞心肌内移植能够显著减少梗死面积。见表1、图2。
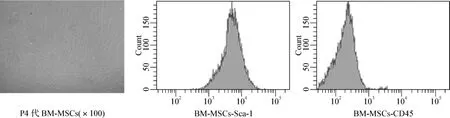
图1 小鼠骨髓间充质干细胞的形态与鉴定Fig 1 The morphology and identification of bone marrow mesenchymal stem cells
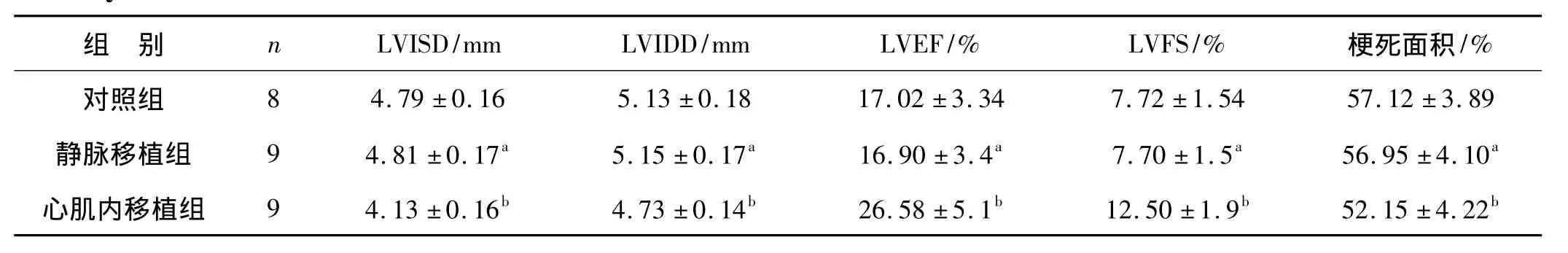
表1 3组超声心动图心功能检测结果及梗死面积比较Tab 1 ECHO parameters of LV cardiac function and infarct size among three groups 2 weeks after cell delivery
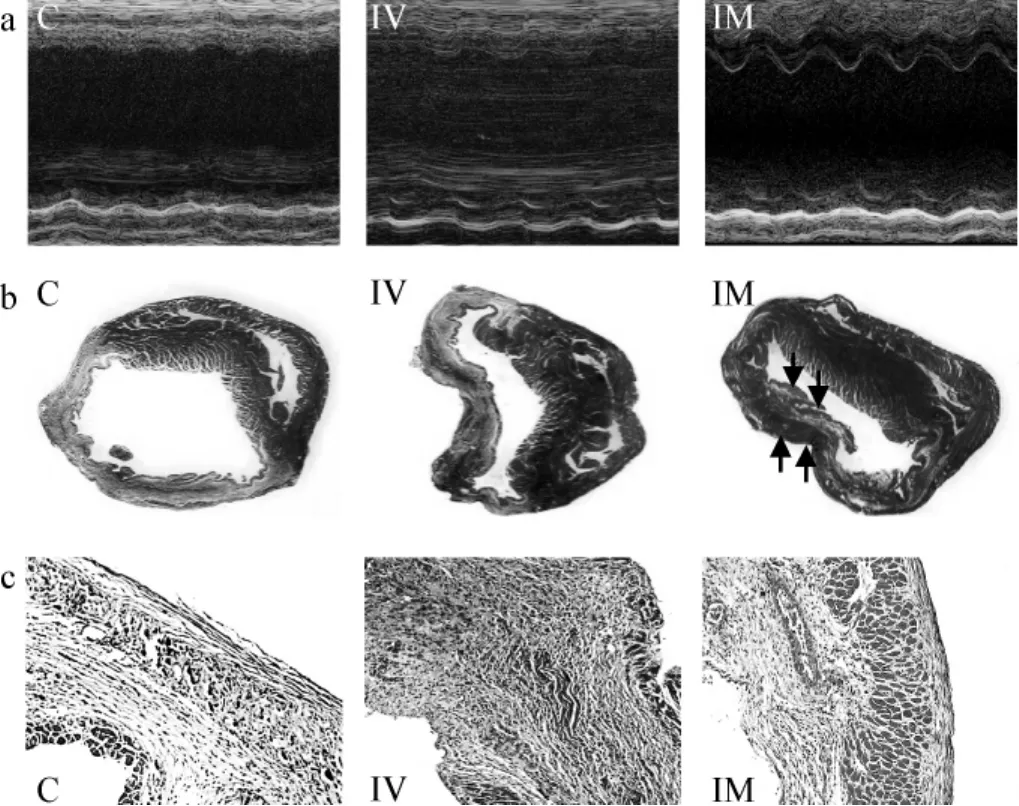
图2 2周后代表性的超声心动图和心肌组织Masson染色图片Fig 2 Measurements of cardiac function and observation of the infarcted myocardium 2 weeks after cell delivery
3 讨 论
心肌梗死后心力衰竭的致残率和病死率持续增长,使心肌梗死成为世界范围内的主要致死原因之一[10]。梗死后心肌细胞的丢失是梗死后心脏功能障碍和心力衰竭的细胞学基础,近年来使用干细胞治疗心肌梗死以期望促进心肌组织再生来修复受损心脏[11]。Wei等[12]认为,干细胞移植能够改善梗死后心脏收缩功能、抑制左室负性重构;然而另一些研究者[8,13-15]却认为,其改善效果有限,或仅有短期一过性改善,或无确切效果。这些研究结论不一致说明,目前关于移植用细胞的种类、数量,移植的时机、途径以及干细胞作用机制的研究远未结束,仍需进一步研究阐明。
我们假设这些研究结论的不一致可能与细胞移植方式有关。经静脉移植和直接心肌内移植是最为常见的用于小动物心肌梗死后的干细胞移植途径[16-17]。每一种移植方式不仅力求移植操作的简便,更为重要的是干细胞移植后的靶向归巢,在受损心肌中驻留、植入以及最终达到修复心脏功能的目的[18]。我们设计该实验比较两种移植方式对梗死后心功能的影响,为干细胞治疗心肌梗死探索更为优化的移植途径。
来源于骨髓的间充质干细胞具有分化为多种细胞系的潜能和诱导宿主免疫耐受的特质[19-20],也是应用于心肌梗死细胞治疗的最早、最常见的干细胞之一。因此,我们选择其作为本研究的实验用干细胞。研究结果显示,与静脉移植组相比,心肌内直接注射移植能够明显改善心脏的收缩功能、抑制心室结构的扩张重构,显著减小梗死面积。同时在病理切片中观察到,心肌内移植组梗死区内存在较多岛状存活心肌(图2箭头处)。有趣的是,我们还发现与对照组相比,静脉移植组未能改善心脏功能和缩小梗死面积(表1、图2)。
干细胞移植治疗的确切作用机制并不明确,我们的近期研究[21]显示,心肌梗死后移植内皮祖细胞似乎是通过旁分泌的功能发挥保护作用的。这些旁分泌因子作用于受体心脏的成熟细胞和原位祖细胞,诱导血管新生、抑制细胞凋亡从而达到缩小梗死面积、抑制心室重构、改善心肌收缩的作用[22-23]。另 Tsuji等[24]认为,间充质干细胞也可能通过转分化实现心肌细胞的再生,达到替代坏死心肌细胞效果。
从以上实验结果,我们可以谨慎得出结论:选择合理恰当的细胞移植途径可能在梗死后心脏干细胞治疗中起到重要的作用,直接心肌内移植优于静脉移植途径。我们认为,这可能与直接心肌内移植可以最大限度地保证干细胞的靶组织内植入、留滞有关;而经静脉移植大量细胞滞留于心外组织,特别是肺间质内[25],难以发挥其治疗性作用。
[1]WOLLERT K C,DREXLER H.Cell therapy for the treatment of coronaryheart disease:a critical appraisal[J].Nat Rev Cardiol,2010,7(4):204-215.
[2]CHARWAT S,GYÖNGYÖSI M,LANG L,et al.Role of adult bone marrow stem cells in the repair of ischemic myocardium:current state of the art[J].Exp Hematol,2008,36(6):672-680.
[3]祁春梅,武维恒,李莉,等.自体骨髓间充质干细胞移植治疗心肌梗死后心力衰竭的实验及临床研究[J].现代医学,2008,36(3):155-158.
[4] JANSSENS S,DUBOIS C,BOGAERT J,et al.Autologous bone marrow derived stem-cell transfer in patients with ST-segment elevation myocardial infarction:double-blind,randomised controlled trial[J].Lancet,2006,367(9505):113-121.
[5]刘孝钧,马根山,祁春梅,等.MRI评价自体骨髓间充质干细胞移植治疗AMI效果的实验研究[J].现代医学,2007,35(2):136-138.
[6]WANG T,TANGW,SUN S,et al.Intravenous infusion of bone marrow mesenchymal stem cells improves myocardial function in a rat model of myocardial ischemia[J].Crit Care Med,2007,35(11):2587-2593.
[7]LIECHTY K W,MACKENZIE T C,SHAABAN A F,et al.Human mesenchymal stem cells engraft and demonstrate sitespecific differentiation after in utero transplantation in sheep[J].Nat Med,2000,6(11):1282-1286.
[8]CARR C A,STUCKEY D J,TATTON L,et al.Bone marrow-derived stromal cells home to and remain in the infarcted rat heart but fail to improve function:anin vivocine-MRI study[J].Am J Physiol Heart Circ Physiol,2008,295(2):H533-542.
[9]YU L H,KIM M H,PARK T H,et al.Improvement of cardiac function and remodeling by transplanting adipose tissue-derived stromal cells into a mouse model of acute myocardial infarction[J].Int J Cardiol,2010,139(2):166-172.
[10]LASALA G P,MINGUELL J J.Bone marrow-derived stem/progenitor cells:their use in clinical studies for the treatment of myocardial infarction[J].Heart Lung Circ,2009,18(3):171-180.
[11]JAIN M,PFISTER O,ROGER J,et al.Mesenchymal stem cells in the infarcted heart[J].Coron Artery Dis,2005,16(2):93-97.
[12]WEI H M,WONG P,HSU L F,et al.Human bone marrowderived adult stem cells for post-myocardial infarction cardiac repair:current status and future directions[J].Singapore Med J,2009,50(10):935-942.
[13]LUNDE K,SOLHEIM S,AAKHUS S,et al.Intracoronary injection of mononuclear bone marrow cells in acute myocardial infarction[J].N Engl J Med,2006,355(12):1199-1209.
[14]PENICKA M,HORAK J,KOBYLKA P,et al.Intracoronary injection of autologous bone marrow-derived mononuclear cells in patients with large anterior acute myocardial infarction[J].J Am Coll Cardiol,2007,49(24):2373-2374.
[15]BEL A,MESSAS E,AGBULUT O,et al.Transplantation of autologous fresh bone marrow into infarcted myocardium:a word of caution[J].Circulation,2003,108(II):247-252.
[16]LI Q,TURDI S,THOMAS D P,et al.Intra-myocardial delivery of mesenchymal stem cells ameliorates left ventricular and cardiomyocyte contractile dysfunction following myocardial infarction[J].Toxicol Lett,2010,195(2-3):119-126.
[17]TANG Y L,ZHU W,CHENG M,et al.Hypoxic preconditioning enhances the benefit of cardiac progenitor cell therapy for treatment of myocardial infarction by inducing CXCR4 expression[J].Circ Res,2009,104(10):1209-1216.
[18]LAPAR D J,KRON I L,YANG Z.Stem cell therapy for ischemic heart disease:where are we?[J].Curr Opin Organ Transplant,2009,14(1):79-84.
[19]YAMAHARA K,NAGAYA N.Mesenchymal stem cells for the treatment of heart disease[J].Regenrative Med,2007,2(2):107-109.
[20]SCHULERI K H,BOYLE A J,HARE J M.Mesenchymal stem cells for cardiac regenerative therapy[J].HEP,2007,180:195-218.
[21]YAO Y,LI Y,MA G,et al.In vivomagnetic resonance imaging of injected endothelial progenitor cells after myocardial infarction in rats[J].Mol Imaging Bio,2011,13(2):303-313.
[22]CRISOSTOMO P R,WANG M,MARKEL T A,et al.Stem cell mechanisms and paracrine effects:potential in cardiac surgery[J].Shock,2007,28(4):375-383.
[23]NAKANISHI C,YAMAGISHI M,YAMAHARA K,et al.Activation of cardiac progenitor cells through paracrine effects of mesenchymal stem cells[J].Biochem Biophys Res Commun,2008,374(1):11-16.
[24]TSUJI H,MIYOSHI S,IKEGAMI Y,et al.Xenografted human amniotic membrane-derived mesenchymal stem cells are immunologically tolerated and transdifferentiated into cardiomyocytes[J].Circ Res,2010,106(10):1613-1623.
[25]AICHER A,BRENNER W,ZUHAYRA M,et al.Assessment of the tissue distribution of transplanted human endothelial progenitor cells by radioactive labeling[J].Circulation,2003,107(16):2134-2139.
东南大学学报(医学版)2011年5期
