CT/MRI 双模态造影剂的制备和表征
王月花,宋丽娜,丁佳丽,鲁珊珊,蒋燕妮,张宇,顾宁
(1.东南大学生物科学与医学工程学院,生物电学国家重点实验室,江苏省生物材料与器件重点实验室,江苏南京 210096;2.江苏省人民医院放射科,江苏 南京 210029)
纳米材料的出现给临床诊断和治疗带来了深远的影响,尤其是一些新型纳米型造影剂的出现有助于准确定位病灶,并进行分子水平的成像[1-3]。尽管很多学者认为,基于纳米平台的造影剂能够增强成像诊断效果,但是每种成像技术由于其自身的原因会有不同的缺点,在一些复杂的病情诊断中,单一的成像技术不能够提供足够的依据。因此,通过多模探针的设计,将不同成像技术的造影剂整合为一个整体,能够更好地发挥各种成像技术的优势,提高成像的特异性和敏感性。
CT是目前临床上常用的影像诊断方法,它是基于人体不同组织对X射线的吸收能力不同而发展起来的一种分辨率较高的成像技术。一些含碘的分子和化合物由于具有较高的X射线吸收系数,所以临床上将它们用作CT造影剂[4-6]。另一方面,MRI由于无电离辐射以及对软组织等具有非常优异的成像效果而被临床上用来进行疾病诊断[7-8]。目前,临床上使用的MRI造影剂主要有两种:一是作为T1造影剂的磁显葡胺(Gd-DTPA);二是作为T2造影剂的超顺磁性氧化铁纳米颗粒。其中,超顺磁性氧化铁纳米颗粒具有独特的磁学性质和较高的生物相容性,其作为MRI造影剂的研究很热门并已逐渐进入临床使用。
本实验借助纳米乳液合成技术,将油酸包裹的Fe3O4纳米颗粒分散到碘化油注射液中,使用表面活性剂并通过超声作用合成水包油型纳米乳液。表征结果说明,该乳液的水动力尺寸约为81.7 nm,具有较高的CT值和MRI弛豫率r2值,能够用于CT/MRI双模态造影。
1 材料与方法
1.1 材料
FeSO4·7H2O(国药集团化学试剂有限公司),FeCl3·6H2O(国药集团化学试剂有限公司),聚乙二醇(25)单硬脂酸酯(上海晶纯实业有限公司),油酸(上海凌峰化学试剂有限公司),氨水(上海凌峰化学试剂有限公司),Lipoid E-80(德国Lipoid公司),碘化油注射液(法国Guerbet公司)。
1.2 实验方法
1.2.1 油酸包裹的Fe3O4纳米颗粒的制备
称取 26 g FeCl3·6H2O、18 g FeSO4·7H2O 放入50 ml超纯水(通氮气30 min)中,超声溶解,全程通氮气保护。将得到的溶液倒入三颈瓶中70℃水浴加热并同时搅拌。快速注入30 ml氨水(浓度为25%),等待片刻后滴入5 ml油酸,维持70℃搅拌30 min,将温度升高到85℃,恒温搅拌1 h。然后用无水乙醇和超纯水进行磁分离洗涤数遍,最后将得到的沉淀溶解到正己烷中,放在4℃冰箱中保存。
1.2.2 CT/MRI双模态造影的水包油型纳米乳液的合成
取制备好的Fe3O4纳米颗粒正己烷溶液290 μl(约含90 mg Fe3O4纳米颗粒),加入0.5 ml碘化油注射液,用漩涡仪振荡使其混合均匀,然后再经超声波清洗器超声数分钟至充分混合。将该混合物离心10 min,去除不能与碘化油注射液充分混合的Fe3O4纳米颗粒,得到的混合物作为油相。
取 100 mg Lipoid E-80,加入 200 μl无水乙醇,超声溶解;称取180 mg聚乙二醇(25)单硬脂酸酯,溶解在装有20 ml超纯水的三颈瓶中,此作为水相。将三颈瓶放在电炉上加热至水相沸腾,然后逐滴加入溶解有Lipoid E-80的无水乙醇溶液,边滴边剧烈搅拌。等待5 min后,逐滴加入油相,继续搅拌30 min,形成初乳液,定容至10 ml。
将得到的初乳液用超声波破碎仪超声21 min,为防止仪器使用时间过长而造成损坏,超声分3次进行,每次持续7 min。最后得到透亮的乳液,放置在4℃冰箱中保存[9]。
1.2.3 表征
1.2.3.1 透射电镜(TEM)分析 对于乳液的TEM表征,通常在准备样品的时候会用电子染料染色乳滴后再进行TEM观察[8]。这里选用磷钨酸(PTA)对乳滴作染色处理,配制2%浓度的PTA水溶液,用NaOH溶液将其pH值调至6.3,选用混合染色法。具体方法为:100 μl乳液按1∶10的比例用超纯水稀释,充分混合后加入 40 μl PTA(2%,pH 为 6.3),等待 30 min。将铜网平放在垫有滤纸的培养皿中,用移液枪吸取样品垂直悬滴在铜网上,使样品能平铺在铜网上。盖好培养皿,待铜网自然干燥后用于TEM(JEM-200CX)观察。
1.2.3.2 动态光散射(DLS)分析 在室温下,将制备好的乳液用超纯水稀释(比例为1∶30)后,用动态激光散射仪(DLS,Zeta-Size 3000HS)测量其水动力尺寸。测量前样品放入样品池后须在仪器中稳定5 min左右。
1.2.3.3 水平磁场作用下乳滴的组装 为了验证乳滴内确实包封着Fe3O4纳米颗粒,我们将乳液放置在水平静磁场下观察乳滴受到静磁场作用后的排布情况,以期证明乳滴具有磁性。
[10],具体设计的方法为:将两块磁铁平行放置,中间用泡沫隔开,形成一个水平静磁场。把一块洗净的玻片放在磁铁中间,在玻片上滴一滴制备好的乳液,等待一段时间,用显微镜观察其磁场诱导组装后的形貌。
1.2.3.4 体外验证乳液的CT造影效果 移液器吸取乳液,等倍数稀释,分别装于5 ml洁净旋盖玻璃瓶中,并定容至3 ml,同时以纯水和碘化油注射液作为对照,各瓶中理论的碘含量为 0(水)、3、6、12、24、480 mg·ml-1(碘化油注射液)。将玻璃瓶固定在多功能试管架上,选择CT血管造影序列,设定管电压为130 kV,管电流为12 mA。
1.2.3.5 体外验证乳液的 MRI造影效果 采用1.5 T磁共振成像仪进行检测:移液器吸取乳液,等倍数稀释,分别装于5 ml洁净旋盖玻璃瓶中,并定容至5 ml,同时以等体积的超纯水作为对照,从而获得不同Fe浓度值的样品。各瓶铁质量浓度依次为12.4、6.20、3.10、1.55、0.78、0 μg·ml-1。选择成像条件进行扫描,可以获得不同浓度样品的T2弛豫时间。MRI测量条件如下:成像序列为SE序列,TR为2 500 ms,TE 为 22.0、44.0、66.0、88.0、110.0、132.0、154.0、176.0、198.0、220.0、242.0、264.0、286.0、308.0、330.0、352.0 s共 16 个回波序列,头颈部线圈,样品置于中心位置;感兴趣区域(ROI)为125像素,视野(FOV)25 cm ×25 cm,矩阵256×256,激励次数 1,层厚5 mm。
2 结果与分析
2.1 形貌和尺寸分析
TEM表征结果见图1。图1(a)中纳米颗粒的磁核尺寸约为10 nm;图1(b)中采用磷钨酸染色,乳滴大小为100 nm左右,由于染色的原因以及碘油的电子衬度较大,乳滴内的Fe3O4纳米颗粒不能明显观察出来。
DLS测得乳液的平均水动力尺寸为81.7 nm,从图2(a)可以看出乳滴的尺寸分布范围较窄,说明粒径分布较均一。从图2(b)可以看出乳液颜色较为透亮,与文献[11]中所论述的一样,当乳液的尺寸在20~200 nm时,乳液呈明显的透亮状态,乳滴的尺寸越小,浊度越低。
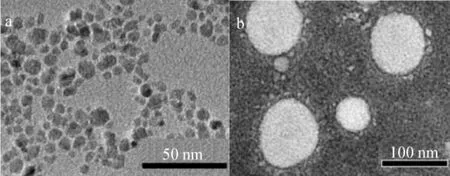
图1 TEM观察形貌Fig 1 TEM images
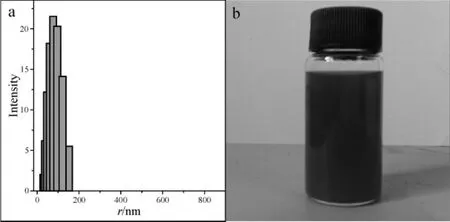
图2 乳液及其DLS检测结果Fig 2 Properties and shape of the nanoemulsion
2.2 水平静磁场作用下乳滴的组装效果
将水平磁场作用于乳液后,由于乳滴内包含有Fe3O4纳米颗粒,所以在磁场作用下乳滴由于受到磁场力的作用会沿着磁力线呈线状排列,这种排列随着时间的增加变得越来越明显(图3)。在没有磁场作用下(图4),乳滴会逐渐聚集到一起,最终形成一些杂乱无章的大聚集体。同时,比较两图可以发现磁场的作用可加速乳滴的运动,也就加快了乳滴之间的聚集,只是这种聚集会呈线状排列。乳滴在水平磁场作用下的组装效果说明了Fe3O4纳米颗粒包含在了碘化油注射液之内,验证了该材料符合了实验方案的设计初衷。
2.3 CT 造影效果
超纯水和碘化油注射液作为对照组,与4个不同浓度的乳液样品测量CT值得到:样品中的碘浓度依次为0(超纯水)、3、6、12、24、480 mg·ml-1(碘化油注射液);对应测得的 CT 值为 19.6、54.8、93.0、159.7、292.6、3 069.5 HU。
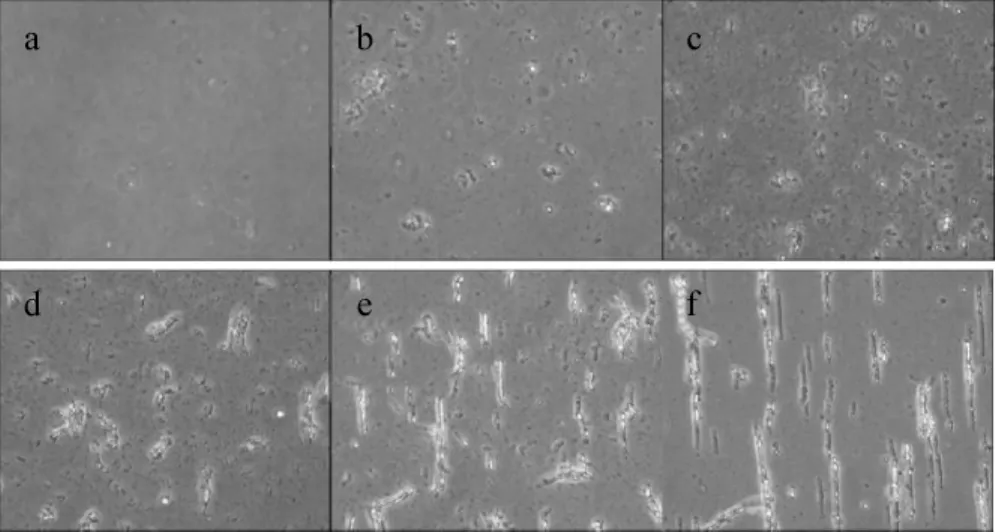
图3 显微镜观察乳液在水平静磁场作用下的组装效果Fig 3 Optical micrographs of the nanoemulsion throughout the drying process(under horizontal magnetic field)
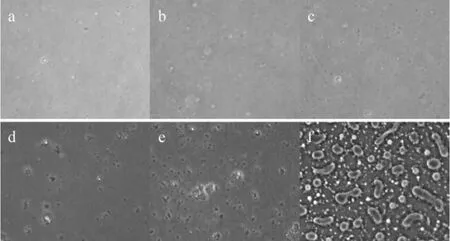
图4 自然状态下乳液干燥过程的显微镜观察图Fig 4 Optical micrographs of the nanoemulsion throughout the drying process(without magnetic field)
从图5可以看出合成的乳液按比例稀释后,碘浓度与CT值之间呈比较明显的线性关系。随着碘浓度的增加,CT值增大。
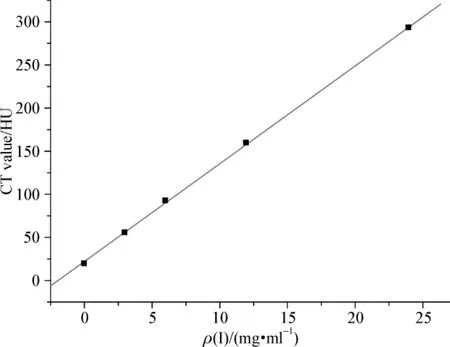
图5 同一乳液不同碘浓度测得的CT值Fig 5 The measured CT value of nanoemulsion with different iodine concentration
2.4 MRI造影效果
测量5个不同铁含量的乳液样品以及超纯水的T2弛豫时间,然后根据公式(1)就可以得到样品的r2弛豫率。
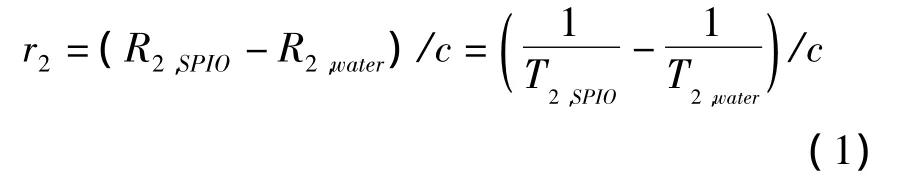
这里c为顺磁中心(Fe)的浓度(mmol·L-1),T2单位为 s,因此 r2弛豫率的单位为 mmol·L-1·s-1。
样品中的铁的物质的量浓度与MRI所测得的T2有如图6所示的关系,斜率就是该材料的弛豫率,线性拟合得到弛豫率的值为 65.7 mmol·L-1·s-1,验证了该样品的MRI造影效果。虽然与目前美国Advanced Magnetics公司生产的临床用造影剂Feridex的r2弛豫率(约为 120 mmol·L-1·s-1)相比较还有一些差距,但是由于本实验中氧化铁存在于乳滴内,与直接溶解在水中的氧化铁相比有差别,会对其弛豫率产生一定的影响。通过增加乳液中的铁浓度可以提高其弛豫率。
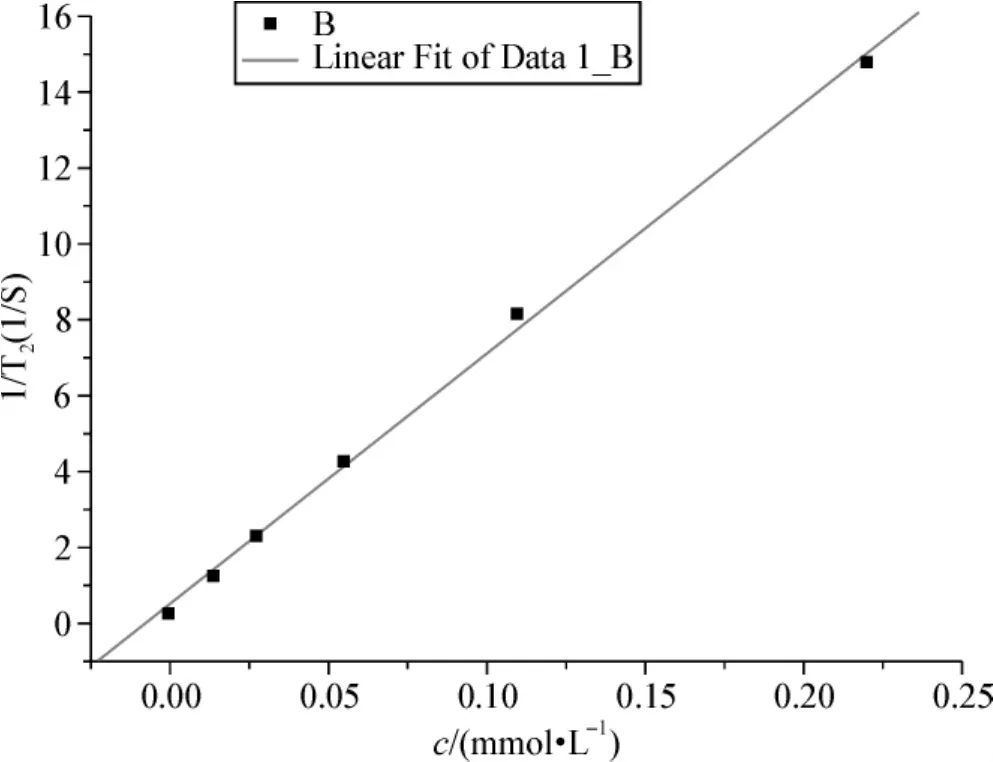
图6 样品中铁的物质的量浓度与1/T2的线性关系Fig 6 The linear relationship between iron concentration and 1/T2
3 结 语
本实验的主要目的是合成CT/MRI双模态造影剂,并对其进行表征。首先我们用共沉淀法合成了稳定性较好的油酸包裹的Fe3O4纳米颗粒,然后将其充分溶解在碘化油注射液(用于CT造影)中,借助水包油纳米乳液的制备技术合成了碘油包封Fe3O4纳米颗粒的水包油型纳米乳液。该实验方法操作简单,可重复性高,通过TEM、DLS、水平磁场作用组装,确定了乳滴的尺寸和形貌。同时通过体外的MRI、CT验证了其造影效果,得到该样品的MRI弛豫率为65.7 mmol·L-1·s-1,CT 值为 292.6 HU(碘含量为 24 mg·ml-1),表明我们合成的材料能够用于CT/MRI双模态造影,具有潜在的临床应用价值。
致谢 感谢国家自然科学基金项目和国家重大科学研究计划项目的资助。
[参考文献]
[1]BRYSON J M,FICHTER K M,CHU W J,et al.Polymer beacons for luminescence and magnetic resonance imaging of DNA delivery[J].PNAS,2009,106:16913-16918.
[2]ATANASIJEVIC T,SHUSTEFF M,FAM P,et al.Calciumsensitive MRI contrast agents based on superparamagnetic iron oxide nanoparticles and calmodulin[J].PNAS,2006,103:14707-14712.
[3]SIMBERG D,DUZA T,PARK J H,et al.Biomimetic amplification of nanoparticle homing to tumors[J].PNAS,2007,104:932-936.
[4]KRAUSE W.Delivery of diagnostic agents in computed tomography[J].Adv Drug Delivery Rev,1999,37:159-173.
[5]KONG W H,LEE W J,CUI Z Y,et al.Nanoparticulate carrier containing water-insoluble iodinated oil as a multifunctional contrast agent for computed tomography imaging[J].Biomaterials,2007,28:5555-5561.
[6]de KRAFFT K E,XIE Z,CAO G,et al.Iodinated nanoscale coordination polymers as potential contrast agents for computed tomography[J].Angew Chem Int Ed,2009,48:9901-9904.
[7]CHENG H Y,NAIR G,WALKER T A,et al.Structural and functional MRI reveals multiple retinal layers[J].PNAS,2006,103:17525-17530.
[8]WU P C,SU C H,CHENG F Y,et al.Modular designed nanoparticles for MRI diagnosis in oral cancer[J].Oral Oncol,2007,2:156-156.
[9]PETER A J,TORJUS S,ANITA G,et al.Iron oxide core oilin-water emulsions as a multifunctional nanoparticle platform for tumor targeting and imaging[J].Biomaterials,2009,30:6947-6954.
[10]MANDAL S K,LEQUEUX N,ROTENBERG B,et al.Encapsulation of magnetic and fluorescent nanoparticles in emulsion droplets[J].Langmuir,2005,21:4175-4179.
[11]GUTIÉRREZ J M,GONZÁLEZ C,MAESTRO A,et al.Nanoemulsions:new applications and optimization of their preparation[J].Curr Opin Colloid Interface Sci,2008,13:245-251.
