乳腺癌彩色多普勒超声表现与P53、Ki-67及p63表达的相关性及意义
蒿业红,蒋天安
(1.浙江萧山医院超声科,浙江 杭州 311201;2.浙江大学医学院第一附属医院超声科,浙江 杭州 310003)
相对于欧美等国家来说,我国虽然是乳腺癌低发国家,但是近年来,乳腺癌的发病率正逐年上升,成为近年危害女性健康最常见恶性肿瘤之一,其预后和评估对临床治疗有着重要的指导意义。彩色多普勒超声检查能够简便而有效地对乳腺癌进行初步诊断。随着分子生物学的迅速发展,人们发现乳腺癌的发生、转移和预后与多种基因蛋白的突变及异常表达有密切关系。本组病例中,116例乳腺癌患者术前均进行彩色多普勒超声检查,手术后肿瘤标本应用免疫组化二步法测定P53、Ki-67及p63,二者进行比较分析,探讨这三个基因蛋白的表达与乳腺癌肿块彩色多普勒超声表现之间的关系和意义。
1 资料与方法
1.1 一般资料
本院2009年4月~2010年7月间住院的116例女性乳腺癌初诊患者,平均年龄52.3岁(38~65岁),其诊断均经术后病理组织学检查证实,全部患者手术前均无放、化疗及激素治疗史,所有病例手术治疗前均经高频彩色多普勒超声检查,观察肿块大小及其与周边组织关系,之后采用Adler分级法观察肿块内部血供情况,同时观察双侧腋窝淋巴结是否肿大。术后对肿瘤标本进行P53、Ki-67及p63等免疫组化指标测定。
1.2 仪器与方法
应用西门子公司Sequioa512彩色多普勒超声诊断仪,探头频率8~10MHz。检查时患者仰卧,充分暴露乳房,使用线阵高频探头,经体表直接检查,以乳头为中心,自乳房12点钟处,从乳房边缘向乳头方向顺时针360度轮辐状扫查,检查时各切面相互部分重叠覆盖,无盲区,然后检查乳房中央区。发现肿块时记录肿块大小、形态、内部回声结构、边界是否清晰(即是否侵犯周边组织)及周边0.5cm范围内血流分布情况。彩色血流丰富程度按Adler血流分级法,将所有病人分为2组,一组为0~1级血流,另一组为2~3级血流,测量其收缩期峰值和阻力指数。最后检查双侧腋窝,观察有无肿大淋巴结及其形态改变、血供情况。
术后对肿瘤标本进行P53、Ki-67及p63指标免疫组化二步法测定,所有标本均为手术切除24小时内取材,经4%甲醛溶液固定,常规石蜡包埋,4μm连续厚切片。操作步骤方法按免疫组化试剂盒说明进行,试剂盒均购自基因公司。
1.3 统计学处理
把全部数据输入SPSS13.0统计软件包进行数据处理,采用卡方检验。
2 结果
116例乳腺癌彩色多普勒超声表现,肿块直径<2cm 40例(34.48%),肿块直径≥2cm 76例(65.52%)。肿块彩色多普勒血流分级 0~1级 22例(18.97%),2~3级 94例(81.03%),肿块侵犯周边组织34例 (29.31%)腋窝淋巴结转移57例(49.14%)。
116例乳腺癌中,P53表达阳性67例(57.8%),Ki-67阳性 82例(70.7%),p63阳性 7例(6.0%)。
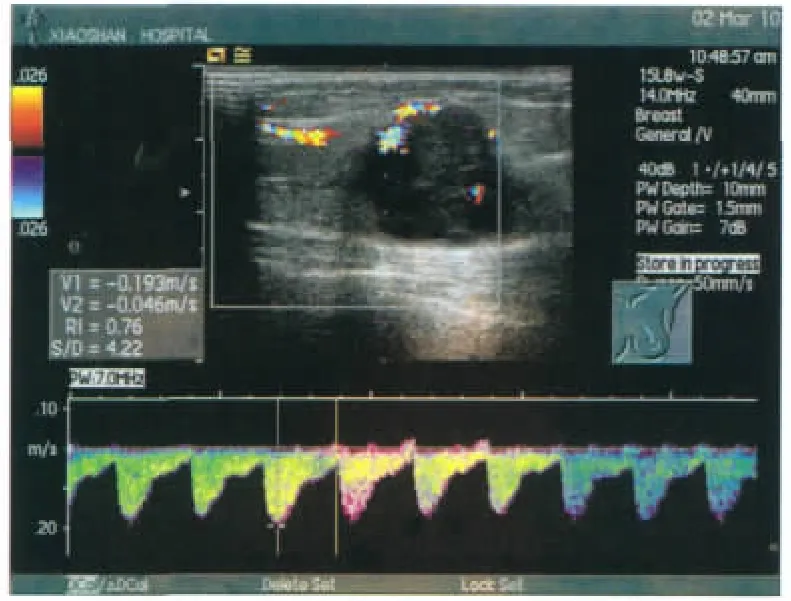
图1 患者左乳内上象限见约2.5cm×2.0cm低回声块,形态不规则,边界不清,内部回声强弱不均,CDFI示肿块内可见几条粗大血管,Adler分级为2级,测RI=0.76。Figure 1. The tumor was in upper inner quadrant of left breast,with irregular shape,obscure boundary,asymmetrical echo inside,a few blood vessels by CDFI,Adler Grade 2,and RI=0.76.
通过彩色多普勒超声表现和免疫组化结果分析比较(见表1)可以发现肿瘤直径≥2cm、血流显像分级2~3级、淋巴结转移阳性和侵犯周边组织者其P53、ki-67阳性表达率分别高于肿瘤直径<2cm、血流显像分级0~1级、无淋巴结转移和无侵犯周边组织者,且差异具有显著性(P≤0.05)。p63阳性的表达却恰恰相反,肿瘤直径≥2cm、血流显像分级2~3级、淋巴结转移阳性和侵犯周边组织者其p63阳性率分别低于肿瘤直径<2cm,血流显像分级0~1级无淋巴结转移和无侵犯周边组织者,差异有显著性(P<0.05)。
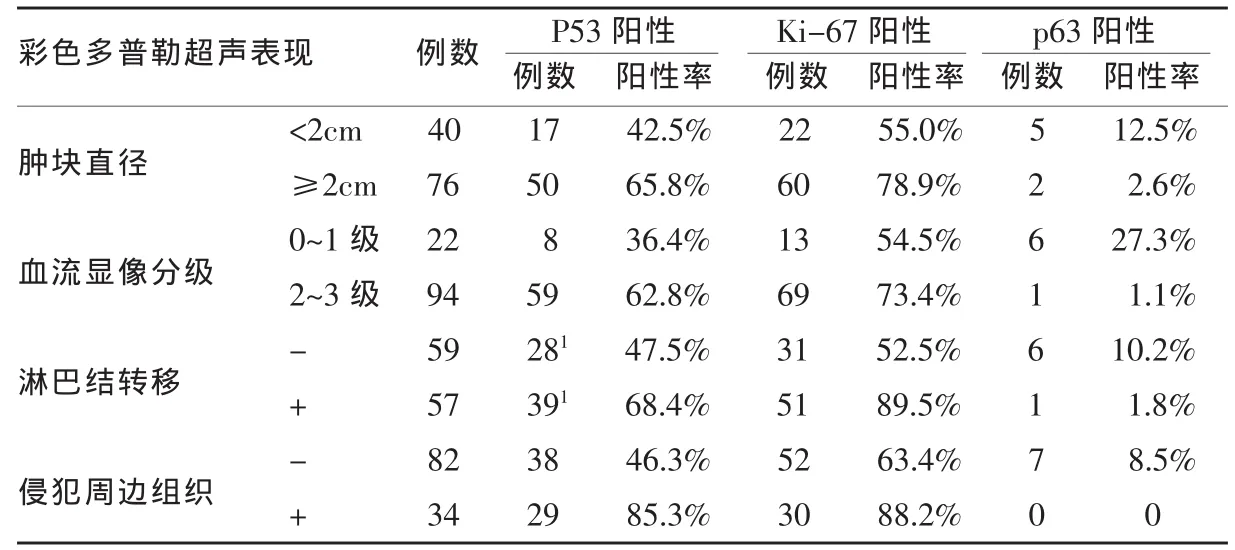
表1 116例乳腺癌彩色多普勒超声表现和免疫组化结果
3 讨论
P53是一种抑癌基因,其失活对肿瘤形成起重要作用。P53基因突变能够产生P53蛋白,后者是一种肿瘤促进因子,不仅可以消除正常P53的抑癌功能,还可以促进肿瘤形成。P53基因突变与乳腺癌的发生密切相关[1],突变型P53蛋白过度表达与乳腺癌患者术后转移和复发有关[2]。黄玉钿等[3]发现P53阳性率与乳腺癌肿块大小和淋巴结转移呈正相关,P53基因突变率高的乳腺癌细胞恶性度高、侵袭性强、淋巴结转移率高。P53基因突变可以上调促进血管增生的内皮生长因子(VEGF),亦能够产生肿瘤促进因子P53蛋白。
Ki-67是一种核抗原,定位于细胞核,半衰期短,与增殖细胞相关。它存在于细胞周期中除G0期以外的所有阶段,并且在M期达到高峰,被公认为是一种敏感、特异的增殖期细胞标志物。Ki-67表达阳性率高者乳腺癌细胞的恶性度高,细胞增殖活跃,因此肿瘤生长速度快、侵袭性强、转移发生较早,预后差。多项研究已表明,Ki-67在肿瘤组织中的表达情况与预后有关,表达越高,预后越差[4-5]。
p63本身是抑癌基因,也是一种上皮生长调节因子;在一些上皮组织细胞核表达,对上皮组织的生长分化起着重要作用。p63可以检测乳腺组织中的肌上皮细胞。免疫标记显示乳腺浸润性癌癌巢周围,肌上皮基本消失或无肌上皮围绕。p63蛋白表达的强度在良性肿瘤较强,恶性肿瘤最弱,p63蛋白的抗原性比较强,有较强的特异性和敏感性。
一般情况下,肿块越大其临床分期相对越晚、恶性程度越高、细胞增殖越活跃。本组病例观察到彩色多普勒超声显示肿块≥2cm以上、血流分级2~3级、淋巴结转移阳性和周边组织侵犯者,其P53、Ki-67阳性表达均分别较肿块<2cm、血流分级0~1级、淋巴结转移阴性、肿瘤未侵犯周边组织者明显增高,p63阳性表达则明显较低,且差异有显著性 (P≤0.05)。说明P53、Ki-67的阳性表达与乳腺癌肿块较大(≥2cm)、血供丰富(2~3级)、淋巴结转移阳性、侵犯肿瘤周边组织等呈正相关,p63的阳性表达则呈负相关。而超声提示乳腺癌肿块较大、血流丰富、淋巴结转移阳性、侵犯肿块周边组织者,其肿瘤恶性程度相对较高[6],这一点正好与P53、Ki-67的高表达提示乳腺癌肿瘤恶性较高相呼应。
在乳腺癌的研究中,彩色多普勒超声检查和免疫组化两者可以相互印证、互为补充,二者联合能够更好地评估乳腺癌恶性程度和预后。当然,肿瘤的发生发展是一个多基因参与、多因素影响、多发展步骤的复杂的过程,在此过程中,多项指标与乳腺癌的转移和预后有关,但各指标间并非完全具有相关性。因此,对于乳腺癌的预后,应根据肿块大小、组织学分级、淋巴结转移与否及多种基因蛋白表达等指标综合分析,以便正确判断预后,制定合理治疗方案。
[1]Rohan TE,Li SQ,Hartwick R,et al.p53 alterations and protein accraulation in benign breast tissue and breast cancer risk,a cohort study[J].Cancer Epidemiol Biomarkers Prev,2006,15(7):1316-1323.
[2]Nayak BK,Das BR.Mutation and methylation status of p53 gene promoter in human breast tumours[J].Tumor Biol,1999,20(6):340-348.
[3]黄玉钿,郑曦,黄双月,等.乳腺癌P53、CAl53的表达及意义[J].中国实验诊断学,2005,9(2):221-224.
[4]Scomro IN,Holmer J,Whimster WF.Predicting prognosis in lung cancer:use of proliferation marker,Ki67 monoclonal antibody[J].Pak Med Assoc,1998,48(3):66.
[5]钟定荣,李向红,桂秋萍,等.Ki67表达在判断星形细胞瘤恶性程度中的作用[J].军医进修学院学报,2002,23(2):153.
[6]张缙熙,姜玉新.浅表器官及组织超声诊断学[M].北京:科学技术文献出版社,2000.133.

