MSCT肝癌介入手术模型的建立及其价值评价
曹登攀 ,郑祥武 ,胡文豪 ,杜玉清 ,张 巍 ,董礼阳 ,董丽卿 ,许化致 ,吴恩福
(1.浙江省永康市第一人民医院放射科,浙江 永康 321300;2.温州医学院附属第一医院影像科,浙江 温州 325000)
肝癌为肝脏最常见的恶性肿瘤,肝动脉化疗栓塞术(TACE)为肝癌非手术治疗的主要手段之一。故术前对肝动脉解剖、肝癌供血动脉的准确评价变得尤为重要。我们利用多层螺旋CT尝试建立了32个MSCT肝癌介入手术模型,并通过DSA与MSCTA的对比研究,对该模型进行了客观的评价。
1 材料与方法
1.1 临床资料
本研究所纳入的研究对象为2009年4~12月期间的32例肝肿瘤患者。纳入标准如下:①患肝癌或肝转移瘤的并行上腹部CT平扫及增强扫描的患者。②在CT检查后1周内行肝动脉造影及TACE的肝恶性肿瘤患者。同时具备上述两条方能纳入研究对象中,且在CT增强与肝动脉血管造影期间未行介入治疗。32例中,男31例,女1例,最小37岁,最大79岁,平均56.8岁。肝癌患者28例,肝转移瘤4例。上腹部增强CT扫描及肝动脉MSCTA、肝动脉DSA及肝肿瘤介入术前均采用同样的准备方式,即受检查者均禁食8小时或以上,以使肝动脉MSCTA和肝DSA时腹部肠道及血管状态尽可能一致。
1.2 肝动脉MSCTA检查方法
MSCT扫描机使用GE公司Lightspeed Pro16层螺旋CT扫描机。扫描范围为右膈顶上2cm到右肾下极水平,一次屏气完成螺旋扫描。扫描参数为:120kV,380mA,螺距 1.375∶1,扫描速度 0.6s/rot,进床速度27.5mm/rot,控测器选用16×1.25mm,扫描层厚5mm,层间距5~7mm。对比剂选用欧乃派克(350mgI/ml),总量为 75~100ml(根据 1.5ml/kg 体重计算),经肘前静脉以3ml/s的速率注射。常规先行上腹部平扫,然后进行动脉期[延时(25±5)s]、门脉期(55~65s)、平衡期(120s)增强扫描。扫描结束后将增强图像以标准重建算法行第二次重建,重建层厚1.25mm,层间距1.00mm,并传到ADW4.2工作站。
1.3 肝动脉DSA检查方法
使用的机器为荷兰Philips公司的Allura Xper FD20型1000mA数字血管造影机。采用Seldinger技术穿刺右侧股动脉,置入4F或5F的RH造影导管,进行腹腔动脉和肝动脉造影。对比剂选用欧乃派克(350mgI/ml)。技术参数为:腹腔干造影的注射速率为 6ml/s,注射总量为 25~30ml,压力为 600Pa;肝总动脉造影的注射速率为5ml/s,注射总量为20ml。然后仔细观察肝动脉走行及肝肿瘤DSA表现,根据MSCT肝癌介入手术模型所显示的肿瘤供血血管有目的地插管,并进行化疗及栓塞治疗。
1.4 MSCT肝癌介入手术模型建立方法
在CT工作站ADW4.2利用选择性容积成像技术(VR法)得到包括肝占位、供血动脉在内的三维彩色VR图像 (对于单发肝癌和结节或肿块少于4个的结节型或巨块型肝癌须包括肝占位,如肝内结节或肿块较多,则不一一勾勒出肿块轮廓),使肝肿瘤的供血动脉的起源、走行、数目得到满意显示,从而建立MSCT肝癌介入手术模型。运用普通VR重建分别重建一幅含有腰椎等骨骼背景的标准前后位及后前位、矢状位肝动脉CTA图像,形成肝动脉MSCTA插管路径图。另外,采用肝动脉的最大密度投影(MIP)对VR方法进行补充。
1.5 MSCT肝癌介入手术模型的评价方法
运用肝动脉DSA作为金标准,对MSCT肝癌介入手术模型显示肝动脉解剖类型、肝癌的供血动脉、有无肝动静脉瘘、腹腔干或肠系膜上动脉的起源及夹角进行对比研究,有无迷走动脉供血,观察两者的符合率及其显示能力。
在评价肝动脉解剖类型时,以Michels分型作为肝动脉解剖分型标准,将MichelsⅠ型作为正常型,其余9型为变异型,分别统计两者构成比。并将MSCTA显示的肝动脉解剖类型与DSA进行比较,观察两者的符合率。
在评价肝癌的供血动脉时,由于在对肝肿瘤行介入治疗时,行肝动脉插管化疗栓塞术常须插到肝叶级肝动脉,故如有两或三支肝叶级肝动脉供血时分别进行统计。在统计肝肿瘤的供血动脉时,如MSCTA清晰显示肝肿瘤的肝叶级分支的肝动脉1支,记为1支,如不能清晰显示则记为0支;如有两支或三支肝叶级的肝动脉供血,则记为2或3支,以此类推;MSCTA上如有变异肝动脉或寄生动脉供血,根据供血动脉数目记下相应的值;对于每个病人,将所有的供血动脉值进行累加,然后与DSA显示的数目进行比较。
将每一椎体以每1/3作为分割标准,将椎体分为上、中、下三部分,观察发出肝动脉的原始上级动脉起点 (腹腔动脉或肠系膜上动脉或其他变异肝动脉自腹主动脉发出处)在椎体上的所在位置,并与DSA对照是否相符合;观察腹腔动脉或肠系膜上动脉或其他供应肝脏的变异肝动脉起始部与腹主动脉在横断面及矢状面的走行及夹角。在横断面观察时,如腹腔动脉干与矢状面吻合为0°,腹腔动脉干向左为+,向右为-;在矢状面观察时,观察腹腔动脉或肠系膜上动脉或其他供应肝脏的变异肝动脉起始部与腹主动脉的所成的下夹角。
由2名副主任医师以上职称的医师采用双盲法独立地进行观察分析,如结果不一致通过讨论达成一致意见。
1.6 统计学分析
统计软件采用SPSS11.5。以配对χ2检验进行比较(检验水准α=0.05),以观察DSA及MSCTA对肝肿瘤的供血动脉的检出率有无显著性差异,比较CT与DSA对显示门静脉瘤栓有无显著性差异。
2 结果
2.1 MSCT肝癌介入手术模型与DSA对肝动脉解剖类型显示的比较
32例肝动脉MSCTA中,MichelsⅠ型 (即正常型, 图 1a,1b)23 例 (71.90%),MichelsⅡ型 3 例(9.4%,图 2a~2d),MichelsⅣ型 1 例(3.1%,图 3a~3d),MichelsⅨ型 1 例(3.1%),MichelsⅢ、Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅹ型均未见到。未列入Michels解剖分型的肝动脉少见变异4例,占12.5%。
在32例患者的DSA图像中,MichelsⅠ型22例(68.8%),MichelsⅡ型 3 例(9.4%),MichelsⅣ型 1 例(3.1%),MichelsⅨ型 1例 (3.1%),Michels Ⅲ、 Ⅴ、Ⅵ、Ⅶ、Ⅷ、Ⅹ型均未见到。未列入Michels解剖分型的肝动脉少见变异5例,4种类型,占15.6%。在32例肝动脉MSCTA中,肝动脉MSCTA与DSA对照结果具体见表1,MSCTA对肝动脉解剖类型诊断符合率达96.9%,两者有很好的一致性,其中1例MSCTA将其误诊为MichelsⅠ型,DSA证实为肝动脉三分叉发育变异。
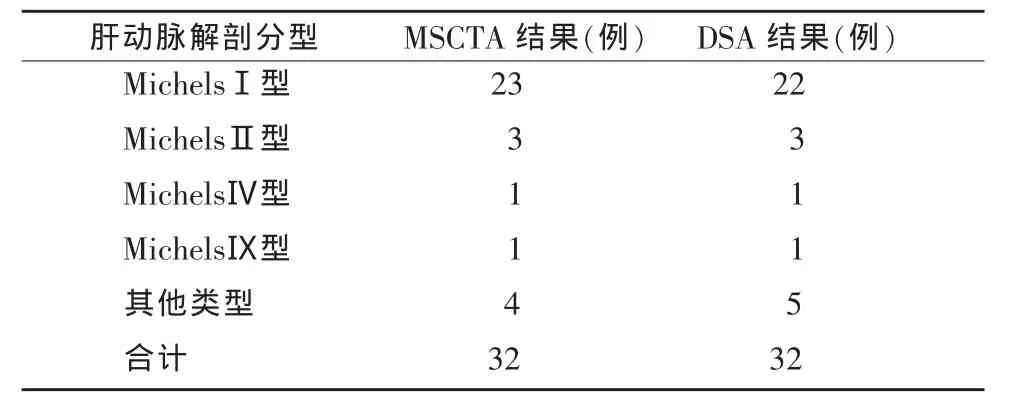
表1 肝动脉解剖类型MSCTA与DSA对照表
2.2 MSCT肝癌介入手术模型与DSA对肝癌供血动脉显示能力比较
在32例肝肿瘤患者中,DSA显示肝肿瘤正常肝动脉供血22例,变异的肝动脉供血10例(图2a~2d);在前述的1例正常型和变异型肝动脉供血的患者中,同时伴有肝外异位寄生血供的患者2例(6.3%),1例为右膈动脉供血 (图3a~3d),1例为右膈动脉和右肾上腺动脉。
在本组32例患者中,MSCT肝癌介入手术模型清晰地显示了肝肿瘤的供血动脉的数目、形态、走行及其起始位置。MSCTA共清晰显示了29例患者的肝肿瘤的供血动脉,3例患者的供血动脉未能清晰显示(原发型肝癌2例,肝转移瘤1例)。MSCTA共检出肝肿瘤供血动脉43条(原发型肝癌37条,肝转移瘤6条),DSA共检出46条肝肿瘤供血动脉 (肝右动脉 条,肝左动脉 条、肝中动脉 条、右膈动脉2条、右肾上腺动脉1条),并显示了在CTA上未能显影的3条供血动脉(肝右动脉2条、肝左动脉1条)。本组MSCT肝癌介入手术模型对肝癌供血动脉的显示率达93.5%,经统计学检验,MSCT肝癌介入手术模型与DSA在肝肿瘤供血动脉的显示上无明显差别(χ2=1.33,P>0.05,配对 χ2检验)。
2.3 MSCT肝癌介入手术模型与DSA对肝动静瘘及门脉癌栓显示能力比较
MSCT肝癌介入手术模型发现肝动脉门静脉瘘4例,DSA证实4例,MSCTA仿真肝肿瘤介入手术模型显示肝动脉门静脉瘘与DSA基本一致。MSCT肝癌介入手术模型(结合横断面CT增强图像)发现门静脉癌栓4例,DSA发现2例。DSA未发现的1例为肝右叶巨块型肝癌,DSA上肝右叶巨大的肿瘤染色掩盖了门静脉右干条形癌栓而未能显示;另1例为CT上示门静脉左干分支癌栓,DSA上病变处血管纵向走行而被门静脉左干影重叠,故DSA上未能得到显示。经配对χ2检验,两者在显示门静脉癌栓上无显著性差别(χ2=0.5,P=0.5)。 MSCTA(结合横断面CT增强图像)能很好地显示肝动脉门静脉瘘、肝动静脉瘘、门静脉及肝静脉瘤栓等征象。
2.4 MSCTA与DSA对腹腔干或肠系膜上动脉的起源及夹角显示的比较
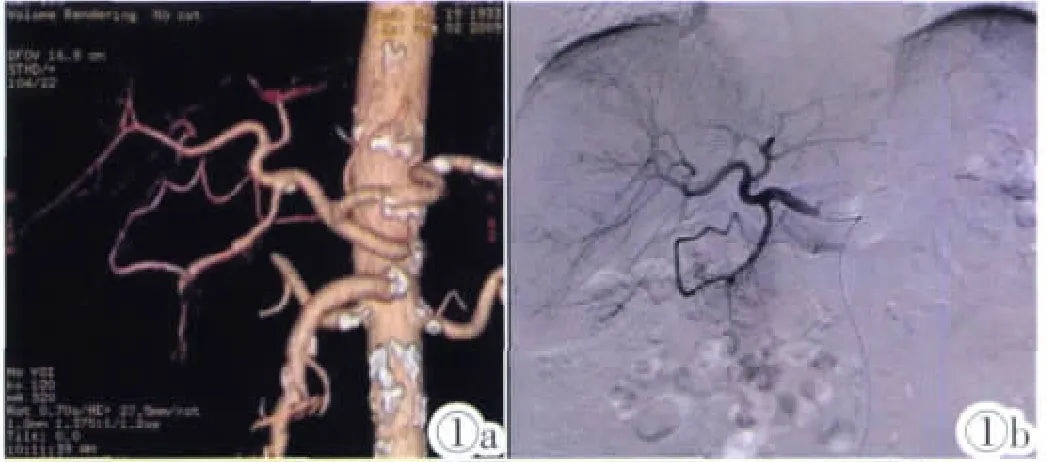
图1a 肝动脉MSCTA(VR)示MichelsⅠ型。 图1b DSA证实MSCTA的结果。Figure 1a. MSCTA(VR)displays hepatic artery of MichelsⅠ.Figure 1b.DSA confirms the results of MSCTA.
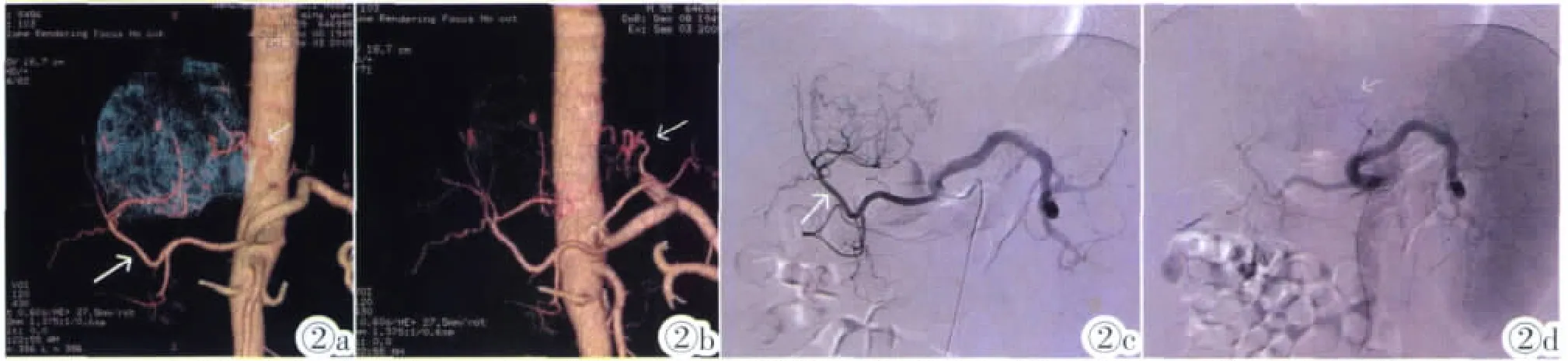
图2a MSCT肝癌介入手术模型示MichelsⅡ型肝动脉变异,替代性肝左动脉发自胃左动脉(细白箭示),粗白箭示肝右动脉。肝癌病灶由肝右动脉和替代性肝左动脉供血。 图2b 旋转位置后MSCTA示替代性肝左动脉发自胃左动脉 (细白箭示)。 图2c,2d DSA证实为MichelsⅡ型肝动脉变异。图2c:肝右动脉发出分支(粗白箭)供应肝癌病灶;图2d:胃左动脉发出替代性肝左动脉分支(细白箭)供应肝癌病灶。Figure 2a. Multi-slice spiral CT model of hepatic carcinoma for interventional procedure clearly displays hepatic artery of MichelsⅡ,it demonstrates replaced left hepatic artery from the left gastric artery(thin white arrow)and the right hepatic artery(thick white arrow).The hepatic tumor is supplied by the right hepatic artery and replaced left hepatic artery. Figure 2b. MSCTA shows an replaced left hepatic artery originating from the left gastric artery(thin white arrow)by rotation. Figure 2c,2d.DSA confirms hepatic artery of MichelⅡ.Figure 2c:The hepatic tumor is supplied by branches of the right hepatic artery(thick white arrow).Figure 2d:The hepatic tumor is supplied by branches of replaced left hepatic artery from the left gastric artery(thin white arrow).
肝动脉 插管路径图清晰地显示腹腔干或肠系膜上动脉的起源在腰椎上的定位、腹主动脉与其夹角,腹腔干或肠系膜上动脉、肝动脉或其他寄生动脉形态、走行,有无狭窄等情况。我们对每例患者均重建了肝动脉MSCTA插管路径图(图4a~4d),有效地指导了肝恶性肿瘤TACE。
在32例患者的MSCTA图像中,供应肝脏血液的腹腔干开口于T12椎体上部2例、T12椎体中部2例、T12椎体下部8例、L1椎体上部9例、L1椎体中部2例、L1椎体下部1例、T12/L1椎间隙水平4例、L1/2椎间隙水平1例。发出替代性肝动脉的肠系膜上动脉开口于T12椎体下部1例、L1椎体上部1例。肝总动脉直接开口于腹主动脉1例,其开口位于L1椎体下缘水平。综上所述,发出供应肝脏血液的肝动脉的腹腔干大多开口于T12椎体下部及L1椎体上部,共17例(53.1%)。MSCTA上腹腔干或肠系膜上动脉开口位置与DSA一致,对肝癌介入治疗的插管有很好的指导价值。
在 例患者的 图像中,其中 例由腹腔干发出供应肝脏血液的肝动脉,腹腔干与腹主动脉矢状面在横断面夹角为-44.8°~54.6°,平均为-16.8°(腹腔干与矢状面吻合为 0°,向右偏斜为-,向左偏斜为+),本组有3例腹腔干向左偏斜,2例偏斜角度大于35°。2例由肠系膜上动脉分别发出肝总动脉或迷走肝右动脉供应肝脏,肠系膜上动脉与腹主动脉矢状面夹角分别为-24.2°和-10°。1例由腹主动脉发出肝总动脉直接供应肝脏血液,其夹角为+11.5°。在矢状面观察,29例患者的腹腔干与腹主动脉的下夹角为 23.5°~106.1°,平均为 64.4°;在 2 例由肠系膜上动脉发出“肝动脉”供应肝脏的患者中,肠系膜上动脉与腹主动脉的下夹角分别为72.1°和101.6°;在唯一的1例由腹主动脉直接发出肝总动脉的患者中,肝总动脉与腹主动脉的下夹角为75.8°。
通过与DSA比较,肝动脉MSCTA插管路径图与DSA有很好的一致性(图4)。
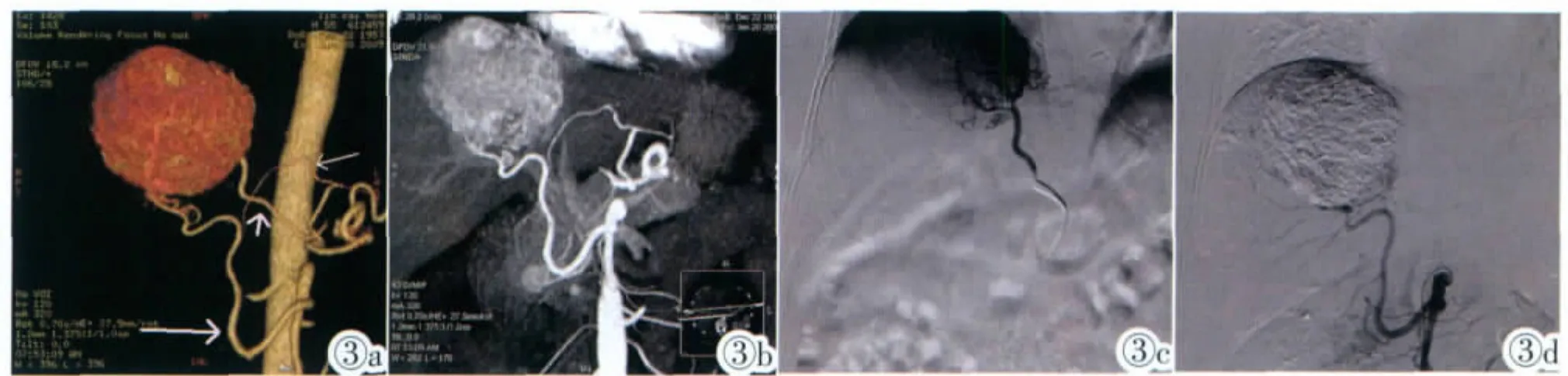
图3a MSCT肝癌介入手术模型示MichelsⅣ肝动脉解剖变异,替代性肝右动脉来自肠系膜上动脉(粗长箭),替代性肝左动脉来自胃左动脉(细长箭),右膈动脉(粗长箭)及肠系膜上动脉发出的替代性肝右动脉供应肝癌病灶。 图3b MIP像。 图3c 右膈动脉动脉选择性造影示右膈动脉明显增粗,发出大量肿瘤血管供应肝癌病灶。 图3d 肠系膜上动脉选择性造影(右膈动脉超选择插管行肝癌TACE后):替代性肝右动脉来自肠系膜上动脉,并发出分支供应肝癌病灶,证实MSCTA的表现,胃左动脉因MSCTA明确显示替代性肝左动脉来自胃左动脉,且对肝癌无血供,故未行选择性胃左动脉造影。Figure 3a. Multi-slice spiral CTA imaging of hepatic carcinoma for interventional procedure demonstrates hepatic artery of MichelsⅣ;A replaced right hepatic artery(the thick and long arrow)arises from the superior mesenteric artery,a replaced left hepatic artery(the thin and long arrow)arises from the left gastric artery.The hepatic tumor is supplied by branches of replaced right hepatic artery from the superior mesenteric artery and the right inferior phrenic artery(dumpy arrow). Figure 3b. It is maximum intensity projection(MIP)of hepatic artery.Figure 3c. DSA demonstrates that the hepatic tumor is supplied by a bunch of tumor blood vessels of thickening right inferior phrenic artery. Figure 3d. DSA confirms the results of MSCTA,it displays that hepatic tumor is supplied by replaced right hepatic artery from the superior mesenteric artery.
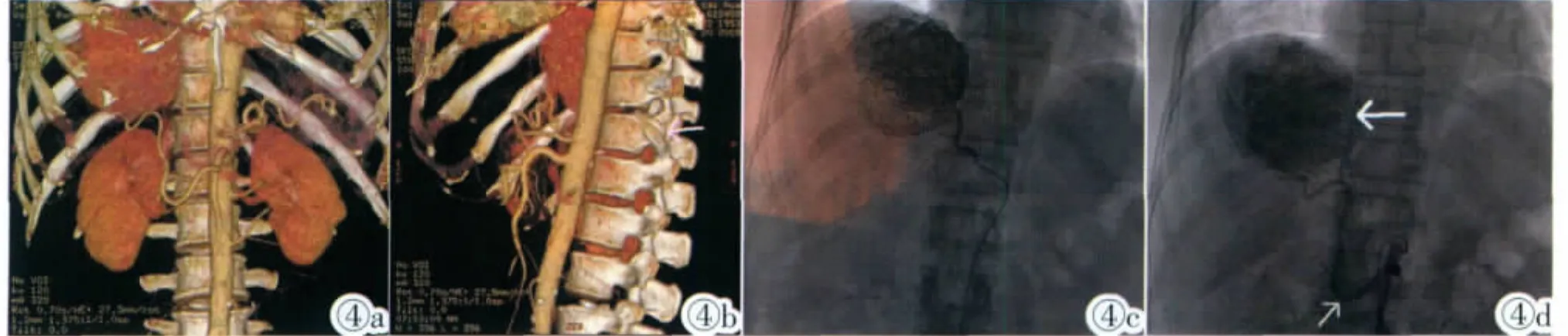
图4a,4b 为肝动脉MSCTA插管路径图正侧位像,清晰显示了右膈动脉、腹腔干、肠系膜上动脉的开口位置。 图4c,4d DSA证实了右膈动脉、肠系膜上动脉开口位置(如肝动脉MSCTA插管路径图所示),图4d为经右膈动脉行肝癌TACE后肿瘤内大量碘油沉积(粗箭)。Figure 4a,4b. MSCTA map of hepatic artery for interventional procedure can clearly display origin of right hepatic artery,the celiac trunk and the superior mesenteric artery. Figure 4c,4d.DSA confirms the results of MSCTA.Figure 4d:DSA shows a large number of lipiodol deposition resulted from TACE of hepatic tumor through the right hepatic artery(thick arrow).
3 讨论
3.1 MSCT肝癌介入手术模型建立的技术要点
准确的肝动脉期是显示肝动脉的首要前题。肝动脉期太早则肝动脉无显影或显示不良,太迟易造成门静脉对肝动脉的 “污染”,影响肝动脉MSCTA的质量。常用确定肝动脉期延时时间的方法有:传统固定时间延迟法、团注追踪法(即半自动跟踪触发技术,Smartprepare法)、小剂量试验注射法。虽然团注追踪法、小剂量试验注射法能一定程度改善血管成像质量,但由于大剂量注射对比剂与小剂量预试验时有所区别,团注追踪法亦不能完全消除个体差异的影响,并不能保证100%的图像优秀。为了更好地节约时间、方便临床应用,我们采用改良固定时间法(即经验法),并且扫描时均固定1名医生,由于具备较多的扫描经验亦能较好地抓住动脉期。故我们要求扫描者在扫描时根据患者年龄、有无心脏疾病、血管情况、平扫时的肝硬化程度进行微调,如患者肝硬化严重,肝萎缩严重,我们可根据程度延时3~5s左右。一般我们用3ml/s的注射速率,对比剂总量用70~120ml(1.5ml/kg),肝动脉期延迟时间为(25±5)s,能够得到较满意的肝动脉MSCTA图像,与文献报道一致[1]。
由于MSCT肝癌介入手术模型建立主要采用选择性容积成像技术,可以较清晰地显示肝癌病灶及其供血动脉,具有较好的整体观与立体感,避免了腰椎及肋骨的重叠。另外,利用普通VR构建肝动脉MSCTA插管路径图,可以较好地显示腹腔干及肠系膜上动脉的起源与夹角,同时观察它们与腰椎椎体的关系,从而可以利用腰椎骨性标志进行插管定位,减少介入时插管的时间。另外,可以利用MIP法作为补充,能更好观察瘤内肿瘤血管及肝动脉细小分支[2]。
3.2 MSCT肝癌介入手术模型与DSA对肝动脉成像的主要技术指标的比较
在两者对肝动脉解剖类型显示能力的比较上,我们采用1966年的Michels分型作为我们的分型标准。Michels分型将肝动脉解剖变异分为10型[3],MichelsⅠ型为正常型,其余9型为肝动脉变异型。Takahashi等[4]和Sahani等[5]学者应用多层螺旋CT血管成像(MSCTA)对肝动脉解剖及变异进行了研究,并与DSA进行了对比。Sahani等学者结果显示:通过22例MSCTA和DSA的对比,发现MSCTA对肝动脉解剖变异诊断的准确度达97%,灵敏度94%,特异度100%。陈光等[6]通过对430例患者的肝动脉MSCTA与肝移植手术结果对照,MSCTA诊断肝动脉解剖变异灵敏度为97.44%,特异度100%。我们以DSA作为金标准,通过比较,MSCT肝癌介入手术模型对肝动脉解剖类型诊断符合率达MSCTA与DSA有很好的一致性,研究结果与上述学者相仿。对肝动脉解剖类型的良好显示能力归功于螺旋CT技术快速发展。由于MSCT的时间和空间分辨力明显提高,其Z轴分辨力较单排螺旋CT有实质性的改善[7-8],实现了图像的各向同性,使肝动脉MSCTA无可争议地成为评价肝动脉解剖的重要手段之一。
在两者对肝癌病灶特点及供血动脉显示能力比较上,我们通过对比研究,MSCT肝癌介入手术模型能很好显示肝内肿块、供血动脉、腹主动脉的关系及空间结构,了解肝肿瘤供血动脉来源及数目、走行,有无肝动脉门静脉瘘。我们共发现了肝肿瘤供血动脉43条,与DSA相比,MSCT肝癌介入手术模型漏掉了3条 (漏诊原因为CT增强时间太早而致肝动脉显示欠佳),但经统计学检验无显著差异 (χ2=1.33,P>0.05),与李杨等观点一致[9]。 肝癌的血供有规则性、变异性和寄生性三类[10],对于肝癌规则性血供,DSA一般不会漏诊。但对于变异性和寄生性血供,由于供血动脉为变异的肝动脉和肝外其他动脉供血,如仅行常规的腹腔干造影极易漏诊。MSCTA通过多角度反复寻找,能很好地发现变异的肝动脉、膈动脉等其他肝外寄生性供血动脉[11-13],继而在MSCT仿真肝肿瘤介入手术模型上显示。我们本组病例共发现肝外寄生性供血动脉3条,其中右膈动脉2条、右肾上腺动脉1条,全部经DSA证实。因MSCTA是在上腹部平扫、增强基础上薄层重建后而来,故我们结合横断面CT能更好地观察肝内肿瘤大小、数目、强化程度,了解门静脉及肝静脉有无癌栓、肝动脉门静脉瘘等情况。本组中我们共发现了肝动脉门静脉瘘4例,DSA证实4例,MSCT肝癌介入手术模型和DSA对肝动脉门静脉瘘显示无差别(P>0.05),与杜玉清等学者观点一致[14]。可见,通过结合横断位CT平扫及增强图像,MSCT肝癌介入手术模型能很好地显示肝肿瘤特点及其供血动脉。
对腹腔干或肠系膜上动脉的起源及夹角显示的比较,MSCTA不逊于DSA。MSCTA能清晰显示出肝动脉的上级动脉 (腹腔动脉或肠系膜上动脉或其他动脉)在腹主动脉的开口的位置、夹角,并显示其在相应水平胸或腰椎骨性标志上的对应位置,从而形成肝动脉MSCTA插管路径图,以利肝恶性肿瘤介入治疗时更快速而准确地插管,从而减少医生和患者接触X射线的时间。如有必要,可进一步多角度进行展示MSCTA上的肝动脉形态、走行、起始位置。肝动脉MSCTA在显示腹腔干的开口及形态上比DSA有优势,在显示腹腔干与腹主动脉的夹角亦比DSA清晰而直观,不必如DSA那样行侧位投照或行旋转DSA,与李智岗等学者观点一致[1]。
3.3 MSCT肝癌介入手术模型在肝恶性肿瘤TACE的价值
MSCT肝癌介入手术模型可以从不同的角度显示肝动脉的起源和走行,特别是能够更加清晰地以三维图像直观显示异位供血动脉及其分支,在术前对手术方案及术中所需导管进行充分估计,用以指导肝动脉的超选择性插管,避免TACE对肝外异位供血动脉的漏栓[14]。由于MSCTA对肝总动脉、肝固有动脉、肝左右动脉狭窄或闭塞的诊断的灵敏度和特异度均较高[15],如MSCT肝癌介入手术模型提示肝动脉高度狭窄或闭塞,我们可避免行肝动脉插管化疗栓塞术,从而采用另外的肝癌介入治疗方法。肝动脉MSCTA插管路径图能充分展现腹腔干、肝总动脉、肝固有动脉等动脉形态、走行、角度等情况。腹腔干与腹主动脉夹角、腹腔干长度对临床介入治疗有较大的意义。如对于MSCTA显示腹腔动脉较长的患者,可采用COBRA管打袢技术或加用微导管;对于腹腔动脉极度向左偏移的患者,可应用微导管;对于MSCTA矢状面显示腹腔动脉直接向上走行,且与腹主动脉上夹角较小的患者,考虑肝管很难深入者,可考虑采用MIK导管[1]。肝动脉MSCTA插管路径图能充分展示TACE的最佳插管路径,从而指导肝动脉快速而准确插管,减少医生和患者接触X射线的时间,减少对比剂用量。通过MSCT肝癌介入手术模型,我们能对肝动脉插管化疗栓塞术提供有效指导。
综上所述,通过MSCT肝癌介入手术模型,我们能很好的显示肝动脉解剖类型,肝动脉的形态及走行,肝癌的供血动脉、肝动脉门静脉瘘等,对于肝恶性肿瘤肝动脉化疗栓塞术具有重要的指导价值。
[1]李智岗,赵俊京,时高峰,等.多层螺旋CT在肝癌肝动脉化疗栓塞中的价值[J]. 中华放射学杂志,2006,40(5):511-514.
[2]刘禄明,都基权,张鹏,等.64层螺旋CT肝动脉血管成像的临床应用[J].医学影像学杂志,2008,1137-1139.
[3]Michels NA.Newer anatomy of the liver and its variant blood supply and collateral circulation[J].Am J Surg,1966,112(3):332-347.
[4]Takahashi S,Murakami T,Takamura M,et al.Multi-detector row helical CT angiography of hepatic vessels:depiction with dualarterial phase acquisition during single breath hold[J].Radiology,2002,222(1):81-88.
[5]Sahani D,Saini S,Pena C,et al.Using multidetector CT for preoperative vascular evaluation of liver neoplasms:technique and results[J].AJR,2002,179(1):53-59.
[6]陈光,沈文,祁吉,等.MSCT血管成像对肝动脉解剖变异的诊断价值[J]. 放射学实践,2007,22(1):44-46.
[7]Guiney MJ,Kruskal JB,Sosna J,et al.Multi-detector row CT of relevant vascular anatomy of the surgical plane in split-liver transplantation[J].Radiology,2003,229(2):401-407.
[8]Byun JH,Kim TK,Lee SS,et al.Evaluation of the hepatic artery in potential donors for living donor liver transplantation by computed tomography angiography using multidetector-row computed tomography:comparison of volume rendering and maximum intensity projection techniques[J].J Comput Assist Tomogr,2003,27(2):125-131.
[9]李杨,杜勇,罗天友,等.多层螺旋CT血管成像在肝脏肿瘤中的临床应用[J]. 中国医学计算机成像杂志,2008,14(2):139-143.
[10]Ruzicka FF,Rossi P,Abrams RE,et al.Anomalous and parasitic arterial blood supply in the abdomen[J].Radiology,1970,96(2):261-268.
[11]Sakai H,Okuda K,Yasunaga M,et al.Reliability of hepatic artery configuration in 3D CT angiography compared with conventional angiography—special reference to living-related liver transplant donors[J].Transpl Int,2005,18(5):499-505.
[12]Duran C,Uraz S,Kantarci M,et al.Hepatic arterial mapping by multidetectorcomputed tomographic angiography in living donor liver transplantation[J].J Comput Assist Tomogr,2009,33(4):618-625.
[13]Basile A,Tsetis D,Montineri A,et al.MDCT anatomic assessment of right inferior phrenic artery origin related to potential supply to hepatocellular carcinoma and its embolization[J].Cardiovasc Intervent Radiol,2008,31(2):349-358.
[14]杜玉清,董丽卿,董礼阳,等.多层螺旋CT仿真肝癌模型在介入治疗中的价值[J].中华肝胆外科杂志 2009,15(6):420-422.
[15]孟晓春,单鸿,朱康顺,等.肝移植术后肝动脉狭窄的多层CT诊断价值[J]. 中华医学杂志,2006,86(28):2002-2005.

