BRMS1基因在胃癌中的表达及意义
韩国新,魏立伟,王庆宝
(泰山医学院附属医院,山东泰安271000)
肿瘤转移抑制基因是目前肿瘤临床防治研究的热点领域之一。国内外学者研究证实,乳腺癌转移抑制基因(BRMS1)与多种恶性肿瘤的浸润转移密切相关。胃癌是全世界最常见的恶性肿瘤之一,本研究旨在探讨BRMS1基因在胃癌中的表达及意义。
1 资料与方法
1.1 临床资料 选择2005年1月~2006年11月泰山医学院附属医院住院的胃癌患者44例,男26例、女18例,年龄19~73岁、中位年龄52.3岁。患者术前均未经化疗或放疗等其他治疗。在手术时收集标本,用DEPC处理过的生理盐水将血液洗净,立即置于液氮中,24 h后贮存在-80℃冰箱。术后均经病理证实,另取距肿瘤边缘5 cm以上胃组织(术后病理未发现癌细胞浸润)作为对照。
1.2 BRMS1的检测 RNA的提取:取100~200 mg胃癌组织及癌旁正常胃组织分别在不同的研钵中经液氮研磨成粉末状,转移至1.5 ml EP管中,提取总RNA(总RNA分离试剂盒,华美生物工程公司);RNA 逆转录:体系为:RNA 2 μl、ARP(0.5 μg/μl)1 μl、0.1%DEPC 水 9 μl,轻度离心混匀,70 ℃5 min;0℃ 5 min;冰水中加反应液5×buffer缓冲液5 μl,dNTPs(2.5 mmol)4 μl,RNase 抑制剂 1 μl,M-MLV 逆转录酶 2 μl,0.1%DEPC 水 1 μl,反应总体积25 μl,混匀后,37 ℃ 60 min;70 ℃ 10 min;将反应生成的cDNA存于-20℃冰箱备用。PCR反应:以cDNA为模板进行目的基因及内参18 s rRNA产物扩增,注意每组实验均常规设置复管和阴性对照。目的基因引物及内参引物由大连TAKARA公司设计合成并且经GenBank验证序列。BRMS1基因特异性引物,上游5'-ATGCCTGTCCAGCCTCCAAG-3';下游 5'-GCGTCGCTCATAGTCCTCATCA-3',产物长度168 bp。18 s rRNA特异性引物,上游5'-GTAACCCGTTGAACCCCATT-3';下游5'-CCATCCAATCGGTAGTAGCG-3',产物长度151 bp。PCR反应体系:10 × buffer缓冲液 5 μl,MgCl2溶液(25 mmol/L)3 μl,dNTPs(各 2.5 mmol/L)4 μl,上游引物 (10 μmol/L)1 μl,下游引物(10 μmol/L)1 μl,cDNA 1 μl,rTaq 酶(5 U/μl)0.5 μl,ddH2O 34.5 μl,总体积为50 μl。内参18 s rRNA反应条件:94℃预变性4 min;94℃变性30 s,60℃退火30 s,72℃延伸20 s,进行20个循环;72℃延伸4 min。BRMS1基因反应条件如下:95℃预变性4 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,进行33个循环;72℃延伸4 min。琼脂糖凝胶电泳和凝胶成像分析系统图像处理:取10 μl PCR扩增产物与2 μl的6×buffer上样缓冲液充分混合后,加入凝胶电泳孔中,并用5 μl Mark 2000作为标记,在120 V、50 mA条件下进行电泳。凝胶分析,采用Bio-Rad凝胶成像分析系统进行图像扫描分析,测定电泳条带的光密度值。
结果判断:BRMS1的表达:以看到清晰的条带作为有表达,记为“+”;没有表达记为“-”。BRMS1相对表达水平:测定BRMS1 mRNA在胃癌组织及癌旁正常胃组织中表达的光密度值,与同一标本的内参照18 s rRNA电泳条带的光密度值相比。
1.3 统计学方法 采用SPSS12.0统计软件,数据比较行χ2检验、校正χ2检验、Fisher精确概率分析检验。P≤0.05为有统计学差异。
2 结果
2.1 BRMS1 mRNA在胃癌组织中的表达 胃癌组织中 BRMS1表达阳性14例,表达量为0.21±0.19,阴性30例;正常胃癌组织分别为35例、0.96±0.21、9例。胃癌组织BRMS1的表达量低于正常胃组织(P <0.01)。
2.2 BRMS1 mRNA与胃癌组织临床病理指标的关系 见表1。
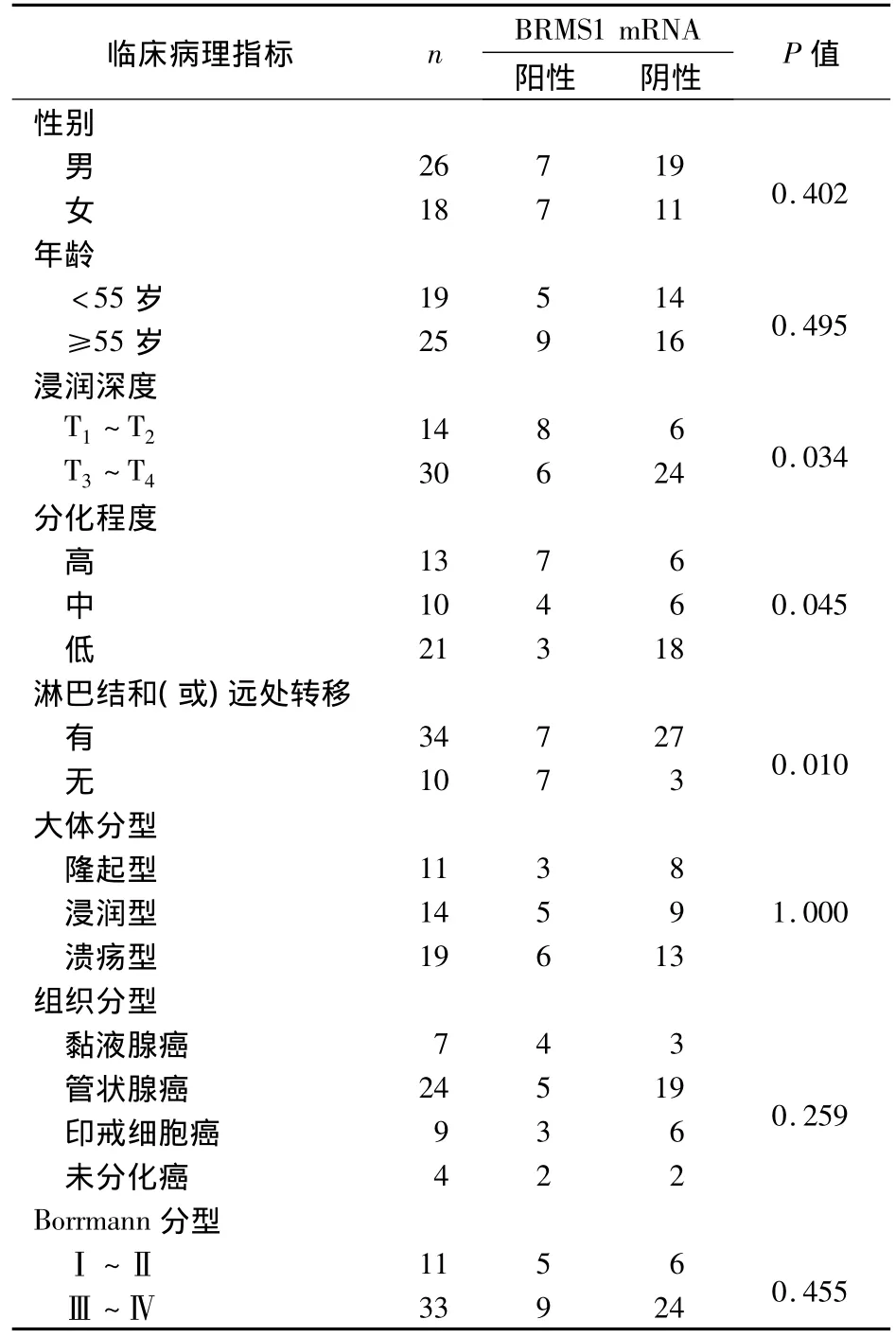
表1 BRMS1 mRNA与胃癌组织临床病理学指标的关系(例)
3 讨论
BRMS1系2000年 Seraj等[1]运用差异显示分析技术发现的定位于人染色体11q13.1~q13.2的一种肿瘤转移抑制基因,全长为10 kb,由10个外显子和9个内含子组成。cDNA全长1 485 bp,有1个741 bp的长开放阅读框(核苷酸122~862)。编码1个有264个氨基酸组成的蛋白质,相对分子量为28 500。BRMS1基因在被检测的酵母、小鼠、人等多个物种及胰腺、胸腺、脾等多种人正常组织中均有不同程度的表达。而且人BRMS1与鼠BRMS1 cDNA 85%同源,蛋白序列同源性达95%,显示出较高的序列保守性[2],提示该基因具有重要的生物学功能。
BRMS1抑制肿瘤转移的机制包括,恢复缝隙连接的细胞间信息交流,促进失巢凋亡,抑制在软琼脂中的生长及转移/侵袭[3]。在分子水平上,当BRMS1重新表达时,可改变转录组和蛋白质组,包括表皮生长因子受体、骨桥蛋白、尿激酶型纤溶酶原激活剂(uPA)、C-X-C趋化因子受体4和成束蛋白。此外BRMS1也可调控miRNA在内的非编码基因,可协同调节多个metastamiR的表达[4]。
BRMS1基因对乳腺癌的转移抑制作用已为大部分学者所共识,一系列研究发现它的转移抑制作用不只存在于乳腺癌中,而且在恶性黑色素瘤、膀胱癌、卵巢上皮癌、子宫内膜癌、口腔鳞癌、喉癌、小细胞未分化肺癌等多种肿瘤转移中均起抑制作用,表现为恶性肿瘤伴随淋巴结转移的发生,BRMS1 mRNA表达下降或缺失,并且转染BRMS1的癌细胞株,其转移潜能明显降低。本实验结果显示,BRMS1 mRNA在胃癌中的表达水平较正常胃组织明显降低或表达缺失,而且与胃癌的分化程度、浸润深度和有无淋巴结转移密切相关,表现为随胃癌分化程度减低、浸润深度的增加和淋巴结转移的发生,BRMS1 mRNA表达下调或缺失。但BRMS1 mRNA表达与患者性别、年龄、胃癌的组织分型无明显关系。而彭海等认为BRMS1 mRNA的表达下降能够促进胃癌淋巴结转移,可以作为临床预测胃癌转移的指标之一。同时发现BRMS1 mRNA的表达与胃癌的病理类型和分化程度无关。本研究与此研究结果基本一致,但在与肿瘤的分化程度上存在差异,考虑BRMS1 mRNA具有不同长度的变异剪切体,如果使用不同的PCR引物检测会产生不同的结果。由此提示BRMS1基因对胃癌的转移也具有抑制作用,可望成为胃癌转移的分子生物学标志之一。
[1]Seraj MJ,Samant RS,Verderame MF,et al.Functional evidence for a novel human breast carcinoma metastasis suppressor,BRMS1,encoded at chromosome 11q13[J].Cancer Res,2000,60(11):2764-2769.
[2]Samant RS,Debies MT,Shevde LA,et al.Identification and characterization of the murina ortholog(brms1)of breast-cancer metastasis suppressor 1(BRMS1)[J].Int J Cancer,2002,97(1):15-20.
[3]Edmonds MD,Hurst DR,Welch DR.Linking metastasis suppression with metastamiR regulation[J].Cell Cycle,2009,8(17):2673-2675.
[4]Edmonds MD,Hurst DR,Vaidya KS,et al.Breast cancer metastasis suppressor 1 coordinately regulates metastasis-associated microRNA expression[J].Int J Cancer,2009,125(8):1778-1785.

