HLA抗原系统与移植临床
周永昌
器官移植是治疗终末期器官功能衰竭最有效的方法,目前随着手术方式的改进和新型免疫抑制剂的临床应用,移植器官早期存活率明显提高,但长期存活率仍不理想。临床实践表明,器官移植的成败取决于供受者间的组织相容性,其中HLA等位基因匹配程度起关键作用,是影响移植器官长期预后的重要因素。本文就HLA抗原系统的基本知识及与移植临床的关系作一简要介绍。
1 HLA抗原系统的由来与发展历程
HLA是迄今为止最复杂的人类基因系统。1952年Jean Dausset首次报道了HLA-A2抗原,并因此获得1980年的诺贝尔奖[1]。至20世纪70年代共发现21个HLA等位基因。随着分子生物学检测技术的不断改进,越来越多的等位基因被发现,迄今发现的HLA等位基因已近5000个。
1964 年,Terasaki[2]发明了 HLA 微量检测方法,患者淋巴细胞上相应的抗原会与抗体发生反应,在补体的作用下淋巴细胞死亡。此时通过染色显示出结果,即可用已知的抗体检测未知的抗原。该方法被美国国立卫生院定为国际标准,即补体依赖的细胞毒(complement dependent cytotoxicity,CDC)方法。从20世纪90年代以前以血清学方法为主到单克隆抗体技术(One Lambda公司),再到90年代中期发展起来的分子生物学技术,HLA抗原检测方法主要经历了血清学、CDC、ELISA和Luminex®磁珠分析等的不断改进,研究人员和系统结构也发生相应的变化,研究理论也从细胞、体液水平到抗原决定簇、分子结构快速发展。技术方法的不断改进和研究理论的不断发展,使HLA配型成功应用于器官移植临床。20世纪60年代中期以后,器官移植数量显著增加。目前,全球每年都会进行200万次左右的HLA配型,绝大部分采用的是分子生物学方法。
1967年,HLA的基因位点被证实在第六号染色体短臂上。当时只发现了HLA-A和B两个位点,发现的HLA只有21个。到第8届国际HLA研讨会时,总共发现79个HLA。由于在20世纪90年代大部分的HLA配型仍由单克隆抗体板检测,至90年代末已知的HLAⅠ类抗原不到100个。根据the international ImMunoGene Tics information system®数据库(版本:3.0.0)的统计显示,截至2010年4月HLA等位基因总数为4633个,其中Ⅰ类为3411个(包括A位点1001个、B位点1605个和C位点690个),Ⅱ类1222个(包括DRB1位点878个),以及其他与HLA相关基因110个(包括MICA 69个、MICB 30个、TAP1 7个和TAP2 4个)。临床常检测的是A、B、DR 3个位点。随着检测技术的改进,发现了越来越多的HLA等位基因,特别是近10年,再过几年HLA等位基因数将超过1万。
2 HLA抗原系统的管理及命名原则
新发现的等位基因需要命名,其生物学功能和意义需要验证,这需要国际间良好的交流与合作。这方面的工作应有相应的机构进行管理和协调。美国组织相容与免疫遗传学会(American Society for Histocompatibility and Immunogenetics,ASHI)是公认的HLA领域的权威机构,另外还有WHO HLA命名委员会、Anthony Nolan研究所、美国国家骨髓库和器官分配联合网络,以及欧盟免疫及组织相容学会等,这些机构如同一个大机构下的不同分支,通过分工合作共同管理HLA系统。
按照WHO的规定,描述HLA某个抗原或等位基因的格式为:大写的HLA(说明是HLA的检测),HLA后面一个横杠,横杠后的大写字母A代表A位点,B代表B位点,以此类推;位点后面如果加*号,提示为分子生物学检测结果,*后至少为4位数字,如HLA-A*0101;如果不加*号,提示为血清学检测结果,位点后只需要两位数字,如HLA-B13。常规的分子生物学检查结果用4位数字表示,如HLA-A*0201,前两个数字代表基因家族,后两个数字代表该家族不同的成员,如 HLA-A*0201和HLA-A*0202。从2010年4月1日开始,WHO的HLA命名规则发生改变,即HLA抗原家族和成员之间用冒号分隔,如HLA-A*02:04。
3 HLA的分子结构及免疫活性
HLAⅠ类抗原的分子结构由两条多肽链组成,即具有多态性的α链(重链)和非多态性的β链(轻链)。这两条多肽链盘曲折叠后构成4个结构区域(α1、α2、α3 和 β2),分子顶部的 α1 和 α2 两个区域间由2个α螺旋和8个β折叠组成多肽结合槽(peptide binding groove),这个区域是抗原识别部位,即决定HLA抗原特异性的部位。α链的羧基端(α3的尾端)穿过细胞膜插入细胞质,以此将HLA分子固定在膜上,并传递细胞内外的信号。β链不具备多态性。许多等位基因名称不同的原因是在抗原识别部位以外存在不同的氨基酸序列,而这些等位基因在抗原识别部位的氨基酸序列是完全一样的。目前尚未发现抗原识别部位以外的差异具有免疫学意义,因此,虽然等位基因不同,但如果抗原识别部位的氨基酸序列完全相同,则可被视为HLA高分辨率相合。
HLAⅠ类抗原识别部位在第2和第3外显子,HLAⅡ类抗原识别部位在第2外显子。例如:“B*07:05,B*15:02”与“B*07:06,B*15:02”,其中B*07:05与B*07:06的区别只在第5外显子281密码子的第1个核苷上,而在第2和第3外显子的氨基酸序列完全相同,两者一般不存在功能上的差异。这也是为什么ASHI将氨基酸序列在第2和第3外显子完全相同(Ⅰ类)和在第2外显子完全相同(Ⅱ类)的等位基因视为可接受的高分辨率结果的原因。如果不了解ASHI可接受的高分辨率定义,很多难得的供者将被视为不理想供者而被排除。
表1为1份HLA配型高分变率检测报告。尽管例2~例6供者与受者的等位基因不完全相同,但这些不同均在抗原识别部位以外。根据ASHI标准,这些供者与受者HLA高分辨率相合,即为零错配。
4 供者特异性抗体及其临床意义
移植后,如果受者血清中发现有针对供者的抗体,该抗体称为供者特异性抗体(donor specific antigen,DSA)。例如,供者抗原为 HLA-A11、HLAA24,移植后患者出现抗 HLA-A11和抗 HLA-A68抗体。此时,抗HLA-A11抗体为DSA,抗A68抗体为非DSA。当受者出现DSA时,移植物发生排斥反应的概率明显增加。有报道,移植失败的患者中有24%存在DSA,而对照组只有1%存在DSA[3]。
因此,建议在行HLA不相合亲缘骨髓移植前将患者血清与供者淋巴细胞进行细胞毒交叉反应试验来筛查HLA抗体,细胞毒交叉反应试验阳性者进一步检测DSA[4]。骨髓移植受者细胞毒交叉反应试验阳性者,排斥反应发生率高达62%。
过去,临床医生很难理解为什么患者会产生针对自身抗原的抗体。例如,患者的抗原是HLADR4,血清里检测出的抗体也是针对HLA-DR4。长期以来的认识是实验室检测存在质量问题,随着检测技术分辨率的提高,证实患者的抗原是HLA-DR*04:05,而血清抗体是抗HLA-DR*04:01。
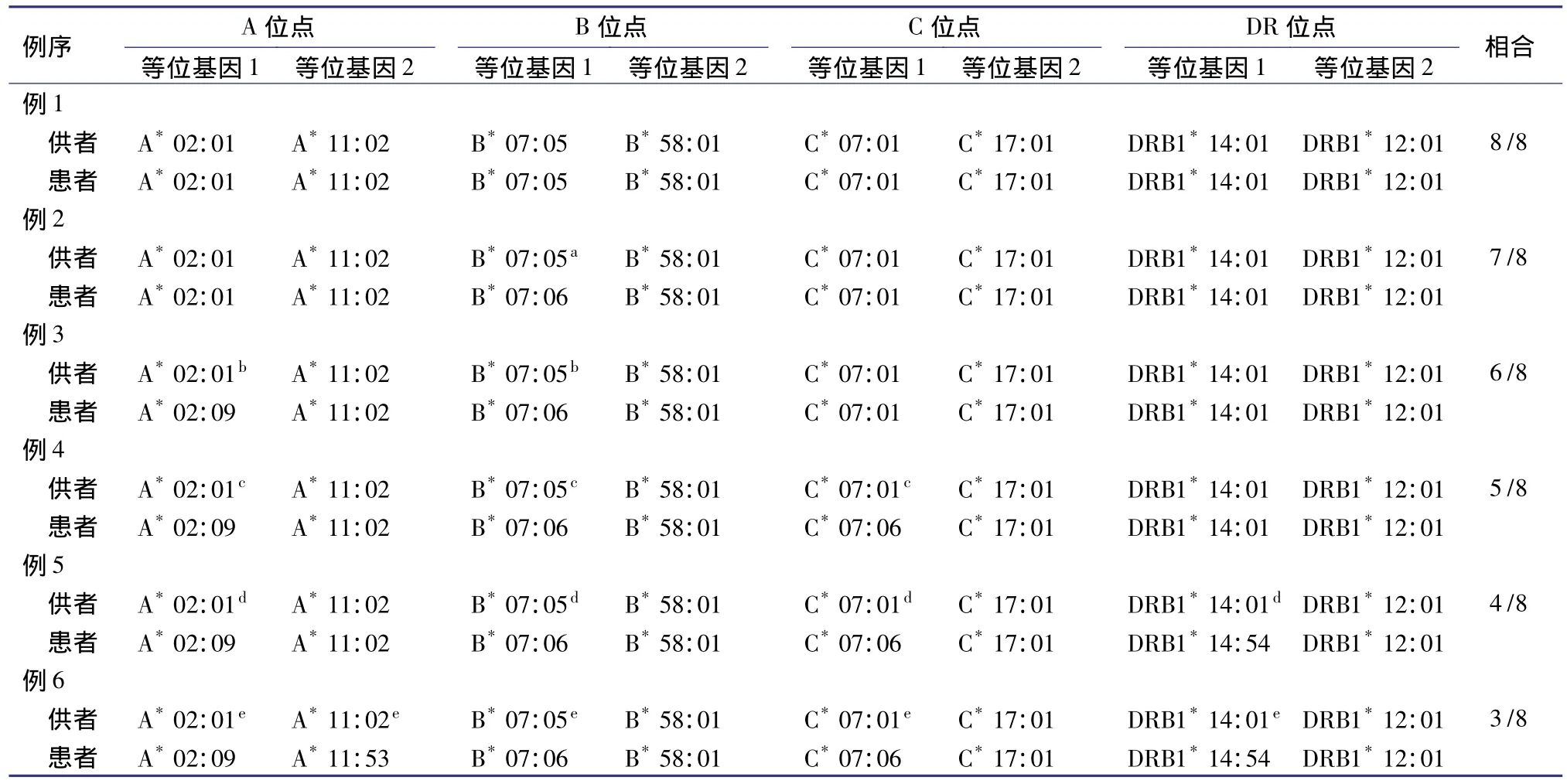
表1 HLA配型高分辨率检测报告
检测抗HLA抗体对及时发现移植器官排斥反应至关重要。检测频率各中心不同:如果手术前受者抗HLA抗体阴性,可考虑术后每3个月检测1次,然后每年检测1次。如果手术前受者抗HLA抗体阳性,则需要术后严密观察,增加抗HLA抗体检测的频度。
当某个HLA抗原与一个抗体发生反应时,另外的抗原也会与这个抗体发生反应。后来证实,这些抗原在分子结构上存在共性,该分子结构称为抗原决定簇。HLA抗原与抗体并非一把钥匙一把锁,常为一个抗体与多个抗原反应;同一组抗原在分子结构上存在共性。抗原决定簇的发现具有实际临床意义,但其检测的实验室技术要求较高。目前发现的抗原决定簇有HLAⅠ类110个(A位点34个、B位点44个、C位点4个、A-B位点20个、B-C位点5个和A-B-C位点3个);HLAⅡ类83个(DR位点60个、DQ位点18个、DP位点5个);MICA 7个。
根据抗原决定簇理论,A2与A68为一个抗原决定簇。A2与B57、B58为另外一个抗原决定簇。某患者移植后前6年没有检测出抗HLA抗体,血清肌酐水平也维持正常。6年后检测出抗HLA抗体,其中包括抗供者的HLA-A2抗体,同时检出的还有抗HLA-A68、B57和B58抗体。抗体出现后,患者血清肌酐水平明显升高,并发生了移植物排斥反应。
5 抗HLA抗体检测技术
以前缺乏抗HLA抗体导致器官移植排斥反应的证据主要是因为没有精确的实验室检测技术和方法。
Terasaki在20世纪60年代创建了加州大学洛杉矶分校的免疫遗传实验室,这是目前HLA领域全球最大的实验室,该实验室在2009年共完成100 000例HLA检测。20世纪70年代,Terasaki教授在美国洛杉矶大学加州分校建立了国际细胞交换中心,与美国国内207个实验室和国外91个实验室进行数据共享。该中心每个月将已知结果的标本(包括血清标本、DNA标本和细胞标本)发送到这些实验室供其检测,用以统计对某个HLA抗原或抗体的检测精确度。由于HLA抗原的特性不同,有的抗原容易被检测出来,有的则很难。HLA抗原数字越小的抗体相对容易检测出来,数字越大越难检测。所以,评估一个实验室的质量,不仅看其错误率,而且要看错在哪个抗原或抗体上。
目前比较常见的检测抗HLA抗体的技术有传统的CDC、ELISA、流式细胞分析和最新的Luminex®磁珠分析。几种方法比较来看,CDC敏感性不高,许多CDC阴性结果者经流式细胞分析检测为阳性结果。ELISA的敏感性高于CDC,但仍不如流式细胞分析方法。而传统的流式细胞分析与Luminex®磁珠分析技术相关性很好。
最新的Luminex®磁珠分析的原理是在微磁珠上包备纯化的HLA抗原。如果血清中存在抗体,抗原抗体结合后,该磁珠发出荧光。流式细胞仪的激光可将其反应强度进行数字化处理,从而获得精确的抗体特异性和强度。磁珠上可包备细胞即某个供者的细胞,上面包含了几个抗原。也可包备纯化的单一抗原。如果单纯检测群体反应性抗体(抗HLA抗体)的效价,可采用前者。如果具体检测某个抗体,可采用单一抗原磁珠。只要这个磁珠呈阳性反应,即可获得准确结果。流式细胞仪内有两个激光。红色激光负责识别磁珠的身份,即第几号磁珠;绿色激光负责识别磁珠上的生物反应。两个激光共同判定以获得结果。
单一抗原磁珠技术可帮助高群体反应性抗体患者获得器官。由于有了精确的检测技术,临床很多高群体反应性抗体患者仍可以接受移植。如某受者其抗原为 A2,A3,B18,血清中检测出抗 HLA-A1、A11、A23、A24、A29、A30、A66、A68、B8、B13、B38、B44、B45和 B53抗体。如果供者器官的抗原是A31、A33、B46和B51,则受者不存在相关抗体,移植后发生排斥反应的概率会很低。
1 Richmond C.Jean Dausset[J].Lancet,2009,374(9698):1324.
2 Terasaki PI,Mcclelland JD.Microdroplet assay of human serum cytotoxins[J].Nature,1964,(204):998-1000.
3 Spellman S,Bray R,Rosen-Bronson S,et al.The detection of donor-directed,HLA-specific alloantibodies in recipients of unrelated hematopoietic cell transplantation is predictive of graft failure[J].Blood,2010,115(13):2704-2708.
4 Blume KG,Forman SJ,Applebaum JR,et al.Hematopoietic cell transplantation from HLA partially matched related donors[M]//Blume KG,Forman SJ,Applebaum JR.Thomas'Hematopoietic Cell Transplantation. 3rd ed. Boston:BlackwellScience, 2004:1116-1131.

