免疫和非免疫因素在角膜移植片慢性失功中的作用
高华 史伟云 张静静 王晔 谢立信
角膜移植已有百余年的历史,以往多数观点认为角膜移植术后主要是免疫因素(如急性排斥反应)影响角膜移植片的透明[1],但是近10年的研究发现,除了免疫因素外,非免疫因素也参与了该过程。临床上有很多角膜移植受者并未观察到明显的免疫排斥反应,但其移植片的透明度逐渐下降,最终发生角膜移植片慢性失功(chronic corneal allograft dysfunction,CCAD)[2]。即使是自体角膜移植,其术后不发生免疫排斥反应,角膜移植片内皮细胞密度同样呈超生理性下降[3]。所以推测角膜移植手术后免疫和非免疫因素都参与了CCAD的发生和发展。本研究主要通过检测小鼠CCAD模型角膜移植片中CD4+T淋巴细胞、F4/80、TGF-β、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、α 平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)表达,探讨免疫和非免疫因素在该过程中的作用。
1 材料与方法
1.1 建立小鼠CCAD模型
1.1.1 实验动物
BALB/c小鼠(H-2d)和C57BL/6小鼠(H-2b),雌雄各半,8周龄,购于中国医学科学院实验动物研究所。将雌性BALB/c小鼠与雄性C57BL/6小鼠杂交,获得CB6F1代(简称F1代)小鼠,见图1。

图1 雄性C57BL/6小鼠(中)与雌性BALB/c小鼠(右)杂交,获得抗原半相合CB6F1代(左)小鼠
1.1.2 实验分组和手术方法
实验共分为4组,每组18只小鼠。异系移植组供体为C57BL/6小鼠,F1代移植组供体为F1代小鼠,同系移植组供体为BALB/c小鼠,3组受体均为BALB/c小鼠;对照组为正常BALB/c小鼠。根据之前的研究,F1代移植组和同系移植组是与角膜移植后临床接近的小鼠CCAD模型[2],异系移植组和对照组主要用于对照研究。
手术前1 d用1%阿托品眼膏涂眼1次,盐酸氯胺酮注射液(34 mg)和盐酸氯丙嗪注射液(0.4~0.6 mg)混合液腹腔内注射麻醉,行穿透角膜移植(penetrating keratoplasty,PK),移植片与植床直径分别为2.5 mm 和2.0 mm,11-0 尼龙线(Mani缝线)间断缝合8针,无菌空气形成前房。涂0.3%妥布霉素眼膏,10-0缝线间断1~2针缝合眼睑。
1.2 术后观察和检测指标
1.2.1 角膜移植片观察
PK术后3 d拆除眼睑缝线,用裂隙灯显微镜观察角膜移植片透明情况。所有小鼠每周观察2次,观察时间大于100 d,主要记录免疫排斥反应发生和角膜移植片透明情况。角膜移植片评分指标如下:0分代表移植片透明;1分代表微小的表浅非间质混浊,透过角膜可见瞳孔缘和虹膜血管;2分代表微小深在的间质性混浊,瞳孔缘和虹膜血管可见;3分代表中等程度的间质混浊,仅瞳孔缘可见;4分代表大片的间质混浊,仅部分瞳孔缘可见;5分代表非常大的间质混浊,前房不可见。如小鼠PK术后移植片评分 >2分,判定为移植失败[4-5]。
1.2.2 免疫组织化学检查
分别在PK术后3周、2个月、3个月随机从各组抽取2只小鼠。颈椎脱臼法处死小鼠后取右侧眼球,置于冷冻胶中-80℃包埋,冷冻切片机做6 μm厚连续切片,室温干燥60 min,免疫组织化学法检测CD4+T淋巴细胞、F4/80(英国Serotec公司)、TGF-β(美国Santa Cruz公司)、bFGF和 α-SMA(武汉博士德生物工程有限公司),免疫组织化学用二抗采用荧光标记(武汉博士德生物工程有限公司产品)。
1.2.3 反转录PCR检查
PK术后3周、2个月和3个月,分别从4组各随机选取1只小鼠。颈椎脱臼法处死小鼠,角巩膜剪沿角膜缘剪下角膜组织,之后将角膜组织剪成4部分提取总RNA,取约1 μg总RNA反转录合成cDNA,根据禽类成髓细胞病毒转录酶使用手册配置10 μL反应体系,反应条件为45℃ 30 min、99℃5 min、5℃ 5 min。取反转录反应产物,首先以巢式外层引物进行PCR,100 μL反应体系,共35个循环。1.5%琼脂糖凝胶电泳回收目的条带。总RNA分离试剂盒购自德国MN公司,引物购自上海生工生物工程技术服务有限公司,反转录PCR试剂盒购自Bio Basic Inc公司。引物F4/80和TGF-β序列分别如下:5-GGTATTGCTGCCTTGCCGTT-3和 5-TCCTCTGACACGTGAGCATC-3;5-TCCTGTAGACGTGTTCCAGA-3和5-TGCTTAGACGTGCAGGTCAA-3。结果采用Image J图像分析软件处理并作量化分析。
1.3 统计学处理
数据采用SPSS 11.5统计软件进行处理。正态分布的计量资料采用One-Way ANOVA检验,非正态分布的计量资料和计数资料组内比较采用Kruskal-Wallis检验,组间比较采用Mann-Whitney检验,P<0.05作为差异有统计学意义。
2 结果
2.1 各组CCAD发生情况
异系移植组在术后4周内发生角膜移植片混浊,同时伴有大量新生血管怒张长入移植片;在术后2周,角膜移植片混浊程度平均分超过2分,至术后4周评分接近4分,之后稍有下降,维持在3分左右。F1代移植组38.9%(7/18)小鼠在术后2~3个月内逐渐发生角膜移植片混浊,无明显新生血管长入角膜移植片;术后1周时角膜移植片评分超过1分,之后下降并在较低水平维持4周后缓慢上升,至术后100 d,角膜移植片平均评分2分。同系移植组角膜移植片功能虽然有下降,22.2%(4/18)的小鼠上皮下轻度混浊,但始终未发生2级及以上角膜移植片混浊;术后1周时角膜移植片评分1分,之后下降并始终维持在较低水平,始终未超过1分。对照组角膜始终透明,移植片评分始终为零。4组角膜移植片评分情况详见图2,各时间点组间比较差异均有统计学意义(均P<0.001)。

图2 各组移植后角膜移植片评分变化
2.2 各组角膜移植片组织CD4+T淋巴细胞浸润情况
术后3周,异系移植组角膜移植片基质见大量CD4+T淋巴细胞浸润(图3A1),而此时F1代和同系移植组偶见 CD4+T淋巴细胞浸润(图3B1,3C1),对照组未见CD4+T淋巴细胞浸润(图3D1)。术后2个月,异系移植组角膜移植片基质内仍然可见较多CD4+T淋巴细胞浸润(图3A2),较3周时减少;F1代移植组、同系移植组及对照组未见CD4+T淋巴细胞浸润(图3B2、C2、D2)。术后3个月,除异系移植组角膜移植片基质内偶见CD4+T淋巴细胞外(图3A3),其余各组均未见CD4+T淋巴细胞浸润(图3B3、C3、D3)。
2.3 各组角膜移植片组织F4/80表达情况
异系移植组移植后3周、2个月及3个月移植片基质层F4/80表达均为阳性,阳性细胞呈细索样、梭形或多型性分布(见图4A)。F1代移植组和同系移植组各时间点角膜移植片基质层F4/80均有表达,表达强度较异系移植组弱(见图4B、C)。对照组角膜缘基质层可见到F4/80表达,角膜中央深基质层偶见F4/80表达(见图4D)。
移植片组织反转录PCR检测显示,各移植组均表达F4/80:异系移植组术后3周表达较弱,2个月和3个月时表达增强;F1代移植组3周和2个月时表达较弱,术后3个月时表达较强;同系移植组术后各时间点表达均较弱;对照组各时间点未见F4/80表达。量化分析结果见图5。

图3 各组移植后3周、2个月、3个月角膜移植片基质CD4+T淋巴细胞表达情况(荧光染色 ×200)
2.4 各组角膜移植片组织TGF-β表达情况
TGF-β阳性表达组织呈现细索样亮荧光。各组角膜上皮层均可以见到TGF-β表达。移植后各组不同时间点均有TGF-β表达,术后3周、2个月表达较强(见图6A、B、C),术后3个月表达减弱。对照组角膜基质及内皮层未见TGF-β表达(见图6D)。

图4 各组移植后2个月角膜移植片F4/80表达情况(荧光染色 ×200)
反转录PCR定量检测显示,各组不同时间点TGF-β均有表达,异系移植组和F1代移植组术后3周或2个月表达量较高,术后3个月表达量明显下降;同系移植组术后3周TGF-β表达量较高,术后2个月和3个月时TGF-β表达量下降。对照组各时间点TGF-β均呈低表达。量化分析结果见图7。

图5 各组移植后3周、2个月、3个月角膜移植片F4/80表达结果:移植各组早期表达均较弱,之后有增强;对照组始终不表达
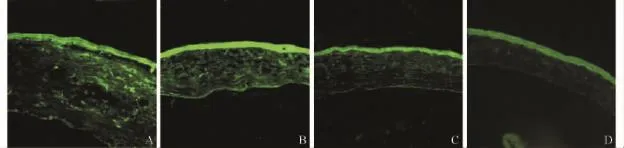
图6 各组移植后2个月角膜移植片TGF-β表达情况(荧光染色 ×200)
2.5 各组角膜移植片组织bFGF表达情况
bFGF阳性表达呈现细索样亮荧光。异系移植组角膜基质内可见bFGF表达(见图8A),F1代移植组和同系移植组偶见表达(见图8B、8C),对照组未见表达(见图8D)。
2.6 各组角膜移植片组织α-SMA阳性表达情况
异系移植组术后3周移植片未见α-SMA表达,术后2个月和3个月时出现α-SMA表达,阳性表达呈细索样亮荧光(见图9A);F1代移植组术后3周、2个月时无明显表达,3个月时角膜基质内出现表达(见图9B);同系移植组术后3周、2个月时无明显表达,3个月角膜基质少量表达(见图9C);对照组小鼠角膜各层细胞α-SMA未见表达(见图9D)。

图7 各组移植后3周、2个月、3个月角膜移植片TGF-β表达结果:各组早期表达较强,之后有减弱,对照组始终在较低水平

图8 各组移植后2个月角膜移植片bFGF表达情况(荧光染色 ×200)

图9 各组移植后3个月角膜移植片α-SMA表达情况(荧光染色 ×200)
3 讨论
同种异体角膜供体组织移植给受者后,受者的免疫系统可以对异体抗原进行识别,或者因为手术损伤和周围微环境改变都可能使移植物处于应激状态,导致移植物功能缓慢受损和下降[1-3]。所以,推测角膜移植术后免疫和非免疫因素都可能参与了移植物慢性失功的发生和发展。
免疫反应是指机体受到抗原刺激后,体内抗原特异性淋巴细胞在抗原呈递细胞的作用下识别抗原分子、活化、增殖、分化,并表现出一定生物学效应的过程。宫华青[6]和 Bell[7]等对发生慢性失功角膜移移植片的超微结构观察并没有发现免疫排斥反应的证据。先前的研究之所以不能证明免疫因素是否参与了CCAD的过程,主要原因是不能获得临床慢性失功过程中的角膜标本,而利用建立的小鼠CCAD模型可以很方便地对该过程进行动态观察[5]。本实验结果显示,异系移植组在术后2~3周移植片发生混浊时,移植片中有大量CD4+T淋巴细胞浸润。说明此时移植片发生急性排斥反应。F1代移植组和同系移植组术后3周时角膜移植片透明,移植片中偶见或见不到T淋巴细胞浸润。F4/80是抗原呈递细胞(成熟的单核/巨噬细胞)的表面标志。本研究CCAD模型的角膜移植片组织见到较多抗原呈递细胞,提示供受者之间的主要组织相容性较异系移植组供受体接近,抗原量尚不足以引起大量的致敏淋巴细胞浸润和临床可见的急性排斥反应。但少量淋巴细胞和抗原呈递细胞浸润仍可能会造成临床上难以发现的慢性排斥反应,而这种慢性损害会对移植片产生影响,并导致其功能缓慢逐渐下降。
此外各组小鼠角膜移植片中的抗原呈递细胞随着移植免疫原性减弱表达减少,也说明免疫因素参与了CCAD的发生和发展。由于F1代移植组和同系移植组供体的组织相容性与受体接近,所以抗原呈递细胞募集的致敏淋巴细胞不足以引起临床可见的急性排斥反应,但可能会通过抗原呈递细胞及浸润等免疫细胞异常分泌细胞因子来改变角膜移植片所处的微环境,从而导致移植片功能缓慢下降。
全身实体器官移植术后的研究表明非免疫因素也参与了移植物慢性失功的发生和发展[8]。本研究也提示非免疫因素相关的细胞因子如TGF-β、bFGF等,可能在CCAD过程中发挥重要的作用。TGF-β和bFGF都是很强的致纤维化因子[9],可诱导细胞凋亡和细胞外基质积聚,α-SMA是成纤维细胞的表面标志。TGF-β和bFGF的表达与随后的α-SMA表达提示纤维增殖在CCAD过程中可能发挥了重要的作用,角膜基质细胞或内皮细胞在异常细胞因子状态下激活可能与角膜内纤维异常形成相关。
电镜观察发现,临床慢性失功角膜移植片的内皮细胞层和后弹力层之间有异常增生的纤维样结构[6]。当角膜内皮细胞处于疾病或不稳定状态时,分泌的后弹力层会出现纤维增殖样改变[10]。本研究观察到的后弹力层与内皮细胞层之间的板层纤维样改变提示角膜移植后内皮细胞可能长期处于不稳定或病理状态,最终导致内皮细胞萎缩退化而逐渐丧失功能。这种不稳定状态可能与TGF-β、bFGF等细胞因子在移植后异常表达有关。移植片基质细胞和内皮细胞在异常表达细胞因子的作用下,表型向成纤维细胞转化,或者在异常细胞因子的作用下分泌异常的后弹力层。如此反复,最终导致内皮细胞功能超生理性下降和角膜内纤维细胞异常增殖,表现为移植物功能缓慢下降。
角膜移植术后免疫和非免疫相关因素在CCAD发展过程中的作用并不能完全分开,二者之间有联系。如抗原呈递细胞可以在存在异常抗原的情况下聚集,而非特异性的炎症也能诱发其表达增多[11]。非特异性的细胞因子TGF-β、bFGF等可以在发生抗原呈递细胞聚集时表达异常增多,而手术的刺激和炎症细胞浸润以及微环境改变等都可能使其表达异常。因此,免疫因素和非免疫因素在CCAD发生发展的过程中可能存在交互作用,最终导致CCAD。
通过本研究可以得出以下初步结论:免疫因素和非免疫因素均参与了CCAD的发生和发展。移植术后抗原依赖性免疫细胞浸润,非抗原依赖性炎症细胞浸润及各种细胞因子异常表达在CCAD的发生过程中可能发挥了重要的作用。
1 Panda A,Vanathi M,Kumar A,et al.Corneal graft rejection[J].Surv Ophthalmol,2007,52(4):375-396.
2 高华,曲利军,张菊,等.再次穿透性角膜移植原因临床分析[J].中华移植杂志:电子版,2009,3(3):195-199.
3 Matsuda M,Manabe R.The corneal endothelium following autokeratoplasty.A case report[J].Acta Ophthalmol(Copenh),1988,66(1):54-57.
4 Cursiefen C,Cao J,Chen L,et al.Inhibition of hemangiogenesis and lymphangiogenesis after normal-risk corneal transplantation by neutralizing VEGF promotes graft survival[J].Invest Ophthalmol Vis Sci,2004,45(8):2666-2673.
5 Gao H,Shi W,Gong H,et al.Establishment of a murine model of chronic corneal allograft dysfunction[J].Graefes Arch Clin Exp Ophthalmol,2010,248(10):1437-1445.
6 宫华青,高华,谢立信,等.穿透性角膜移植术后慢性失功移移植片的超微结构观察[J].中华眼科杂志,2007,43(4):307-312.
7 Bell KD,Campbell RJ,Bourne WM.Pathology of late endothelial failure:late endothelial failure of penetrating keratoplasty:study with light and electron microscopy[J].Cornea,2000,19(1):40-46.
8 Schmid C,Heemann U,Tilney NL.Retransplantation reverses mononuclear infiltration but not myointimal proliferation in a rat model of chronic cardiac allograft rejection[J].Transplantation,1996,61(12):1695-1699.
9 Chujo S,Shirasaki F,Kondo-Miyazaki M,et al.Role of connective tissue growth factor and its interaction with basic fibroblast growth factor and macrophage chemoattractant protein-1 in skin fibrosis[J].J Cell Physiol,2009,220(1):189-195.
10 Bourne WM.Biology of the corneal endothelium in health and disease[J].Eye,2003,17(8):912-918.
11 Dana MR.Corneal antigen-presenting cells:diversity,plasticity,and disguise:the Cogan lecture[J].Invest Ophthalmol Vis Sci,2004,45(3):722-727;721.

