BAPTA-AM对HepG-2细胞MT的保护作用及其机制
付再林,宋必卫,施水娟,杨 毅
(浙江工业大学药学院,浙江杭州 310014)
线粒体(mitochondria,MT)是细胞内氧化磷酸化主要场所,在维持细胞生命活动中起着极为重要的作用。MT的损伤可致细胞能量供应中断,MT内Ca2+超载,细胞内自由基水平升高,MT膜屏障功能减低甚至丧失,膜通透性增加、跨膜电位降低、细胞色素C释放等并激活下游凋亡信号通路[1-2]。这些改变将直接或间接导致细胞凋亡(apoptosis)和坏死(necrosis)[3]。大量细胞急性死亡是临床危、重、急症如急性肝衰竭、中风等病的共同病理基础,持续的细胞死亡是许多慢性疾病如帕金森病、老年性痴呆的发病且不断恶化的原因[4]。尽管在细胞死亡机制研究方面已有长足进步,但目前仍然缺乏减少细胞死亡的有效药物,抢救濒危细胞以挽回生命的药物为临床亟需。
钙超载是公认的细胞损伤、死亡的共同环节[5]。理论上,迅速降低细胞内钙,消除钙超载,逆转细胞死亡进程,是挽救濒危细胞可行手段。BAPTA-AM[1,2-bis(2-aminophenoxy)ethane-N,N,N'N'-tetraacetic acid]是一种进入细胞后活化的高效钙络合剂,广泛用于控制细胞内钙水平[5]。本研究以H2O2损伤HepG-2细胞,通过测定MT膜电位、细胞色素C的释放、Caspase-9及 ROS的激活等,观察BAPTA-AM对MT的保护作用,探讨其可能的作用机制,期望发现一种强有力的抢救濒危细胞药物。
1 材料与方法
1.1 材料
1.1.1试剂HepG-2细胞株购自南京凯基生物科技发展有限公司;BAPTA-AM由合肥恒星药物研究所提供;Rhodamine123、MTT购自Sigma公司;细胞色素C(CytC)酶联免疫分析(ELISA)试剂盒,购自Uscn-life公司;Caspase-9活性检测试剂盒、活性氧ROS检测试剂盒购自海门市碧云天生物技术研究所;RPMI 1640培养液、小牛血清、0.25%胰蛋白酶购自上海吉诺医药生物技术有限公司。
1.1.2仪器垂直流超净台(ESCO,SCV-4A1);CO2培养箱(Thermo Electron,Forma 3111);荧光显微镜(Leica Devices);酶标仪(Molecular Devices,Spectramax M2e);离心机(Heraeus,LDZ5-2)。
1.2 方法
1.2.1H2O2诱导HepG-2细胞损伤模型的建立[6-7]将细胞以 104/孔接种于 96 孔板,RPMI 1640培养液培养至细胞生长到70%~80%孔面积。加入终浓度 500 μmol·L-1的 H2O2,分别培养 0、3、6、9、12、15和 24 h,每组设 8 个复孔。MTT 法检测细胞活力:终止培养后加终浓度0.5%的MTT,37℃孵育4 h后DMSO溶解,酶标仪(λ=570 nm)记录各孔吸光度。
1.2.2BAPTA-AM对H2O2诱导HepG-2细胞损伤的影响细胞分为正常对照组、H2O2损伤组、BAPTA-AM(10-8-10-5mol·L-1)4 个保护组。每组8个复孔。保护组分别加入相应浓度的BAPTA-AM培养1 h后,模型组和各保护组均加入500 μmol·L-1H2O2,继续培养9 h,MTT法检测细胞活力。
1.2.3MT膜电位(MMP)的检测[6-7]Rh 123 为膜电位敏感的亲脂性阳离子荧光染料,能选择性地在活细胞MT内聚集,发出黄绿色荧光,其强度可以间接反映MT膜电位(MMP)的高低。细胞接种、分组与处理同“1.2.2”,每组设3个复孔。弃培养液,PBS清洗两次后加含100 μg·L-1Rh 123的无血清培养基中37℃孵育45 min,弃培养液,PBS清洗多次至背景较浅,荧光显微镜观察、拍照。
1.2.4胞质内细胞色素C(CytC)含量测定[6-7]细胞接种于6孔板中,分组与处理同“1.2.2”,收集细胞,PBS稀释使细胞浓度达到200万·ml-1。通过液氮反复冻融破坏细胞以释放出细胞内成份,离心10 min(10 000 r·min-1)收集上清,ELISA法测定CytC含量(按试剂盒说明书操作)。
1.2.5细胞内Caspase-9活性检测[6-7]细胞接种、分组与处理同“1.2.4”,收集细胞,按每200万细胞加入100 μl的比例加入裂解液,重悬沉淀,冰浴中裂解 15 min,4℃ 离心 15 min(15 000 r·min-1)。按试剂盒说明书检测Caspase-9催化底物Ac-LEHD-pNA(acetyl-Leu-Glu-His-Asp p-nitroanilide)产生的黄色pNA量,405 nm测定pNA吸光度确定Caspase-9的活性。
1.2.6细胞内活性氧(ROS)含量的测定[8]2',7'-二氯荧光乙酰乙酸盐(DCFH-DA)进入细胞后被胞内酯酶水解成不能透过细胞膜的DCFH,从而将探针载入胞内。胞内ROS可将无荧光的DCFH氧化成发出绿色荧光的DCF。其荧光的强弱可以间接反映细胞内ROS的水平。同“1.2.2”分组与处理,PBS清洗细胞两次,加 10 μmol·L-1DCFH-DA,37℃孵育30 min,弃 DCFH-DA,PBS清洗多次至背景较浅,荧光显微镜观察结果。
1.2.7统计学处理采用 GraphPad Prism 5.0软件,数据用±s表示,用One-way或Two-way ANOVA检测均数差异显著性。
2 结果
2.1 BAPTA-AM明显提高受H2O2攻击的HepG-2细胞活力H2O2作用细胞9 h,细胞活力仅为正常对照组的56.1%(Fig 1)。BAPTA-AM浓度依赖性地减轻细胞损伤,在10-6mmol·L-1时效果最佳(活力为93.4%),再增大剂量则作用有所减弱。
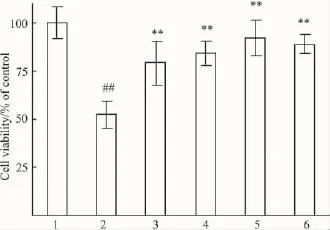
Fig 1 BAPTA-AM protects HepG-2 cells against H2O2-induced injury(MTT method,±s,n=8).
2.2 BAPTA-AM抗H2O2所致的MMP降低由Fig 2可见,H2O2攻击9 h使MT摄取Rh123能力降至正常细胞的7%,MMP崩溃。BAPTA-AM浓度依赖性防止MT对Rh123的摄取能力的溃损,浓度为10-6mol·L-1时作用最佳(与“2.1”结果一致),表明BAPTA-AM能有效减轻H2O2所致的MT损伤,稳定MMP,维持膜功能。
2.3BAPTA-AM明显抑制CytC的释放由Fig 3A可知H2O2攻击下胞质内CytC明显增加(由MT释放),12 h时累积量最大。随着损伤时间延长,细胞大量死亡、残留细胞少,故24 h测得的CytC量很低,因此以损伤12 h为观察药效时间点。BAPTAAM明显抑制 CytC的释放(Fig 3B),浓度为10-6mol·L-1时作用最佳,增加浓度作用反而减弱,与上述结果一致。
2.4BAPTA-AM防止Caspase-9激活Caspase-9的激活可反映出以MT为核心的内源性凋亡通路的激活程度。由Tab 1可知Caspase-9活性随时间延长而增高,6~12 h模型组Caspase-9催化产生的pNA量与正常对照组比较差异有显著性,表明损伤已激活Caspase-9,BAPTA-AM明显抑制Caspase-9激活,10-7mol·L-1时 Caspase-9 的活性已近正常对照组水平,随着浓度增加 Caspase-9的活性可降低至正常基础值以下。

Tab 1 BAPTA-AM prevents the activation of caspase-9 induced by H2O2attack in HepG-2 cells(n=3)

Fig 2 Mitochondrial membrane potential(MMP)labeled with rhodamine123 and detected by fluorescence microscope.BAPTAAM protects mitochondrial membrane against MMP drop induced by H2O2injury.
2.5BAPTA-AM抑制ROS的产生由Fig 4可见细胞损伤(模型组)大量生成ROS,BAPTA-AM浓度依赖性减少ROS的产生,从而抑制ROS对细胞的损伤。
3 讨论
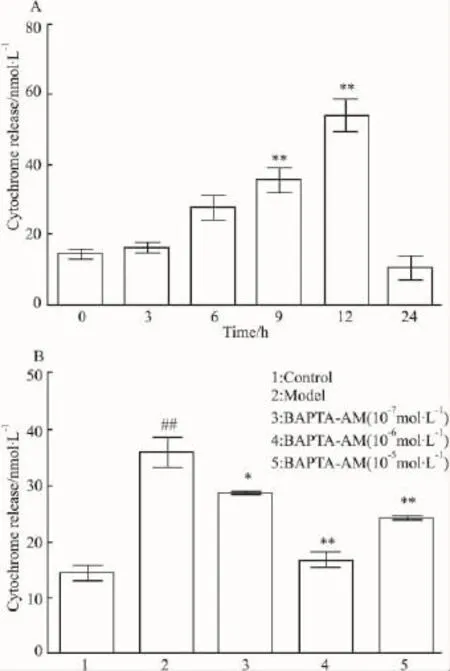
Fig 3 Inhibitory effect of BAPTA-AM on cytochrome C(CytC)release from mitochondria induced by H2O2attack(±s,n=3).
MT和Ca2+超载在细胞死亡中的作用 MT是细胞有氧代谢中心和能量供应站,也是ROS产生中心。MT结构和功能的完整是细胞正常生命活动的前提。缺血缺氧致代谢和能量障碍、炎症、化学毒性攻击等损伤因素均可损伤MT。能量障碍使离子转运失常,形成Ca2+超载。Ca2+超载的危害:(1)刺激ROS过度生成,攻击膜、蛋白质、核酸,致细胞损伤并加重钙超载,形成恶性循环;(2)MT电子传递和ATP生成脱偶联,加重能量障碍;(3)Ca2+和ROS共同作用,在MT内膜形成通透性转换孔(mitochondrial permeability transition pore,MPTP),膜通透性高,造成MT肿胀,ATP耗竭,膜电位降低,引起细胞凋亡和坏死;同时MT外膜形成大孔径的凋亡诱导通道(mitochondrialapoptosis-induced channel,MAC),CytC经此通道释放到细胞质,与Apaf-1蛋白结合后,再寡聚成凋亡小体,激活Caspase-9,始动凋亡后期Caspases级联反应[9]。(4)直接或间接激活蛋白酶、核酸内切酶,如使细胞结构蛋白、核酸水解,细胞死亡[1]。(5)其它作用:例如Ca2+通过Calpain激活Caspase-12,启动内质网应激凋亡(apoptosis by ER stress)通路,通过促进ROS产生,激活应激致活蛋白激酶JNK信号通路产生凋亡与坏死(TNF-α-死亡受体信号亦参与该通路激活)等[10]。由于Ca2+可通过多种离子通道、转运蛋白、内源储库释放、直接通过损伤的膜等多种途径进入细胞质,Tymianski等认为必须采用多种阻滞药联合应用才能阻断Ca2+内流以保护细胞。
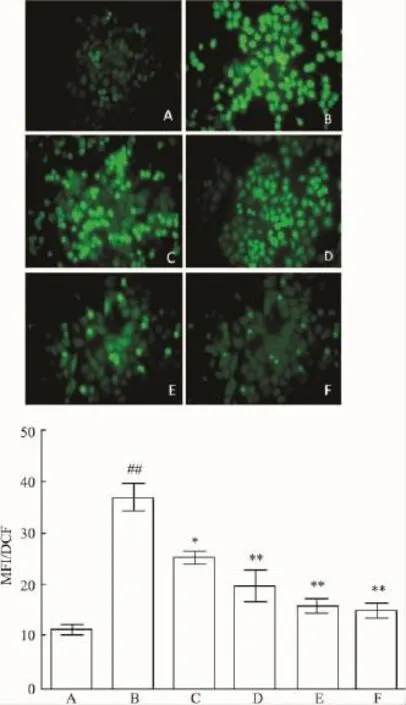
Fig 4 BAPTA-AM blocks the generation of ROS in HepG-2 cells induced by H2O2attack.
BAPTA-AM的优势[11]:(1)目前临床可用的钙拮抗剂只能选择性阻滞Ca2+自某一亚型钙通道内流,并且对已形成的细胞内Ca2+超载无作用,难当抗细胞死亡重任。(2)细胞凋亡、坏死机制复杂,涉及的信号通路和信号分子很多,仅阻断某一环节对改善全局帮助不大。(3)Ca2+超载在多环节参与细胞死亡信号过程。理论上,直接降低[Ca2+]i,迅速消除Ca2+超载,恢复细胞内Ca2+稳态,可在多环节协同产生高效有益作用,是目前最佳可选策略。(4)BAPTA-AM是一种快速高效的细胞内Ca2+络合剂,有效控制[Ca2+]i。是迅速消除Ca2+超载的最佳选择。
基于以上观点,我们致力于BAPTA-AM抗细胞损伤作用的研究,证实其确能多环节抗细胞死亡,结果令人兴奋:(1)BAPTA-AM能有效消除Ca2+超载[11],抗D-氨基半乳糖所致的肝细胞凋亡与坏死。细胞损伤后,[Ca2+]i明显升高;BAPTA-AM剂量依赖性降低受损细胞[Ca2+]i,浓度为 10-6mol·L-1时使受损细胞[Ca2+]i降低至正常细胞水平。(2)本文工作进一步证明BAPTA-AM可有效保护HepG-2细胞,减轻H2O2攻击所致的细胞活力下降,其机制包括:减少细胞ROS生成;减少MT损伤,维持膜电位;抑制CytC释放而抑制MT凋亡通路的激活;抑制Caspase-9激活。Caspase-9是MT凋亡通路起始物,其活性抑制表明该通路受到抑制。(3)我们有资料(另文发表)表明BAPTA-AM也明显抑制Caspase-8的激活,提示该药也能抑制凋亡的死亡受体通路。动物实验结果支持BAPTA-AM作用的高效性:静脉注射 BAPTA-AM 1-2.5 mg·kg-1,使 D-氨基半乳糖与内毒素(LPS)所致的极性肝衰竭小鼠死亡率大大降低。以上结果相互支持。文献报道[11]BAPTA-AM能抑制H2O2诱导的家兔肾近端小管细胞的死亡,减轻肺主动脉内皮细胞的氧化损伤,抑制Caspase-12和JNK的活化,逆转Cardiotoxin-Ⅲ的细胞毒性,使因大脑中动脉闭塞引起的脑梗死体积减小50.5%,均与本课题组工作一致。BAPTAAM对其它重要信号通路如TNF-α、Bcl蛋白、NF-κb也可能产生影响,我们将作进一步观察。就已有的结果看,BAPTA-AM作为抗细胞死亡、抢救濒危细胞药物,有良好的进一步研发前景。
[1]Szydlowska K,Tymianski M.Calcium,ischemia and excitotoxicity[J].Cell Calcium,2010,47(2):122-9.
[2]Rasheva V I,Domingos P M .Cellular responses to endoplasmic reticulum stress and apoptosis[J].Apoptosis,2009,14(8):996 -1007.
[3]Roy S S,Hajnóczky G.Calcium,mitochondria and apoptosis studied by fluorescence measurements[J].Method,2008,46(3):213-23.
[4]Talukder M A,Zweier J L,Periasamy M.Targeting calcium transport in ischaemic heart disease[J].Cardiovasc Res,2009,84(3):345-52.
[5]Spigelman I,Tymianski M,Wallace C M,et al.Modulation of hippocampal synaptic transmission by low concentrations of cell permeant calcium chelators:effects of calcium affinity,structure and binding kinetics[J].J Neurosci,1996,75(2):559 - 72.
[6]Cai L,Wang H,Li Q,et al.Salidroside inhibits H2O2-induced apoptosis in PC12 cells by preventing cytochrome c release and inactivating of caspase cascade[J].Acta Biochim Biophys Sin,2008,40(9):796-802.
[7]匡 荣,孙意国,邓同乐,等.松果菊苷对过氧化氢损伤的PC12细胞的保护作用及机制研究[J].中国药理学通报,2009,25(4):515 -8.
[7]Kuang R,Sun Y G,Deng T L,et al.The protective effect and mechanisms of echinacoside on H2O2-injured PC12 cells[J].Chin Pharmacol Bull,2009,25(4):515 -8.
[8]Zhou Y J,Zhang S P,Liu C W,et al.The protection of selenium on ROS mediated-apoptosis by mitochondria dysfunction in cadmium-induced LLC-PK1 cells[J].Toxicol in Vitro,2009,23(2):288-94.
[9]Kinnally K W,Antonsson B.A tale of two mitochondrial channels,MAC and PTP,in apoptosis[J].Apoptosis,2007,12(5):857-68.
[10]Shen H M,Liu Z G.JNK signaling pathway is a key modulator in cell death mediated by reactive oxygen and nitrogen species[J].Free Rad Biol Med,2006,40(6):928-39.
[11]宋必卫,储昭兴.BAPTA-AM的研究现状[J].中国药理学通报,2009,25(7):851 -3
[11]Song B W,Chu Z X.The research progress of BAPTA-AM[J].Chin Pharmacol Bull,2009,25(7):851 -3.
[12]蔡 雁,付再林,顾喜燕,等.BAPTA-AM抗D-GalN致L-O2细胞损伤作用[J].浙江工业大学学报,2010,38(3):326-31.
[12]Cai Y,Fu Z L,Gu X Y,et al.Protective effects and mechanism of BAPTA-AM on D-galactosmine-induced injury of L-O2 cells[J].J Zhejiang Univ Technol,2010,38(3):326 -31.

