PI3K-Akt-mTOR信号通路对Foxp3基因表达的影响
葛圣林,彭磊磊,张成鑫
(安徽医科大学第一附属医院心脏血管外科,安徽合肥 230022)
调节性T细胞(CD4+CD25+T细胞)是一类具有免疫抑制功能的细胞,在正常机体维持T淋巴细胞动态平衡和免疫耐受机制中扮演重要角色。由于调节性T细胞具有免疫抑制这种特殊功能,可能为抑制免疫排斥反应及诱导免疫耐受开辟一条新的道路,因此受到各国器官移植学家的极大关注。Foxp3是调节性T细胞的特异性功能基因,其在调节性T细胞的表型、发育和功能中起决定性作用[1-2]。Foxp3的调控受多种细胞因子(如 CD28、IL-2、CTLA-4和TGF-β等)及TCR信号的影响,与磷脂酰肌醇3激酶/蛋白激酶B/哺乳动物雷帕霉素靶体蛋白(PI3K-Akt-mTOR)信号通路之间有无联系目前鲜有报道。本实验将研究PI3K-Akt-mTOR信号通路对Foxp3基因表达的影响并探讨两者之间是否具有相关性。
1 材料与方法
1.1实验动物SPF级昆明系小鼠60只,♂性,体重(20±2)g,由安徽医科大学动物中心提供。
1.2主要药物及试剂雷帕霉素(rapamycin,RAPA)购自福建科瑞药业有限公司(产品批号:080601);FITC标记的抗小鼠CD4单克隆抗体及匹配的同型对照(Cat:BM0401,Lot:E033698),PE 标记的抗小鼠CD25单克隆抗体及匹配的同型对照(Cat:EM2504,Lot:E021463)购自美国 ebioscience公司,兔抗小鼠p-mTOR(S2448)单克隆抗体购自美国Bioworld公司(Cat:BS4706),免疫组织化学SP法染色试剂盒购自北京中杉金桥生物技术有限公司,TRIzol溶液购自美国 Invitrogen公司(Cat:1401902),逆转录试剂盒购自美国 Promega公司(Cat:261785)。
1.3主要仪器EPICS XL-MCL(4C)型流式细胞仪(美国Beckman-Coulter公司生产),Z-300型低速台式离心机(德国HERMLE公司生产),显微镜(Nikon,ECLIPSE 80i,Japan),形态学图像分析系统(JEDR 801D),Tgradient PCR仪(德国Biometra公司生产)。
1.4实验方法将60只小鼠随机分为对照组和实验组,每组15只,饲养在SPF级饲养柜中,饮用水和饲料均经灭菌处理。根据小鼠和人实验剂量换算关系,按照成人的维持治疗剂量2 mg·d-1,实验组(C)每只小鼠灌胃 RAPA 0.4 mg·d-1[3],实验组(B、D)分别用较低剂量(0.2 mg·d-1)和较高剂量(0.6 mg·d-1)RAPA灌胃,对照组(A)每天予以无菌生理盐水灌胃,共3周。戊巴比妥腹腔注射麻醉,无菌条件下心脏采血,EDTA抗凝,用于流式细胞仪检测;分离脾脏,取1/2研磨,过200目金属滤网,RPMI 1640培养液重新悬浮细胞,制备脾细胞悬液1010·L-1;另 1/2脾脏用于 Foxp3 mRNA RT-PCR及P-mTOR蛋白的测定。
1.5CD4+CD25+T细胞的百分比测定分别取100 μl EDTA抗凝血和脾细胞悬液,加入5 μl FITC标记的抗小鼠CD4单克隆抗体及5 μl PE标记的抗小鼠CD25单克隆抗体,混匀后室温避光孵育30 min,加入溶血剂后室温放置10 min至透明,2 000 r·min-1离心5 min,弃上清,PBS再洗涤2次,加入500 μl PBS混匀,上流式细胞仪检测。同时设立相应的同型对照管。
1.6P-mTOR蛋白的测定及结果评定标准实验步骤严格按照试剂盒说明书操作,石蜡切片经常规脱蜡,梯度酒精水化,0.01 mol·L-1(pH 7.2)枸橼酸盐缓冲液修复抗原,用3%H2O2去离子水室温孵育10 min,PBS液冲洗3次,滴加山羊血清工作液室温孵育30 min后加入一抗(p-mTOR工作液浓度为1∶100)后4℃过夜,PBS液冲洗3次,滴加生物素化二抗工作液后室温孵育30 min,PBS液冲洗3次,DAB显色,自来水充分冲洗,封片,镜检。阳性对照采用已知阳性片为标准,阴性对照采用PBS液代替一抗为标准,其余步骤相同。P-mT0R蛋白主要表达于胞质,阳性染色为浅黄色、棕黄色或棕褐色。采用JEDR 801D形态学图像分析系统对P-mT0R蛋白表达进行定量分析,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性反应的平均光密度。以每例5个视野的平均光密度的平均值作为该例的测量值。
1.7Foxp3 mRNA RT-PCR测定取100 mg脾脏组织,用 TRIzol法常规提取淋巴细胞总 RNA,Foxp3 mRNA特异引物做RT-PCR反应,引物由美国Invitrogen公司设计与合成。扩增目的基因在琼脂糖凝胶上电泳,上游物:5'-ACACCCAGGAAAGACAGC-3',下游引物:5'-CGAACATGCGAGTAAACC-3',扩增片段592bp。在紫外分析仪上观察结果,同时设Beta-actin作为内参照,扩增片段上游引物:5'-GACCTTCAACACCCCAG-3',下 游 引 物:5'-GTCACGCACGATTTCCC-3',扩增片段259bp。凝胶扫描成像系统记录电泳结果。采用Imagemaster VDS(Pharmacia Biotech)图像分析软件分析光密度值,以Foxp3/β-actin光密度比值来表示Foxp3mRNA表达水平。
1.8统计学分析采用SPSS11.0统计软件对数据进行统计分析,计量资料以±s表示。4组间比较采用单因素方差分析,同时采用LSD法进行两两比较;关联分析用Spearman秩相关分析。Foxp3mRNA和p-mTOR蛋白两指标之间用pearson相关分析其是否具有相关性。
2 结果
2.1CD4+CD25+T细胞百分比实验组(B、C、D)小鼠外周血和脾细胞中CD4+CD25+Treg细胞水平分别为(9.62±1.43、13.76±1.97、15.41±2.45)%和(12.23±4.56、23.03±6.18、25.17±6.42)%,对照组(A)小鼠外周血和脾细胞中 CD4+CD25+Treg细胞水平分别为(3.52±0.65)%和(6.53±3.01)%,无论是在外周血还是脾细胞中,B、C、D组CD4+CD25+Treg细胞水平明显高于A组(P<0.05),C、D组与B组之间CD4+CD25+Treg细胞水平也有差异(P<0.05),C组和D组之间CD4+CD25+Treg细胞水平无差异(P>0.05),见Tab 1。
Tab 1 Proportion of CD4+CD25+Treg cells in peripheral blood and spleen cells of mice(% ,±s)
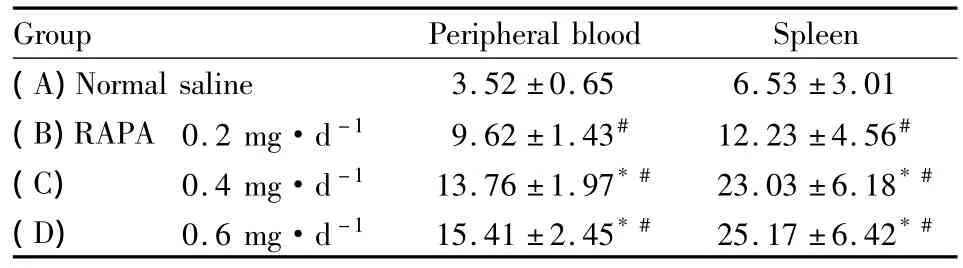
Tab 1 Proportion of CD4+CD25+Treg cells in peripheral blood and spleen cells of mice(% ,±s)
In peripheral blood,the comparison among four groups general F=39.971,P=0.000;*P <0.05 vs B;#P <0.05 vs A.Spearman rank correlation:r=0.749,P <0.01In spleen cells,the comparison among four groups general F=30.775,P=0.000.Spearman rank correlation:r=0.762,P <0.01
Group Peripheral blood Spleen(A)Normal saline 3.52 ±0.65 6.53 ±3.01(B)RAPA 0.2 mg·d-1 9.62 ±1.43# 12.23 ±4.56#(C)0.4 mg·d-1 13.76 ±1.97*# 23.03 ±6.18*#(D)0.6 mg·d-1 15.41 ±2.45*# 25.17 ±6.42*#
2.2P-mTOR蛋白在脾脏中的表达P-mT0R蛋白的阳性表达主要位于脾细胞胞质,图像分析结果显示,实验组(B、C、D)小鼠脾脏中P-mT0R蛋白表达的平均光密度分别为(0.2326±0.0431、0.1156±0.0223、0.0556±0.0041),对照组 A 为(0.4223 ±0.0534),B、C、D组平均光密度均明显低于A组(P<0.05),C、D组与B组之间平均光密度也有差异(P<0.05),C组和D组之间平均光密度无差异(P>0.05),见 Fig 1及 Tab 2。
2.3Foxp3表达实验组(B、C、D)小鼠脾脏中Foxp3/β-actin光密度比值分别为(0.4853±0.0574、0.7886 ±0.1085、0.9639 ±0.2015),对照组A为(0.1345±0.0271),见Fig 2及Tab 2。
3 讨论
PI3K-Akt-mTOR信号通路参与细胞增殖、凋亡和分化等多种细胞功能的调节,此信号通路激活后可促进细胞周期运行,使细胞增殖,过度激活可使细胞生存与凋亡失衡,正常细胞发生恶性转化,恶性肿瘤侵袭及转移。哺乳动物雷帕霉素靶蛋白是一种丝氨酸/苏氨酸蛋白激酶,是Akt的下游信号,是调控PI3K/Akt途径的关键因子[4],在细胞的增殖、分化过程中起着中心调控点的作用[5-6]。mTOR 通过PI3K-Akt途径被Akt直接磷酸化而激活,其磷酸化形式(p-mTOR)是mTOR在PI3K-Akt-mTOR信号通路中的激活状态,研究显示mTOR的ser2448磷酸化,是mTOR信号通路被激活的生物学标志,而总mTOR却不能很好反映mTOR信号通路的激活状态[7-8],因此本实验选取 p-mTOR(ser2448)蛋白作为研究指标。激活的mTOR随后磷酸化它的两个下游分子(4E-BP1、p70S6K),使细胞产生生物学效应[9]。雷帕霉素是mTOR的特异抑制剂,RAPA进入细胞后在细胞质中首先与FK506结合蛋白(FKBP)结合形成FKBP12-RAPA复合物,此复合物再与mTOR氨基酸残基2025-2114区结合导致mTOR不能被磷酸化,从而抑制mTOR的生物学功能。研究表明RAPA可以促进CD4+CD25+Treg细胞增长并维持其功能,同时减少 CD4+CD25-效应性 T细胞(effector T cell,Teff)的数量[10-11],因此深入研究mTOR及其信号通路,可能会为诱导免疫耐受提供新的思路和方法。

Fig 1 Expression of protein p-mTOR in spleen cells of mice

Fig 2 Expression of Foxp3 mRNA in spleen cells of mice
Tab 2 Expression of Foxp3 mRNA and protein p-mTOR in spleen cells of mice(%,±s)

Tab 2 Expression of Foxp3 mRNA and protein p-mTOR in spleen cells of mice(%,±s)
For average optical density of p-mTOR,the comparison among four groups general F=19.875,P=0.000.Spearman rank correlation:r= -0.968,P <0.01For the ratio of optical density between Foxp3 and β-ctin,the comparison among four groups general F=12.139,P=0.000;#P <0.05 vs A:*P <0.05 vs B.Spearman rank correlation:r=0.868,P <0.01Two index about average optical of p-mTOR and the ratio of optical density between Foxp3 and β-actin were analysized by Pearson rank correlation:r= -0.993,P<0.01
Group Foxp3/β-actin Average optical density of p-mTOR(A)Normal saline 0.1345 ±0.0271 0.4223 ±0.0534(B)RAPA 0.2 mg·d -1 0.4853 ±0.0574# 0.2326 ±0.0431#(C)0.4 mg·d -1 0.7886 ±0.1085#*0.1156 ±0.0223#*(D)0.6 mg·d -1 0.9639 ±0.2015#*0.0556 ±0.0041#*
本实验结果发现,在RAPA 3种使用剂量情况下,随着RAPA使用剂量逐步加大,p-mTOR的阳性率逐渐降低,说明PI3K-Akt-mTOR信号通路不同程度地被RAPA所抑制;同时,Foxp3 mRNA的表达也不同程度地增强,CD4+CD25+Treg细胞占CD4+T细胞的百分比逐渐增高。对外周血及脾细胞中CD4+CD25+Treg细胞水平均进行Spearman秩相关分析,结果显示CD4+CD25+Treg细胞水平与RAPA给药剂量呈正相关(外周血组:r=0.749,P<0.01;脾细胞组:r=0.762,P<0.01),说明在一定的RAPA给药剂量范围内可以通过增加其给药剂量来提高CD4+CD25+Treg细胞占CD4+T细胞的百分比。虽然C组和D组之间无差异,但D组较C组也有增高的趋势,可能在进一步增大RAPA的给药剂量后就会表现出差异。通过对Foxp3mRNA和p-mTOR蛋白两指标(Foxp3/β-actin光密度比值及平均光密度)之间相关性分析发现二者之间存在负相关(r=-0.993,P<0.01),p-mTOR蛋白表达的平均光密度随着雷帕霉素用量的增加而降低说明PI3K-AktmTOR信号通路被逐步的抑制,尔后Foxp3mRNA的表达逐渐增强,由此我们可以推出抑制PI3K-AktmTOR信号通路可以使Foxp3的表达增强,且Foxp3的表达程度与PI3K-Akt-mTOR信号通路的激活程度呈负相关。
在以往的研究中,人们逐渐发现mTOR信号通路在调控天然免疫和适应性免疫反应中起着重要作用。虽然抑制mTOR在一些免疫抑制试验计划中得到开发,但RAPA在体内的免疫抑制机制仍然不明确。目前,科学家已对PI3K-Akt-mTOR信号通路和Treg细胞生长分化之间的关系给出自己的观点,Feuerer等[12]认为激活 PI3K-Akt-mTOR信号通路会抑制 Treg细胞的分化,Strauss等[13]也认为 PI3KAkt-mTOR信号通路在CD4+Foxp3+Treg细胞生长分化中起着重要作用。通过本实验可发现抑制PI3K-Akt-mTOR信号通路会促使CD4+CD25+Treg细胞特异性基因Foxp3的表达增强,最终影响小鼠体内CD4+CD25+Treg细胞含量的不同,这为我们进一步研究RAPA诱导Foxp3表达的具体机制提供了一条新的思路,此外mTOR已经被确定是PI3KAkt的下游靶点,抑制PI3K-Akt-mTOR信号通路的这一成分,对于我们在临床工作中诱导免疫耐受也具有积极意义。
[1]Lauren E M,Youhai H C.Maintaining immunological tolerance with Foxp3[J].Cell Research,2007,17:904 - 18.
[2]Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299:1057-61.
[3]杨明珍,吴德沛,岑建农,等.雷帕霉素诱导Balb/c小鼠CD4+CD25+foxp3+调节性T细胞增殖[J].中国药理学通报,2007,23(6):795 -9.
[3]Yang M Z,Wu D P,Cen J N,et al.Rapamycin induces Balb/c murine CD4+CD25+foxp3+T cells proliferations[J].Chin Pharmacol Bull,2007,23(6):795 -9.
[4]Hanaban D.Signaling vascular morphogenesis and maintenance[J].Science,1997,277(5322):27748 -50.
[5]Fingar D C,Blenis J.Target of rapamycin(TOR):an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cyele progression[J].Oncogene,2004,23(18):3151 -71.
[6]Pene F,Claessens Y E,Muller O,et al.Role of the phosphatidylinositol 3-kinase/Akt and mTOR/P70S6-kinase pathways in the proliferation and apoptosis in multiple myeloma[J].Oncogene,2002,21:6587 -97.
[7]Reynolds T H 4th,Bodine S C,Lawrence J C Jr.Contro1 of Ser2448 phosphorylation in the mammalian target of rapamycin by insulin and skeletal muscle load[J].J Biol Chem,2002,277:17657-62.
[8]Sahin F,Kannangai R,Adegbola O,et al.mTOR and P70S6 kinase expression in primary liver neoplasms[J].Clin Cancer Res,2004,10:8421-25.
[9]Sandsmark D K,Pelletier C,Weber J D,et al.Mammalian target of rapamyein:master regulator of cell growth in the nervous system[J].Histol Histopathol,2007,22(8):895 -903.
[10]Strauss L,Whiteside T L,Knights A,et al.Selective survival of naturally occurring human CD4+CD25+FoxP3+regulatory T cells cultured with rapamycin[J].J Immunol,2007,178(1):320-9.
[11]Battaglia M,Stabilini A,Migliavacca B,et al.Rapamycin promotes expansion of functional CD4+CD25+FOXP3+regulatory T cells of both healthy subjects and type 1 diabetic patients[J].J Immunol,2006,177(12):8338 -47.
[12]Feuerer M,Hill J A,Mathis D,et al.Foxp3+regulatory T cells:differentiation,specification,subphenotypes[J].Nature Immunology,2009,10(7):689 -95.
[13]Strauss L,Czystowska M,Szajnik M,et al.Differential responses of human regulatory T cells(Treg)and effector T cells to rapamycin[J].PLoS ONE,2009,4(6):e5994.
——雷帕霉素

