对甲氧基肉桂醛左氧氟沙星酰腙诱导人肝癌SMMC-7721细胞凋亡的作用
付建民,王德辉,孙金平,康玉华,皇甫超申,胡国强,刘 彬
(河南大学1.护理学院神经生物学研究所、2.医学院、3.化学生物学研究所,河南开封 475004)
喹诺酮类抗菌药物主要的作用于细菌的DNA回旋酶(gyrase),影响细菌的复制和转录,抑制细菌增殖[1]。原核生物的DNA回旋酶与真核生物的拓扑异构酶Ⅱ(TopoisomeraseⅡ,TopoⅡ)具有同源性和功能相似性,而拓扑异构酶Ⅱ是许多重要的抗肿瘤药物细胞内的主要靶酶[2]。多年来人们一直试图通过改造喹诺酮抗菌药物的构效关系,寻求新型抗肿瘤药物。目前已有二环喹诺酮、三环喹诺酮、四环喹诺酮、手性喹诺酮抗有丝分裂的喹诺酮等,先后用于抗肿瘤活性的研究,但均因体内毒性或生物利用度或稳定性等问题而未进入临床评价。因此,寻找新结构的氟喹诺酮先导化合物已成为新的挑战。目前的研究发现,喹诺酮类化合物的C-3位羧基对于其抗菌活性是必需的,但并非是抗肿瘤活性所必要的,可被某些杂环或稠杂环等生物电子等排体取代,这为寻求新结构的抗肿瘤氟喹诺酮先导物提供了新的思路[3]。本课题组发现抗菌氟喹诺酮C-3位羧用酰腙电子等排体取代的化合物具有潜在的抗肿瘤活性。其中由左氧氟沙星衍生的化合物(S)N-(3-对甲氧基苯亚丙烯基-6-氟-7-(4-甲基哌嗪-1-基)-1,8-(3,1-丙氧基)-喹啉-4(1H)酮-3-甲酰肼(FQ-10,Fig 1)具有较强活性,IC50值达 4.40 μmol·L-1。为进一步了解该化合物抑制细胞增殖作用的机制,课题组利用人肝癌细胞株SMMC-7721,对该化合物抑制细胞的增殖的机制进行了初步研究,为进一步开发和应用提供实验依据。

Fig 1 Structure of(S)N-(3-p-methoxylphenyl)-6-fluoro-7-(4-methylpiperazin-1-yl)-1,8-(3,1-propoxy)-quinolin-4(1H)-one-3-carbonyl hydrazine
1 材料与方法
1.1 主要试剂与仪器
1.1.1诱导剂对甲氧基肉桂醛左氧氟沙星酰腙由河南大学药物化学研究所提供,HPLC法测定纯度>99%,溶解在二甲基亚砜(DMSO,Solarbi公司)中,浓度为1 ×10-2mol·L-1。
1.1.2细胞株和主要试剂人肝癌细胞系SMMC-7721购自中国医学科学院基础医学研究所,生长在含体积分数为0.1的胎牛血清(杭州四季青生物工程材料有限公司)的DMEM培养基(Gibco公司)中,置体积分数为0.05的CO2、37℃恒温培养。
四甲基偶氮唑盐(MTT),DeadEndTMFluorometric TUNELSystem(promega公司);caspase-9、caspase-8、caspase-3、p53、Bcl-2、Bax 抗体(碧云天公司);β-actin抗体(Santa Cruz公司)、HRP标记的羊抗兔IgG、DNA ladder抽提试剂盒;HRP标记的羊抗鼠IgG(中衫金桥公司);Hoechst 33258(Sigma公司)。其余试剂为国产分析纯产品。
1.1.3主要仪器二氧化碳培养箱(Thermo Forma,3121,USA);酶标仪(Thermo Multiskan Ascent,USA);BX51荧光显微镜(Olympus公司);DYY-7C型转移电泳仪;半干式电转装置;凝胶成像系统(北京六一仪器厂);高内涵活细胞成像系统(Thermo Fisher Scientific USA)。
1.2 方法
1.2.1 MTT法测定药物对细胞增殖的影响细胞以1×107·L-1浓度接种于96孔细胞培养板,加入不同浓度的FQ-10分别培养24、48、72 h后吸去培养液,每孔加入DMSO 0.15 ml振荡10 min,至蓝色结晶完全溶解,酶标仪测570 nm吸收度(A)值并计算抑制率。以含等体积的培养液和DMSO的无细胞孔测的吸光度值为空白对照。根据中效方程式[fa/fu=(D/Dm)m]计算出中效浓度(IC50)[4]。细胞生长抑制率/%=[1-(处理组吸收度-空白对照组吸收度)/(对照组吸收度-空白对照组吸收度)]×100%。
1.2.2 Hoechst 33258/PI双染色法观察细胞凋亡形态变化以1×107·L-1细胞数接种于放置盖玻片的六孔板,加入不同浓度的FQ-10培养24 h,去培养液后加入终浓度为5 mg·L-1的Hoechst33258避光染色10 min,再加入终浓度为15 mg·L-1的PI避光10 min,去染液,加入4%多聚甲醛4℃固定5 min,荧光显微镜下观察拍摄。
1.2.3 TUNEL法测定细胞凋亡率取1×107·L-1细胞数接种细胞于放置盖玻片的六孔板,用不同浓度的FQ-10作用24 h,按Promega公司的试剂盒说明书进行检测,统计细胞凋亡率。
1.2.4 DNA琼脂糖凝胶电泳观察细胞凋亡的梯状DNA条带在对数生长期细胞中加入不同浓度的FQ-10培养24 h,质量分数为0.25%胰酶消化处理后收集细胞,PBS洗涤两次,按DNA ladder抽提试剂盒说明书提取DNA,1%琼脂糖凝胶电泳,凝胶成像系统观察拍摄。
1.2.5线粒体膜电位(△ψm)测定在对数生长期细胞中加入不同浓度的FQ-10培养24 h后,加入细胞培养液和JC-1染色工作液各1 mL,37℃孵育20 min,加入终浓度为5 mg·L-1的 Hoechst33258 避光染色10 min,PBS洗涤,高内涵活细胞成像系统观察分析。
1.2.6 Western blot检测蛋白表达不同浓度FQ-10作用细胞24 h,RIPA裂解液200 μl充分裂解细胞,4℃离心(12 000 r·min-1)5 min 提取蛋白,考马斯亮蓝G250法分光光度计测样品蛋白浓度,以12%SDS-PAGE电泳分离。电转移蛋白至PVDF膜,5%脱脂奶粉封闭1 h,一抗(1∶2 000)4℃封闭过夜,二抗(辣根过氧化物酶标记的羊抗兔或羊抗鼠抗体1∶4 000)孵育1 h,化学发光法显示结果,凝胶图像分析系统拍照。
1.2.7统计学分析所有资料均采用SPSS 12.0软件包进行统计学处理。计量资料用±s表示,组间比较采用t检验分析。
2 结果
2.1FQ10对SMMC-7721细胞增殖的抑制作用不同浓度的FQ-10分别作用于SMMC-7721细胞24 h、48 h和72 h,表现出明显的细胞增殖抑制作用,抑制率呈浓度和时间依赖性。24、48 h和72 h的IC50值分别为 4.40 μmol·L-1(r2=0.822 1),3.65 μmol·L-1(r2=0.799 0)和 3.61 μmol·L-1(r2=0.783 3),见 Fig 2。

Fig 2 Proliferation inhibition effect of FQ-10 on SMMC-7721 cells
2.2 FQ10诱导SMMC-7721细胞凋亡作用Hoechst33258/PI双染结果显示,FQ-10作用于SMMC-7721细胞24 h,出现细胞膜皱缩、染色质凝集、核呈碎片状等凋亡形态学变化,晚期可见特异性PI染色(Fig 3)。TUNEL结果显示,随着FQ-10浓度增加,凋亡细胞明显增多,呈浓度依赖性(Fig 4)。DNA凝胶电泳显示,FQ-10(10 μmol·L-1)处理组的基因组DNA呈现典型的梯状条带,对照组细胞DNA完整(Fig 5)。
2.3FQ-10对线粒体膜电位的影响JC-1正常在线粒体内形成多聚体,呈红色荧光。凋亡细胞内△ψm破坏,使JC-1以单体的形式进入胞质呈绿色荧光。荧光强度比值的变化反映△ψm的变化。SMMC-7721 细胞经1.48、4.40、10.00 μmol·L-1FQ-10 作用24 h后,每孔绿色荧光强度与红色荧光强度比值随药物浓度增加而增大,表明细胞线粒体膜电位降低。与对照组相比分别降低(9.24±4.68)%,(35.16±5.06)%,(43.80±3.25)%,差异有统计学意义(P<0.05),见 Fig 6。

Fig 3 SMMC-7721 cells apoptosis under fluorescent microscope stained by Hoechst 33258/PI(×200).

Fig 4 Induction of apoptosis of SMMC-7721 cells treated with FQ-10 for 24 h evaluated by TUNEL assay
Tab 1 Apoptotic effects of FQ-10 on SMMC-7721 cells(±s,n=9)
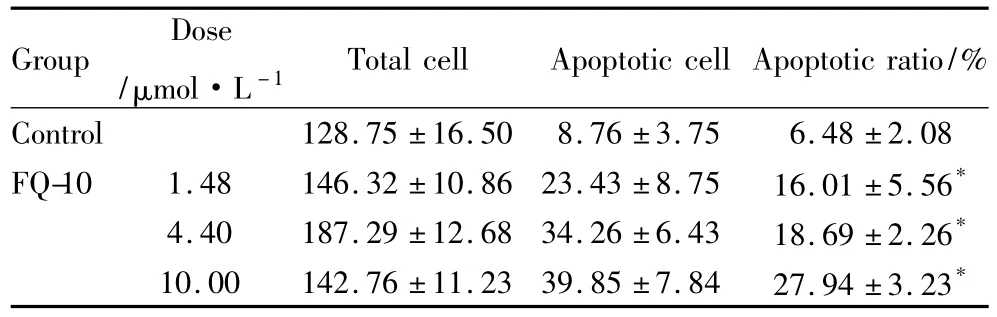
Tab 1 Apoptotic effects of FQ-10 on SMMC-7721 cells(±s,n=9)
*P<0.05 vs control
Group Dose/μmol·L -1Total cell Apoptotic cell Apoptotic ratio/%Control 128.75 ±16.50 8.76 ±3.75 6.48 ±2.08 FQ-10 1.48 146.32 ±10.86 23.43 ±8.75 16.01 ±5.56*4.40 187.29 ±12.68 34.26 ±6.43 18.69 ±2.26*10.00 142.76 ±11.23 39.85 ±7.84 27.94 ±3.23*

Fig 5 DNA fragmentation in SMMC-7721 cells

Fig 6 Changes in the MMP of SMMC-7721 cells induced by FQ-10 for 24 h and analyzed by HCS after staining with JC-1
2.4FQ-10对凋亡相关基因蛋白表达的影响以1.48、4.40、7.32 和 10.00 μmol·L-1FQ-10 分别作用于 SMMC-7721细胞 24 h,Western blot法检测caspase-9,caspase-8,caspase-3,Bcl-2,Bax 和 p53 的表达。与对照组相比,FQ-10作用后细胞p53蛋白表达明显增加,Bcl-2家族中促凋亡蛋白Bax的蛋白表达量随加药浓度的增高而增加,呈明显的浓度依赖关系;抗凋亡蛋白 Bcl-2的表达则略有下调。细胞凋亡可通过两条途径实现,一条是线粒体途径,另一条是膜死亡受体介导途径。前者主要通过激活caspase-9诱导细胞凋亡,而后者主要通过激活caspase-8实现细胞凋亡。Fig 7显示,FQ-10作用后Caspase-9蛋白总体表达水平增高,活化裂解片段增多,同时caspase 3活化片段亦有增加,而caspase-8变化不明显,提示FQ-10诱导SMMC-7721细胞凋亡作用可能仅与线粒体凋亡通路有关。
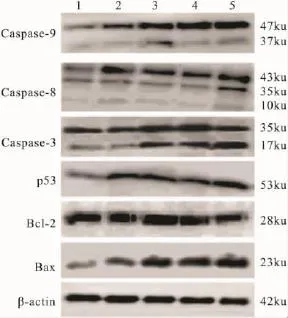
Fig 7 Protein expression of caspase-9,caspase-8,caspase-3,Bcl-2,Bax and p53 in SMMC-7721 cells treated with different FQ-10 concentrations for 24 h
3 讨论
氟喹诺酮类化合物抑制肿瘤细胞增殖及诱导细胞凋亡的作用已见报道[5]。本实验显示,FQ-10对人肝癌细胞SMMC-7721有较强的增殖抑制作用,且呈时间和浓度依赖性,可能成为一种有价值的候选抗肿瘤药物。研究中发现,在低剂量条件下,FQ-10对SMMC-7721细胞的杀伤作用不足,残存少量耐药细胞密度适中,能够很快进入对数生长期,导致长时间(72 h和48 h)处理组的增殖抑制率低于24 h处理组(Fig 2),值得注意。
临床常用抗菌氟喹诺酮类药物作用于细菌的DNA回旋酶,此酶与真核生物拓扑异构酶Ⅱ在活性部位酪氨酸附近的序列有同源性[6],部分氟喹诺酮类药物如氧氟沙星、环丙沙星等,对拓扑异构酶Ⅱ有很弱的抑制作用[7]。已有报道[8],经结构改造后,某些氟喹诺酮类药物显示出较强的拓扑异构酶Ⅱ抑制作用,作用机制类似于抗癌药物依托泊苷[9],主要通过促进拓扑异构酶Ⅱ介导的DNA解旋或断裂,抑制其再连接反应,造成细胞DNA损伤。资料显示,喹诺酮类化合物致DNA损伤多通过激活p53蛋白诱导细胞凋亡[10-11]。本实验 Western blot结果显示,FQ-10可使p53蛋白表达明显增多,同时细胞凋亡率也随FQ-10浓度增加明显升高,说明FQ-10诱导细胞凋亡作用与激活p53蛋白有关。
一般认为,经拓扑异构酶Ⅱ毒性作用造成的DNA损伤,可能激活线粒体凋亡途径和膜死亡受体途径造成细胞凋亡,线粒体途径受Bcl-2家族控制[12-13]。本实验结果显示 FQ-10可上调促凋亡Bax的表达,下调 Bcl-2的表达,这种调节作用与FQ-10剂量一致,说明FQ-10诱导SMMC-7721细胞凋亡作用与线粒体凋亡通路有关[14]。通过高内涵活细胞成像系统测定发现FQ-10可以引起SMMC-7721细胞线粒体膜电位降低,这种变化主要由线粒体膜通透性增加所致,促使线粒体内细胞色素C释放到细胞质中,经caspase-9和caspase-3激活途径,诱导细胞凋亡。有报道喹诺酮类化合物可经膜死亡受体途径诱导细胞凋亡,但FQ-10对caspase-8的影响并不显著,其诱导细胞凋亡作用可能与膜死亡受体途径无关[15]。
综上所述,喹诺酮类化合物FQ-10可抑制肝癌细胞增殖,造成DNA损伤,经p53蛋白作用激活线粒体凋亡通路,诱导人肝癌细胞凋亡。
[1]Shen L L,Pernet A G.Mechanism of inhibition of DNA gyrase by analogues of nalidixic acid[J].Proc Nat Acad Sci USA,1985,82:307-11.
[2]Kishii R,Takei M,Fukuda H,et al.Contribution of the 8-Methoxy Group to the Activity of Gatifloxacin against typeⅡTopoisomerases of Strep to coccus pnenmoniae[J].Antimicrob Agents Chemother,2003,47(1):77-81.
[3]You Q D,Li Z Y,Huang C H,et al.Discovery of a novel series of quinolone and naphthyridine derivatives as potential topoisomerase I inhibitors by scaffold modification[J].J Med Chem,2009,52(18):5649-61.
[4]皇甫超申,马永超,房 娜,等.三氮唑席夫碱衍生物对人肝癌细胞分化和凋亡的影响[J].中国药理学通报,2008,24(4):498-503.
[4]Huangfu C S,Ma Y C,Fang N,et al.Effects of tri zole schiff base derivative on the differentiation and apoptosis of human hepatocarcinoma cells[J].Chin Pharmacol Bull,2008,24(4):498-503.
[5]Efthimiadou E K,Thomadaki H,Sanakis Y,et al.Structure and biological properties of the copper(Ⅱ)complex with the quinolone antibacterial drug N-pro-pyl-norfloxacin and 2,2'-bipyridine[J].J Inorg Biochem,2007,101(1):64 -73.
[6]Berger J M,Gamblin S J,Harrison S C,et al.Structure and mechanism of DNA topoisomerase Ⅱ[J].Nature,1996,379(6562):225-32.
[7]Kamat A M,De Haven J I,Lamm D L.A potential adjunct to intravesical chemotherapy for bladder cancer[J].Urology,1999,54(1):56-61.
[8]Elsea S H,Osheroff N,Nitiss J L.Cytotoxicity of quinolones toward eukaryotic cells.Identification of topoisomeraseⅡ as the primary cellular target for the quinolone CP-115,953 in yeast[J].J Biol Chem,1992,267(19):13150 -3.
[9]Yogeeswari P,Sriram D,Kavya R,et al.Synthesis and in-vitro cytotoxicity evaluation of gatifloxacin Mannich bases[J].Biomed Pharmacother,2005,59(9):501 -10.
[10]Sheng Z,Cao X,Peng S,et al.Ofloxacin induces apoptosis in microencapsulated juvenile rabbit chondrocytes by caspase-8-dependent mitochondrial pathway[J].Toxicol Appl Pharmacol,2008,226(2):119-27.
[11]Smart D J,Halicka H D,Traganos F,et al.Ciprofloxacin-induced G2 arrest and apoptosis in TK6 lymphoblastoid cells is not dependent on DNA double-strand break formation[J].Cancer Biol Ther,2008,7(1):113 -9.
[12]Xie C Y,Zhu H,Lin L P,et al.MFTZ-1,an actinomycetes subspecies derived antitumor macrolide,functions as a novel topoisomerase Ⅱ poison[J].Mol Cancer Ther,2007,6(11):3059 -70.
[13]谢松强,李 骞,张亚宏,等.萘酰亚胺-多胺缀合物NNINspm通过PI3 K/Akt信号通路诱导肝癌细胞凋亡[J].中国药理学通报,2010,26(2):169 -7.
[13]Xie S Q,Li Q,Zhang Y H,et al.NNINspm,naphthalimide-polyamine conjugate,induces hepatoma HepG2 cell apoptosis via PI3K/Akt pathways[J].Chin Pharmacol Bull,2010,26(2):169-7.
[14]Hsu S C,Yang J S,Kuo C L,et al.Novel quinolone CHM-1 induces apoptosis and inhibits metastasis in a human osterogenic sarcoma cell line[J].J Orth-op Res,2009,27(12):1637 -44.
[15]Wang S W,Pan S L,Huang Y C,et al.CHM-1,a novel synthetic quinolone with potent and selective antimitotic antitumor activity against human hepatocellular carcinomain vitroandin vivo[J].Mol Cancer Ther,2008,7(2):350 -60.

