蛇毒半胱氨酸蛋白酶抑制剂基因转染对小鼠黑色素瘤B16细胞蛋白质表达谱的影响
齐元麟,纪明开,2,谢 群,3,黄清玲,林建银
(福建医科大学1.基础医学院分子医学研究中心,消化道恶性肿瘤教育部重点实验室,2.附属第一医院皮肤科,福建 福州 350004;3.莆田学院医学院,福建莆田 351100)
蛇毒半胱氨酸蛋白酶抑制剂(sv-cystatin)是来自中华眼镜蛇(Naja atra)蛇毒的活性成分[1]。本实验室合成sv-cystatin全基因,采用两种策略研究其功能:①在大肠杆菌和毕赤酵母表达系统中生产重组sv-cystatin蛋白,纯化蛋白质,研究其抗肿瘤活性[2];②构建sv-cystatin真核表达载体,研究基因转染对肿瘤细胞的影响[3-4]。在体内体外实验中,两种策略都显示sv-cystatin可抑制小鼠黑素瘤B16细胞和人肝癌MHCC97H细胞的侵袭转移。为进一步了解sv-cystatin抗肿瘤作用机制,我们采用基因芯片技术分析了sv-cystatin基因转染对B16细胞基因表达谱的影响[5]。本研究在前期研究基础上,采用比较蛋白质组学策略研究sv-cystatin转染对B16F1细胞的蛋白质表达谱的影响,以双向电泳分离蛋白质,以基质辅助激光解吸电离质谱法(MALDI-TOFMS)鉴定差异蛋白,结合前期基因组数据进行整合分析,探讨sv-cystatin抑制肿瘤的可能机制。
1 材料与方法
1.1材料
1.1.1仪器IPGphorⅡ等电聚焦电泳仪、DALTsix垂直电泳槽、ImageScanner凝胶扫描仪均为 GE Healthcare产品;7500荧光定量PCR仪为Applied Biosystems产品。
1.1.2试剂固相 pH梯度(IPG)胶条(pH 3-11非线性,24 cm)、IPG缓冲液、丙烯酰胺、甲叉双丙烯酰胺、尿素、硫脲、CHAPS、蛋白酶抑制剂混合物、蛋白定量试剂盒、二甲基甲酰胺等双向电泳试剂均购自GE Healthcare;TRIzol、ECL化学发光液购自 Invitrogen;M-MLV逆转录酶、RNasin购自 Promega;SYBR Premix实时定量PCR试剂盒购自TaKaRa;鸡抗sv-cystatin单抗为上海中科开瑞公司产品;兔抗GAPDH、RhoGDI-beta和 NM23抗体均购自 Santa Cruz;HRP标记的羊抗兔IgG抗体购自Cell Signaling;其余试剂均为进口或国产分析纯。
1.2方法
1.2.1细胞株B16F1/pcDNA3.1和 B16F1/svcystatin细胞由本实验室保存。B16F1/pcDNA3.1细胞为真核表达载体pcDNA3.1-His C转染B16F1细胞后经G418筛选获得;B16F1/sv-cystatin为包含完整sv-cystatin阅读框的重组pcDNA3.1-His C载体转染 B16F1 细胞后,G418 筛选所得[3-4],该细胞高表达 sv-cystatin(见 Fig 1),生长增殖能力与B16F1/pcDNA3.1无异,但体外侵袭和体内转移能力低于B16F1/pcDNA3.1。

Fig 1 Western blot analysis of sv-cystatin overexpression
1.2.2细胞总蛋白的提取、双向电泳与凝胶图像分析[6]B16F1/pcDNA3.1和 B16F1/sv-cystatin细胞生长至对数生长期,胰酶消化,2×106细胞加入100 μl裂解缓冲液(7 mol·L-1尿素,2 mol·L-1硫脲,0.065 mol·L-1CHAPS,0.04 mol·L-1Tris HC1,0.04 mol·L-1二硫苏糖醇,2% 两性非线性电解质pH 3~11,1 μl广谱蛋白酶抑制剂混合物)裂解细胞,40 000×g离心1 h吸取上清液,测定总蛋白浓度。按照IPGphor等电聚焦系统操作手册对两组蛋白样品进行等电聚焦,并将聚焦结束后的IPG干胶条放人平衡液平衡,随后灌制12.5%SDS-PAGE凝胶,在第二相Ettan DALTsix中对样品进行垂直板电泳。实验重复3次。凝胶经考马斯亮蓝R-350染色,Image Scanner扫描,用 Image Master 2D Platinum软件分析蛋白差异点。
1.2.3质谱分析[7]手工切下包含蛋白的小块凝胶。凝胶经脱色、酶解,在4700 Proteomics Analyzer(TOF/TOF)上进行MALDI-TOF-MS分析。肽质量指纹图谱(PMF)质量扫描范围为700~3 500 ku且强度最大的5个峰进行串级质谱分析。谱图用myoglobin酶解肽段进行外标校正。所得结果用GPS(Applied Biosystems)和 MASCOT(Matrix Science)进行数据库检索,并结合专业知识进行蛋白的确认。
1.2.4Western blot验证差异表达蛋白B16F1/pcDNA3.1和B16F1/sv-cystatin细胞经RIPA裂解液裂解后离心并保留上清液,测定上清液蛋白浓度。取等量40 μg蛋白,10%SDS-PAGE电泳,电转移至聚偏二氟乙烯(PVDF)膜,封闭过夜。一抗4℃温育24 h,二抗室温温育2 h,化学发光法检测差异蛋白表达,以GAPDH基因为内参照,计算蛋白表达的相对变化。
1.2.5Realtime PCR验证差异表达基因TRIzol一步法提取B16F1/pcDNA3.1和B16F1/sv-cystatin细胞总 RNA,按照常规方法逆转录,采用 SYBR Green法实时定量PCR分析各差异基因的mRNA表达,以 β-actin 基因为内参照,采用 2-ΔΔCt法计算基因表达的相对变化。引物序列见Tab 1。

Tab 1 Primers for differential genes found by the proteomics analysis
1.2.6差异基因的Gene Ontology(GO)初步分析将本研究得到的差异蛋白质和前期基因芯片数据[5]合并,提交到 DAVID Bioinformatics Resources 6.7(National Institute of Allergy and Infectious Diseases(NIAID),NIH)(http://david.abcc.ncifcrf.gov/home.jsp)[8],根据 Gene Ontology(http://www.geneontology.org/),对差异表达基因的功能、定位、途径进行分析。
1.2.7统计学处理所有数据均采用 SPSS for Windows 13.0软件进行统计学处理,各组数据以±s表示,组间比较采用t检验。
2 结果
2.1双向凝胶电泳和差异蛋白点的筛选实验对B16F1/pcDNA3.1和B16F1/sv-cystatin细胞的总蛋白进行了双向凝胶电泳分离,Fig 2是其中具有代表性的背景清晰、分辨率高的图谱。经过Image Master 2D Platinum分析,在 B16F1/pcDNA3.1组上找到(724±27)个蛋白点,B16F1/sv-cystatin组上找到(665±40)个点,两组图的匹配蛋白点有(412±20)个。与对照组相比,B16F1/sv-cystatin组有5个蛋白表达上调2倍、6个蛋白表达下调2倍以上。我们选择了这11个蛋白点,同时也选择了1个在B16F1/sv-cystatin特异表达的蛋白点进行质谱鉴定,选择的蛋白点见Fig 2。

Tab 2 The differential proteins identified by MALDI-TOF-MS analysis

Fig 2 2D eletrophoresis spectrum of B16F1/pcDNA3.1 or B16F1/sv-cystatin cell extracts
2.2蛋白质质谱鉴定12个差异蛋白点经过胶内酶解提取蛋白肽段进行MALDI-TOF/TOF-MS鉴定,所得m/z数据经数据库(http://www.matrixscience.com 和 http://cn.expasy.org/sprot)搜索分析,其中10个差异表达蛋白的Protein Score在100分以上,结果予以采信。它们按功能可以分为糖代谢酶系、小G蛋白调控分子、真核翻译因子、核苷酸激酶等,详见Tab 2,而G4和H3两个蛋白的Protein Score低于50,结果不予采信。
2.3差异基因的Western blot和Real time PCR验证采用Western blot鉴定了NM23和RhoGDI-beta的表达,以GAPDH为内参照,结果显示,与对照组相比,B16F1/sv-cystatin细胞的NM23和RhoGDI-beta的蛋白表达分别上调了(2.23±0.34)倍和(1.57±0.11)倍,与蛋白质组学结果相符。结果见Fig 3。
为探讨差异表达蛋白在mRNA上表达的变化,我们采用Real time PCR验证了8个差异表达蛋白质的mRNA的表达水平,结果显示,与对照组相比,B16F1/sv-cystatin 细胞的 NM23、RhoGDI-beta、RANBP1的 mRNA 表达上调,eIF5A、MDH1、eEF1-beta2表达下调,与蛋白质表达趋势一致,说明这些蛋白表达改变与其基因转录水平改变有关;RhoGDI-alpha和Prdx2的转录水平没有明显变化,与其蛋白表达趋势不完全一致,说明其蛋白表达和基因转录水平存在一定差异。结果见Fig 4。
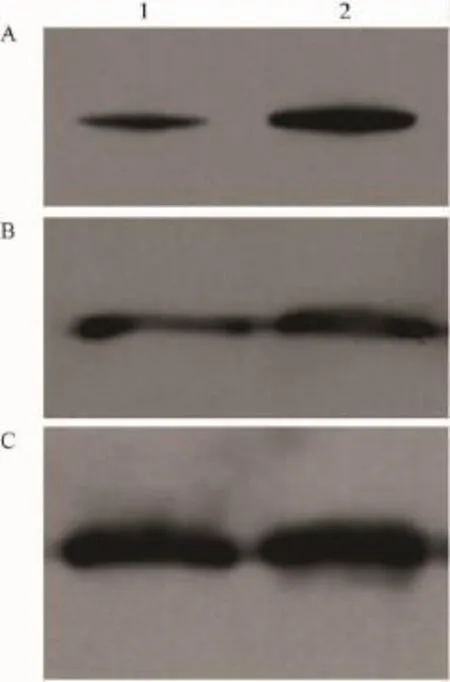
Fig 3 Western blot analysis of differentially expressed proteins
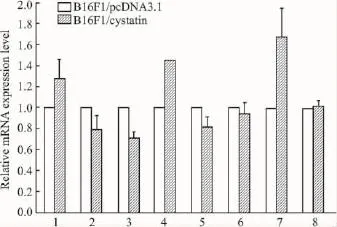
Fig 4 Realtime PCR analysis of differentially expressed genes
2.4差异基因的Gene Ontology分析我们将前期报道的sv-cystatin的差异基因组学数据和上述差异蛋白组学数据整合,进行了分子功能注释,通过GO分析,从细胞组分(cellular component)、分子功能(molecular function)和生物过程(biological process)3个角度对它们进行了分类,详见Tab 3。

Tab 3 The gene ontology annotation of differentially expressed genes
3 讨论
本研究结果初步显示sv-cystatin可以影响B16F1的蛋白质表达谱,这些差异表达蛋白主要与肿瘤转移、小G蛋白调节、翻译和代谢等生理过程相关。
以往研究中我们发现重组sv-cystatin蛋白处理或基因转染均可抑制小鼠黑素瘤B16、人肝癌MHCC97H 和人胃癌 SGC7901的侵袭和转移[2-4],并发现这与sv-cystatin抑制肿瘤细胞分泌的半胱氨酸蛋白酶[2]以及下调细胞表面黏附分子如 Laminin等[4-5]有关。本研究显示,sv-cystatin能明显上调抑癌蛋白NM23的表达,这可能是sv-cystatin抑制肿瘤转移的另一机制。NM23是Steeg等从小鼠黑素瘤细胞中筛选到的抑癌蛋白,由Nme1基因编码,它在低转移细胞株中的表达是高转移细胞株中的10倍,与肿瘤转移密切相关[9]。NM23是一种核苷二磷酸激酶,可以催化γ-磷酸基团在NTP和NDP之间的转移,并能结合DNA和调节转录。许多研究显示,NM23可通过催化GDP-GTP交换反应而激活各种小G蛋白和三聚体G蛋白而激活信号转导,此外,NM23还能与Tubulin结合,通过调节微管结构而影响细胞的结构和迁移,从而抑制肿瘤细胞的侵袭和转移[10]。本研究中双向电泳凝胶染色和Westernblot都显示B16F1/sv-cystatin细胞的NM23相比对照组上调超过100%,而RT-PCR分析显示NM23的mRNA表达也上调,说明上调NM23表达很可能是sv-cystatin抑制肿瘤转移的机制之一。
Rho是Ras超家族小G蛋白的一员,在信号转导中作用于肌动蛋白,调控细胞的运动与迁移。有研究表明Rho在多种肿瘤中表达异常,并与肿瘤细胞的侵袭转移密切相关。Rho GDP解离抑制因子(Rho GDP dissociation inhibitor,RhoGDI)可阻止GDP从Rho酶上分离,抑制Rho的激活,从而发挥抑制肿瘤转移的作用[11]。牛慧彦等[12]发现,RhoGDI2蛋白在肺癌组织中表达较癌旁组织降低,且与组织分化程度、临床分期和淋巴结转移有关。组织分化程度低,临床分期晚,有淋巴结转移的患者,RhoGDI2蛋白表达明显降低,提示RhoGDI2与肺癌的发生、发展和侵袭转移有关。本研究发现RhoGDI-beta(在人类中为RhoGDI2)在B16F1/sv-cystatin中高表达,推测可能与sv-cystatin抑制肿瘤侵袭转移有关。真核翻译起始因子5A(eIF5A)和真核翻译延长因子1-β(eEF1-beta2)都是非常保守的蛋白质,在翻译过程起重要作用,并参与调节细胞增殖和凋亡。本研究发现 sv-cystatin可下调 eIF5A和eEF1-beta2,从而抑制蛋白质合成,推测与其抑制细胞增殖的活力有关。本研究结果还显示,sv-cystatin可影响糖代谢酶系、氧化还原蛋白的表达,这些蛋白变化的确切机制和意义有待进一步研究。
本课题组前期采用基因芯片分析sv-cystatin对B16细胞mRNA表达的影响,筛选得到45个差异表达基因,其中21个上调,24个下调[5]。本研究分析sv-cystatin对B16细胞蛋白质表达谱的影响,筛选了10个差异蛋白,这些蛋白与基因芯片鉴定的结果没有明确的对应关系。这种转录组数据和蛋白质组数据不匹配的结果在国内外研究中都有发现,如Chen等[13]同时采用基因芯片和蛋白质组学对肺癌样本的研究发现,在鉴定的165个蛋白点中只有17%的mRNA和蛋白质表达趋势在统计学上明显相关,而83%的mRNA和蛋白质表达不相关甚至相反(如α-结合珠蛋白)[13]。其他文献也指出,转录组和蛋白组的Pearson相关系数分布在0.46到0.76之间,说明mRNA表达量对于蛋白质丰度只能提供微弱的提示[14]。一般认为,引起这种不匹配的原因是高等动物存在复杂的转录后调控机制,如mRNA/蛋白稳定性调节、翻译起始控制、转录后基因沉默等。为探讨本研究鉴定的差异蛋白与相应mRNA表达的关系,我们采用实时定量PCR检测差异蛋白的转录本含量。结果显示,在检测的8个基因中,有6个的mRNA表达趋势和蛋白表达趋势一致,两个不一致,说明我们鉴定的差异蛋白大多与mRNA表达趋势存在相关性。但是,这些基因的mRNA表达变化幅度普遍低于蛋白质变化幅度,都低于基因芯片筛选的阈值(表达变化2倍以上),所以前期基因芯片实验没有筛选出这些基因。另一方面,目前基于双向电泳-质谱的蛋白质组学技术对偏性蛋白、膜蛋白、低丰度蛋白的分离和定量都存在一定难度[14],也使蛋白质组提供的信息量低于转录组,我们前期基因芯片鉴定的差异基因许多都编码疏水的质膜受体或低表达,它们被双向电泳分离并被我们筛选得到的概率较低。
转录组和蛋白质组研究手段差异很大,结果的相关性也并不高,但是它们都提供了特定层次上的基因表达情况,对转录组和蛋白组数据进行整合分析,有利于获得基因表达变化的“全景图”[15],因此,本研究利用美国NIH的DAVID生物信息学分析平台(The Database for Annotation,Visualization and Integrated Discovery,DAVID)[8]对基因芯片数据和蛋白组数据进行了初步功能注释和分类。Gene Ontology(基因本体学,GO)是生物信息学领域中一个极为重要的方法和工具,它通过对基因序列的注释,推断序列编码产物的功能,已广泛用于大规模组学的数据整合和利用[16]。我们通过DAVID平台,对数据进行了GO分类和注释,结果显示,sv-cystatin转染导致差异变化基因的细胞定位(cellular component)主要分布在细胞间质、质膜和细胞核;分子功能(molecular function)则表现为DNA结合能力、转录因子活性和半胱氨酸蛋白酶;参与的生物过程(biological process)主要有细胞凋亡、胚胎成形和DNA转录调控。因此,我们初步认为,sv-cystatin的主要作用靶点蛋白可能分为几类:①细胞核的转录因子,调控基因表达;② 内源或分泌型半胱氨酸蛋白酶,与调节细胞迁移和细胞凋亡有关;③ 质膜受体,与信号转导有关。虽然这只是较为粗浅层次的数据整合分析,但它对进一步研究sv-cystatin作用机制指出了新方向。
目前,采用蛋白质组学研究药物作用机制的报道越来越多[17],蛇毒蛋白功能复杂多样,采用蛋白质组学研究其功能,对从整体水平上理解它们的作用机制十分有利。本研究应用蛋白质组学技术,发现NM23、RhoGDI-beta等10个与sv-cystatin抗黑色素瘤活性相关的差异蛋白;通过Gene Ontology分析提示sv-cystatin的主要靶分子可能是转录因子、分泌蛋白和质膜受体。这些结果为进一步探讨sv-cystatin抗肿瘤作用的分子机制及其作为抗肿瘤药物的开发应用提供了理论基础和实验依据。
[1]Billiard-Bourdet M,Nguyen V,Ferrerdi M,et al.Purification and characterization of a new cystatin inhibitor from Taiwan cobra(Naja naja atra)venom[J].Biochem J,1998,331(Pt1):239-44.
[2]Xie Q,Tang N,Wan R,et al.Recombinant snake venom cystatin inhibits the growth,invasion and metastasis of B16F10 cells and MHCC97H cellsin vitroandin vivo[J],Toxicon,2011,57(5):704-11.
[3]万 榕,宋 军,郑海音,等,蛇毒cystatin基因转染抗人胃腺癌细胞体外侵袭作用的研究[J].中国肿瘤临床,2005,32(17):961-5.
[3]Wan R,Song J,Zheng H Y,et al.The studies on effect of snake venom cystatin for invasion and metastasis of the human gastric carcinoma cell line[J].Chin J Clin Oncol,2005,32(17):961-5.
[4]万 榕,郑海音,宋 军,等,蛇毒半胱氨酸蛋白酶抑制剂的表达对黑色素瘤B16细胞侵袭与转移的作用[J].解剖学报,2006,37(6):640-5.
[4]Wan R,Zheng H Y,Song J,et al.The effect of cysteine protease inhibitor of snake venom(sv-cystatin)on mouse melanoma cells invasion in vitro and in vivo[J].Acta Anatomica Sin,2006,37(6):640-5.
[5]谢 群,万 榕,林 旭,等,蛇毒半胱氨酸蛋白酶抑制剂基因转染对小鼠黑色素瘤B16F1细胞基因表达谱的影响[J].癌症,2008,27(7):716-22.
[5]Xie Q,Wan R,Lin X,et al.Effects of snake venom cystatin gene on gene expression profiles in mouse melanoma cell line B16F1[J].Chin J Cancer,2008,27(7):716 -22.
[6]苗 兰,刘建勋,李欣志,潘映红.中国实验小型猪冠心病模型的心肌组织蛋白质组学研究[J].中国药理学通报,2009,25(7):880-3.
[6]Miao L,Liu J X,Li X Z,Pan Y H.Proteomics research on myocardial tissues of Chinese experimental mini-pig model with coronary heart disease[J].Chin Pharmacol Bull,2009,25(7):880-3.
[7]宋 敏,李耀军,赖国旗.蜕皮甾酮对胰岛素抵抗HepG2细胞的蛋白质组学研究[J].中国药理学通报,2009,25(12):1640-4.
[7]Song M,Li Y J,Lai G Q.A proteomic study on the insulin resistant HepG2 cell treated by Ecdysterone[J].Chin Pharmacol Bull,2009,25(12):1640 -4.
[8]Huang D W,Sherman B T,Lempicki R A.Systematic and integrative analysis of large gene lists using DAVID bioinformatics resources[J].Nat Protoc,2009,4(1):44 -57.
[9]Steeg P S,Bevilacqua G,Kopper L,et al.Evidence for a novel gene associated with low tumor metastatic potential[J].J Natl Cancer Inst,1988,80:200 -4.
[10]Boissan M,Dabernat S,Peuchant E,et al.The mammalian NM23/NDPK family:from metastasis control to cilia movement[J].Mol Cell Biochem,2009,329:51-62.
[11]Moissoglu K,McRoberts K S,Meier J A,et al.Rho GDP dissociation inhibitor 2 suppresses metastasis via unconventional regulation of Rho GTPases[J].Cancer Res,2009,69(7):2838 -44.
[12]牛慧彦,王佳贺,徐 灿,等.RhoGDI2在肺鳞癌、腺癌组织和肺癌细胞系中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2010,19(1):32-7.
[12]Niu H Y,Wang J H,Xu C,et al.Expression of RhoGDI2 ln lung squamous carcinoma,adenocarcinom and lung cancer cell lines and its clinical significance[J].Chin J Histochem Cytochem,2010,19(1):32-7.
[13]Chen G,Gharib T G,Huang C C,et al.Discordant protein and mRNA expression in lung adenocarcinomas[J].Mol Cell Proteomics,2002,1:304 -13.
[14]孙 薇,贺福初.差异蛋白质组学研究技术新进展[J].化学通报,2005,68(6):401-7.
[14]Sun W,He F C.Advances in differential proteomics techniques[J].Chemistry,2005,68(6):401 -7.
[15]刘 伟,朱云平,贺福初.系统生物学研究中不同组学数据的整合[J].中国生物化学与分子生物学报,2007,23(12):971-6.
[15]Liu W,Zhu Y P,He F C.Integration of various‘Omics’data in biological systems[J].Chin J Biochem Mol Biol,2007,23(12):971-6.
[16]The gene ontology Consortium.The Gene Ontology in 2010:extensions and refinements[J].Nucleic Acids Res,2010,38:D331 -D335.
[17]王继生,邱宗荫,夏永鹏,等.茅莓总皂苷对局灶性脑缺血/再灌注大鼠的比较蛋白质组学研究[J].中国药理学通报,2009,25(2):201-4.
[17]Wang J S,Qiu Z Y,Xia Y P,et al.Study on compared proteomics of focal cerebral ischemia-reperfusion in rats with the total saponins of rubus parviflolius L[J].Chin Pharmacol Bull,2009,25(2):201-4.

