芪丑汤对肾间质纤维化大鼠EMT抵抗作用研究
张 翠,张 兰,刘 颖,王晓泊,王 萌,代百东
(哈尔滨商业大学药学院,哈尔滨 150076)
肾小管间质纤维化(Tubulointerstitial fibrosis)是各种炎症和非炎症肾脏疾病进展的最终结局.近年来,各国学者在实验动物模型和人类慢性肾小球疾病中发现肌成纤维细胞与肾间质纤维化的形成和发展关系密切,其标志蛋白α-平滑肌肌动蛋白(α-smooth muscleactin,α-SMA).肌成纤维细胞可分泌细胞外基质:实验动物和人类肾小球疾病研究中证实,肌成纤维细胞可分泌Ⅰ、Ⅲ、Ⅳ型胶原和纤维粘连蛋白等[1],肾间质 α-SMA表达程度与Ⅲ、Ⅳ型胶原和纤维粘连蛋白表达之间存在正相关.
肾小管上皮细胞向间充质细胞的转分化作用致纤维化细胞因子过度表达、细胞外基质(extracellular matrix,ECM)的合成-降解失衡及大量积聚等因素在肾间质纤维化的发生、发展过程中起着重要作用.芪丑汤为自拟方,在对肾大部切除大鼠致慢性肾衰模型的研究中发现它可减轻肾小球硬化和肾间质纤维化的程度[1],本研究目的旨在从分子水平探讨芪丑汤对肾间质纤维化大鼠生物学效应的调控机制.
1 实验材料
1.1 动物
雄性Wistar大鼠,体重(190±20)g,由黑龙江省肿瘤医院实验动物研究所提供,动物合格证号为:黑动字第06-4-21号.
1.2 药物组成
黄芪50 g,大黄10 g,石菖蒲15 g,牵牛子20 g,附子10g,人参15 g,白术15 g,丹参20 g,王不留行15 g,橘皮10 g组成,以上药物均购自哈尔滨宝丰药业有限公司.
1.3 药液制备
按照各药在方中的比例准确称取,混匀,过滤,制备芪丑汤水煎液的浓缩液,质量浓度为每毫升浓缩液含芪丑汤 1.33 g 生药[2-3](由哈尔滨商业大学药学院制剂教研室制备),4℃冰箱保存备用.
1.4 对照药
依那普利,扬子江药业有限公司生产,批号:05091202,国药准字:H32026567.
1.5 试剂
小鼠抗大鼠α-平滑肌肌动蛋白(α-SMA)单克隆抗体,批号:BM0002.兔抗大鼠胶原蛋白Ⅲ(ColⅢ)多克隆抗体,批号:BA0326.第二抗体为生物素标记的马抗小鼠IgG抗体及山羊抗兔IgG抗体,二乙酯焦碳酸(DEPC),均由博士德生物工程有限公司提供.二氨基联苯胺DAB显色剂,北京中山生物技术公司提供.肌酐测定试剂盒,批号:060321;尿素测定试剂盒,批号:060151;总胆固醇测定试剂盒,批号:060211;甘油三酯试剂盒,批号:060721.均由北京中生生物工程高技术公司提供.
1.6 仪器
医学病理图象分析系统:HJPIAS-1000,哈尔滨医科大学提供.病理组织漂烘仪:PHY-III,常州中威电子仪器厂提供.电热鼓风干燥箱:DGX-9143P-1,上海福玛实验设备有限公司.生物组织包埋机:BM-VⅡ,孝感市宏业医用仪器有限公司.全自动生化分析仪:LISA 300 plus型,法国生产.
血液细胞分析仪:XF9030B型,南京普朗设备有限公司.
2 实验方法
2.1 模型制作
模型制作参见薛痕等报道[4],采用单侧输尿管结扎方法.取雄性Wistar大鼠48只,体重(190±20)g,用10%水合氯醛35mg/kg腹腔注射将大鼠麻醉后局部剪毛.选择腹正中线切口,依次切开皮肤至腹腔,游离肾脏及输尿管,将左侧输尿管用止血钳托起中段部位,夹住,在止血钳两侧用4-0号丝线两次结扎左侧输尿管近肾盂段,两结扎点之间剪断输尿管,逐层缝合皮下组织及皮肤.假手术组切开皮肤至腹腔,分离左侧输尿管但不结扎及剪断输尿管.手术后各鼠均腹腔注射青霉素72万单位/kg,连续3 d以防感染.
2.2 分组与给药
术后将大鼠随机分为以下6组,假手术组和模型组各7只,给予等体积生理盐水;依那普利组9只,给药剂量为0.77 g/(kg·d-1);芪丑汤高剂量组8只,给药剂量为26.6 g/(kg·d-1);芪丑汤中剂量组9只,给药剂量为13.3g/(kg·d-1);芪丑汤低剂量组8只,给药剂量为6.65g/(kg·d-1).各组灌胃给药,每日服药1次,连续12 d.
2.3 检测方法
2.3.1 对肾组织病理形态的影响
肾组织纵切4%多聚甲醛固定(含有1/1000DEPC)常规脱水、浸蜡 、包埋切成2 μm的切片,片行苏木素(Hematoxylin)—伊红(Eosin)染色法.双盲法于光镜200倍下分别于左上、左下、右上、右下、中间各取2个视野,每张切片共10个视野,进行半定量分析,依据文献[5]结合本模型特点,选取间质纤维化、小管萎缩、间质浸润、红细胞管型、蛋白管型、间质水肿、小管扩张、小管细胞空泡变性8项指标来判断肾间质病理改变,每个参数按0~3分评定(0=正常,1=轻度受损,2=中度受损,3=重度受损).
2.3.2 VG 染色
常规脱蜡水洗,采用Weigert氏铁苏木精染核5~15min,自来水充分冲洗,镜检核着色程度,蒸馏水洗后以VG染液染l~5min,最长不超过7min.直接用新鲜的95%酒精急速分化兼脱水,需数秒钟,无水酒精脱水,二甲苯透明,树胶封固.胶原纤维呈深粉红色.采用彩色病理图像分析系统进行分析,每组随机选取10个视野,通过深粉红色调节区分视野内阳性信号面积,计算阳性目标面积与统计场总面积比值,取均值进行统计分析.
2.3.3 血清 Scr、BUN、CHO、TG 检测 采用全自动生化分析仪测定.
2.3.4 红细胞(RBC),血红蛋白(Hb)检测
采用电阻抗法和光电比色法测量红细胞和血红蛋白的含量.
2.3.5 α-SMA、ColⅢ测定
采用免疫组化SP法检测:肾组织石蜡切片脱蜡至水,二甲苯三次10min 1次,100%,90%,80%乙醇10min 1次.滴加蒸馏水新鲜配置的0.3%H2O2,溶液封闭内源性过氧化物酶10min,磷酸盐缓冲液(PBS)冲洗(每次5min,共3次),在微波缓冲液中微波修复10min.滴加非免疫性驴血清封闭液(含10%驴血清),室温下10min.滴加工作质量浓度的第一抗体(小鼠抗大鼠α-SMA单克隆抗体,兔抗大鼠LN多克隆抗体,兔抗大鼠ColⅢ多克隆抗体)4℃过夜.0.1 mol PBS液洗3次;每次3min.加入二抗(生物素标记的抗小鼠IgG抗体及抗兔IgG抗体)37℃孵育30min,0.1 mol PBS液洗3次,每次3min.滴加链霉卵白素-碱磷酶轭合物37℃孵育40min,用DAB显色液显色3~5min,苏木素复染3min,切片经梯度脱水干燥、二甲苯透明、用树脂封片.每组均以PBS代替第一抗体作阴性对照.实验结果采用单盲法评价.借助HPIAS-1000高清晰度彩色病理图文报告分析系统,每张切片随机选取10个高倍视野(×400),测定肾间质阳性面积和小管间质总面积的比值,进行免疫组化半定量分析后取均值.
2.4 统计分析
3 实验结果
3.1 芪丑汤对单侧输尿管梗阻大鼠肾组织病理形态的影响
术后12d模型组左侧肾脏体积较对侧明显增大,镜下见皮髓质明显变薄,以髓质为重,可见肾小管排列紊乱,弥漫的肾小管上皮细胞肿胀、空泡变性,部分肾小管腔内有蛋白或细胞管型、多数肾小管扩张、灶状萎缩,偶见坏死,肾间质增宽,有散在或多灶状单核、淋巴细胞浸润和间质纤维化,肾小球改变不明显.假手术组肾间质损伤指数为(0.83±0.23),模型组(10.71 ±1.13),依那普利组(8.51 ±1.06),高剂量组(6.62 ±1.54),中剂量组(4.93±0.97),低剂量组(5.85 ±2.03),模型组与假手术组比较,病理变化有显著性差异(P<0.01),表明单侧输尿管梗阻后大鼠肾组织呈现肾间质纤维化样改变.各治疗组与模型组相比,均可使病理变化降低(P<0.05),芪丑汤中剂量组与依那普利组比较具有明显的差异性(P<0.05),表明芪丑汤具有减轻肾小管上皮细胞坏死,间质炎症细胞浸润,减轻肾间质纤维化作用.
3.2 芪丑汤对单侧输尿管梗阻大鼠肾组织VG染色与胶原分布的影响
采用彩色病理图像分析系统,计算阳性目标面积与统计场总面积比值.假手术组阳性信号面积为(4.33 ±1.33),模型组(33.81 ±6.13),依那普利组(23.51 ±2.91),高剂量组(18.77 ±2.24),中剂量组(15.93 ±2.57),低剂量组(24.25 ±3.03).模型组与假手术组比较,阳性信号面积比有显著性差异(P<0.01),表明单侧输尿管梗阻后大鼠肾组织胶原分布含量升高.各治疗组与模型组比较,均可使阳性信号面积比明显降低(P<0.05),芪丑汤中剂量组与依那普利组比较具有明显的差异性(P<0.05).
3.3 芪丑汤对单侧输尿管梗阻大鼠血清肌酐(Scr),尿素氮(BUN)的影响
图1、2结果表明:模型组与假手术组比较差异非常显著(P<0.01),说明大鼠单侧输尿管梗阻后可使BUN、Scr明显升高;各给药组同模型对照组相比,均可使 BUN、Scr明显降低(P <0.05).芪丑汤中剂量组同依那普利组比较有差异性(P<0.05).

图1 芪丑汤对单侧输尿管梗阻大鼠血清Scr的影响)

图2 芪丑汤对单侧输尿管梗阻大鼠血清BUN的影响()
3.4 芪丑汤对单侧输尿管梗阻大鼠血清总胆固醇(CHO)、甘油三酯(TG)的影响
图3、4结果表明:模型组与假手术组比较血清CHO、TG明显升高(P<0.01);各给药组与模型对照组相比均可使CHO、TG明显降低(P<0.01).芪丑汤中剂量组与依那普利组比较有的差异性(P<0.05).
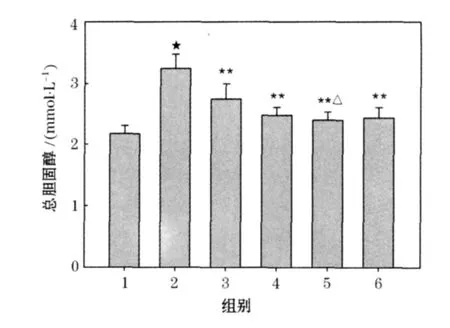
图3 芪丑汤对单侧输尿管梗阻大鼠血清CHO影响()

图4 芪丑汤对单侧输尿管梗阻大鼠血清TG的影响()
3.5 芪丑汤对单侧输尿管梗阻大鼠RBC、Hb的影响
从图5、6结果看出:模型组与假手术组比较,RBC、Hb明显降低(P<0.01),表明大鼠单侧输尿管梗阻后可使RBC、Hb浓度降低.各治疗组与模型组比较,可使 RBC、Hb明显升高(P<0.01,P<0.05);中剂量组与依那普利组比较,RBC、Hb有明显的差异性(P<0.05);表明芪丑汤对单侧输尿管梗阻大鼠引起的RBC、Hb浓度降低具有明显的升高作用,并且作用强度强于依那普利阳性组,且以中剂量作用为最佳(P<0.05).
3.6 芪丑汤对单侧输尿管梗阻大鼠肾组织α-SMA、ColⅢ表达的影响

图5 芪丑汤对单侧输尿管梗阻大鼠RBC的影响()
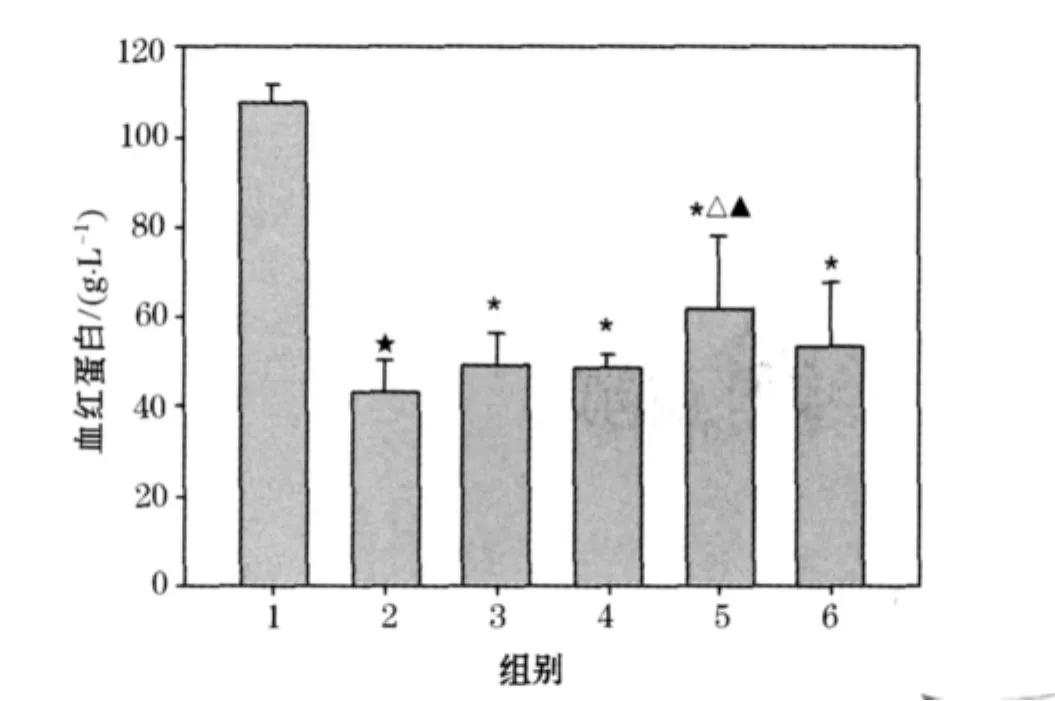
图6 芪丑汤对单侧输尿管梗阻大鼠Hb的影响()
表1结果表明:模型组与假手术组比较,大鼠肾组织α-SMA、COlⅢ的表达有显著性差异(P<0.01);各给药组与模型组比较,均可使α-SMA、ColⅢ的表达明显降低(P<0.01).芪丑汤中剂量组与依那普利组比较有差异性(P<0.05).
表1 芪丑汤对单侧输尿管梗阻大鼠肾组织α-SMA、COlⅢ表达的影响()
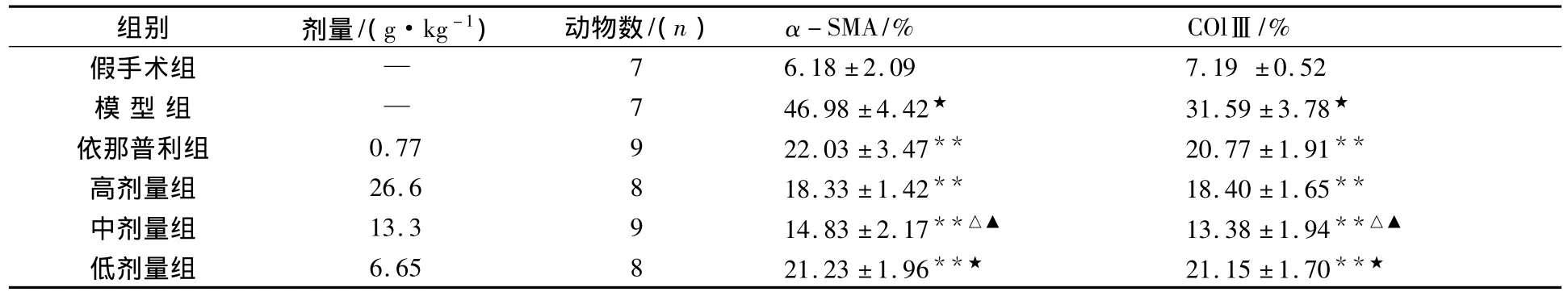
表1 芪丑汤对单侧输尿管梗阻大鼠肾组织α-SMA、COlⅢ表达的影响()
4 讨论
近来国外的研究表明:肾小管上皮细胞-肌纤维母细胞表型转化,在人类肾间质纤维化相关的肾脏疾病和动物模型中扮演了重要角色.α平滑肌肌动蛋白(α- smooth muscular actin,α-SMA),已被公认为肌纤维母细胞的标志蛋白,用免疫组织化学的方法观察到,在正常肾组织,α-SMA只在肾脏血管中层表达,而在肾小球和肾间质中几乎无表达.在肾脏病理条件下,α-SMA可在肾小球系膜区、肾小球周围间质、萎缩的小管周围纤维化区域及血管周围表达并增生,参与肾脏纤维化形成[6-7].本实验结果显示,在单侧输尿管梗阻大鼠术后第12天肾间质区域可见大量的α-SMA强阳性表达细胞,提示肾间质纤维化后已有大量的肾小管上皮细胞转化为肌纤维母细胞,且在α-SMA表达增强的同时伴有Ⅲ型胶原蛋白的高度表达.
肾小管间质纤维化它以过量细胞外基质(如胶原Ⅲ型)在肾间质积聚及肾间质成纤维细胞增生为特征.本研究采用VG胶原染色可以清晰的观察到间质内胶原随着病变的加重其沉积逐渐增多.胶原纤维呈束状或灶状增生,深粉红色.经芪丑汤治疗后间质内胶原沉积逐渐减少,阳性信号面积比明显降低,颜色变浅,与依那普利组比较具有明显的差异性(P <0.05).
尿素的长期毒性作用与其代谢产物氰酸盐有关,它可使蛋白质发生氨基甲酰化,如在触突体膜蛋白发生这一变化时,高级神经中枢的整合功能可受到损害.肌酐是肌肉内磷酸肌酸的代谢产物,有人报告肌酐具有溶血、抑制组织对葡萄糖和氧的摄取、抑制红细胞增殖与成熟等作用.本实验结果表明(见表1),芪丑汤可明显改善RIF大鼠肾功能,加速BuN、Scr等有毒物质排出,延缓RIF发展趋势.芪丑汤中剂量组同阳性药依那普利组比较,BUN、Scr具有明显的差异性(P<0.05);表明芪丑汤对大鼠单侧输尿管梗阻后引起的BUN、Scr升高具有明显的降低作用,并且作用强度强于依那普利阳性药.方中大黄能改善氮质代谢,这是因为大黄能减少肠道对氨基酸(合成尿素的原料)的吸收,增加谷氨酰酶合成酶活性,促进氨合成氨酰胺和蛋白质,并且抑制肝、肾组织合成尿素,抑制蛋白质分解,减少尿素和肌酐的生成,促进尿素和肌酐从肾脏排出[8].药理研究表明:黄芪、人参、附子、丹参、水蛭均可降 BuN、Scr[9].
近年研究表明,血胆固醇、低密度脂蛋白(LDL)、氧化型低密度脂蛋白(Ox-LDL)、极低密度脂蛋白(VLDL)、中间密度脂蛋白(IDL)及其中间代谢产物与肾间质炎症及纤维化的进展密切相关,且皮质中胆固醇的含量与肾小管间质损伤的严重性呈正相关[10]本实验结果表明,芪丑汤对肾间质纤维化大鼠所引起的CHO、TG升高具有降低作用,与阳性药依那普利组比较有差异性(P<0.05).
现代医学认为,肾性贫血的发病机理主要是由于肾脏产生促红细胞生成素(EPO)减少,还与营养性贫血、慢性失血性贫血以及体内毒素对骨髓造血的抑制有关.近有学者报道红细胞膜结构和功能的改变,也是肾性贫血的机制之一,改善造血微环境、恢复红细胞膜的正常和功能利于其病的治疗[11].本实验研究结果表明:各治疗组与模型组比较,可使RBC、Hb明显升高(P<0.01);中剂量组与依那普利组比较,RBC、Hb有明显的差异性(P<0.05).方中黄芪、人参、茯苓、白术健运脾胃以培后天之本;大黄通腑泄浊;半夏化浊降逆;砂仁理气和胃;丹参行气活血,共奏补脾益肾,益气生血之功.现代药理研究:黄芪能促进红细胞和血红蛋白增加[12].
[1]TANG W W,VAN G Y,QI M.Myofibroblast and alpha 1(III)collagenexpression in experimental tubulointerstitial nephritis[J].Kidney Int,1997 ,51(4):926.
[2]张 翠.芪丑汤对肾大部切除大鼠白细胞黏附分子CD11b,CD44调控机制的研究[J].中国中药杂志,2005,30(24):1953.
[3]张 翠.温补脾肾、泄浊化瘀法对慢性肾功能衰竭患者CD44、CD54、TNF-a表达调节的影响[J].中国中药杂志,2007,32(2):142.
[4]薛 痕,樊均明,陈 亮,等.大鼠肾间质纤维化动物模型的实验研究[J].四川动物,2004,23(1):16.
[5]RADFORD G,DONADIO J.Predicting renal outcome in IgA nephroPathy[J].J Am Soc Nephrol,1997,8(2):199.
[6]MUCHANETA K E C.Myofibroblast phenotypes expression inexperimental renal scarring[J].Nephrol Dial Trans ,1997 ,12(5):904.
[7]BOUKHALFA G,DESMOULIERE A,RONDEAU E,et al.Relationship betweenalpha-smooth muscle actin expression and fibrotic changes in human kidney[J].Exp Nephrol.,1996 ,4(4):241.
[8]郑 丰,黎磊石.大黄对肾小管细胞增殖的影响[J].中华医学杂志,1993,73(6):34.
[9]联广信,史玲艾.虫类入终药为主治疗慢性肾功能衰竭28例[J].河北中医,1999,21(2):99.
[10]李 娅.血脂与肾间质纤维化[J].国外医学:内科学分册,2001,28(10):429.
[11]刘 惠,邹成钢,段永寿,等.尿素症患者红细胞结构和功能的改变及其意义[J].中华肾脏杂志,1998,14:270-271.
[12]陈双华,蒋成燕,曹健林.益肾解毒方治疗肾性贫血疗效分析[J].中国中西医结合肾病杂志,2004,10(5):588.

