成年C57BL/6小鼠空肠Cajal间质细胞的分离、培养及鉴定
刘登群,龙 爽,王军平,史春梦,冉新泽,粟永萍
第三军医大学军事预防医学院防原医学教研室全军复合伤研究所创伤、烧伤与复合伤国家重点实验室,重庆400038
正常的胃肠道运动功能是机体消化吸收营养物质、传递神经信号及抵抗外源致病菌入侵的重要生理基础。胃肠道运动功能的产生和维持是胃肠道神经元、平滑肌细胞以及Cajal间质细胞(interstitial cells of Cajal,ICC)三者协同作用的结果[1-2]。由于 ICC 能够自发产生电慢波,且能够介导神经递质从神经元向平滑肌的传导过程,因此探讨ICC的生物学行为对进一步阐明胃肠运动机制、治疗胃肠运动功能障碍具有重要意义。目前对ICC的研究多限于动物在体模型,也曾文献报道过ICC的体外分离培养,但其通常使用幼年动物,分离效率、细胞纯度均有较大差异。本文在综合分析以往报道的基础上,提出可以联合使用酶消化-组织块培养方法培养成年C57BL/6小鼠的空肠ICC。该方法能够较方便地实现ICC的体外培养,为进一步研究其在胃肠运动中的作用及机制提供了一定的细胞模型。
1 材料与方法
1.1 实验动物与试剂 正常6~8周龄的C57BL/6小鼠购自第三军医大学实验动物中心。DMEM/F12培养基购自 Hyclone公司,重组小鼠干细胞因子(mSCF)、Ⅱ型胶原酶购自Sigma公司,胎牛血清购自Gibco公司,大鼠抗小鼠c-Kit抗体购自eBioscience公司,小鼠抗平滑肌激动蛋白(SMA)购自Santa Cruz,封闭用正常山羊血清购自北京中山公司,100×青霉素-链霉素溶液、Cy3标记山羊抗大鼠二抗、FITC标记羊抗小鼠二抗、Fluo-3 AM钙离子荧光探针购自碧云天公司。
1.2 肌条分离与消化 小鼠禁食24 h后开始实验。颈椎脱臼法处死小鼠,使用酒精对腹部进行消毒后,超净台上打开腹腔,截取空肠中段约5 cm的小肠,仔细剥去肠系膜和血管,在已加入双抗的4℃ D-Hanks液中纵行剖开小肠,将内容物漂洗干净,转入干净的上述D-Hanks液中。解剖显微镜下仔细剥去小肠黏膜层和黏膜下层,仅留取肌层。撕取一定数量肌层组织后,将肌条剪碎至2 mm3左右小块后放入含有Ⅱ型胶原酶(1.3 mg/mL)的EP管内,置于37℃消化20 min,期间振荡混匀数次,随后1 000 r/min离心3 min,弃上清,加入完全培养基进行重悬。
1.3 组织块悬液的培养 将DMEM/F12完全培养基(含90%DMEM/F12,10%FBS,10 ng/mL SCF,1%的100×青霉素-链霉素)重悬后的组织悬液加入到6孔板中,板中预先放入鼠尾胶原包被的小盖玻片。将6孔板放入37℃培养箱内,5%CO2条件下培养。接种72 h后进行首次换液,小心洗去组织块,加入足量完全培养基继续培养,此后每3 d换液一次,观察细胞生长情况。
1.4 培养细胞的鉴定
1.4.1 小肠肌层分离效果确认:使用4%多聚甲醛将细胞固定培养前分离得到的小肠平滑肌肌条和完整的小肠,常规脱水并石蜡包埋,切片进行HE染色,以确认分离所得组织是否为小肠环形肌和纵行肌。
1.4.2 培养细胞的形态学观察:倒置显微镜观察培养不同时间的组织块和细胞形态,使用Olympus BX51数码相机拍照。
1.4.3 免疫荧光染色:细胞培养7 d后,使用Histochoice MB对细胞进行固定,固定后半小时取出细胞爬片进行免疫荧光检测。染色主要步骤:使用0.01 mol/L的PBS充分漂洗玻片,滴加含有0.1%Triton X-100的0.01 mol/L PBS进行透膜处理,室温条件下作用20 min。PBS漂洗后滴加封闭用正常山羊血清,室温下封闭30 min。加入1∶100稀释的c-Kit单克隆抗体,置于4℃过夜,次日PBS漂洗玻片后加入1∶250稀释的Cy3标记羊抗大鼠二抗,室温条件下避光孵育1 h,PBS漂洗后继续加入1∶100稀释的小鼠抗平滑肌激动蛋白(SMA)一抗,4℃过夜孵育后漂洗玻片并加入1∶100稀释的FITC标记羊抗小鼠二抗,室温避光孵育1 h,PBS漂洗后DAPI复染胞核。抗荧光淬灭水溶性封片剂封片,激光共聚焦显微镜下观察染色效果并照像。
1.4.4 培养细胞的钙离子流检测:配置终浓度为5 μmol/L的Fluo-3 AM完全培养基,使用该培养基对细胞进行换液,于37℃孵育50 min进行荧光探针装载,随后更换为普通完全培养基,继续于37℃孵育20 min,以确保Fluo-3 AM在细胞内完全转变为Fluo-3。使用激光共聚焦显微镜进行照相并分析细胞内钙,激发波长为488 nm,发射波长为525~530 nm。
2 结果
2.1 石蜡切片证实分离的组织为空肠肌层 解剖显微镜下分离所得组织石蜡包埋后切片,进行HE染色,可见该组织仅含有空肠的平滑肌,包括纵行肌和环形肌,不含黏膜层和黏膜下层(见图1)。该组织培养所得ICC主要属于ICC-MY亚型。
2.2 培养所得细胞具备ICC的形态特点 培养24 h后可见有少量细胞贴壁(见图2A),继续培养至72 h,可见大量细胞从平滑肌组织中爬出并贴壁生长(见图2B)。培养5~7 d后,可见培养所得细胞呈梭形,且有2~3个细长突起,同时细胞之间彼此相互连接,类似在体的ICC细胞网络(见图2C、2D)。
2.3 免疫荧光染色鉴定细胞表型 c-Kit阳性是目前确认细胞是否为ICC的重要指标。使用免疫荧光双标对培养至2周的细胞进行表型分析,可见该细胞呈c-Kit阳性(见图3A),而平滑肌细胞标志物平滑肌肌动蛋白(SMA)呈阴性(见图3B),DAPI复染细胞核后可见c-Kit阳性细胞均为SMA阴性(见图3C、3D)。此外结合该细胞的形态学特点,可以排除肥大细胞污染。因此免疫表型分析可证实培养所得细胞为ICC,而不是平滑肌细胞。
2.4 Fluo-3 AM染色证实该细胞具有钙离子波动 使用Fluo-3 AM染色后,在共聚焦显微镜下,可以看到ICC的胞浆中含有一定的钙离子(见图4A)。在不改变培养基中钙离子浓度的条件下,细胞胞浆中的钙离子浓度能够周期性的自发增加(见图4B),提示该培养的ICC细胞能够自发产生钙离子振荡,具备形成慢波的功能。
3 讨论
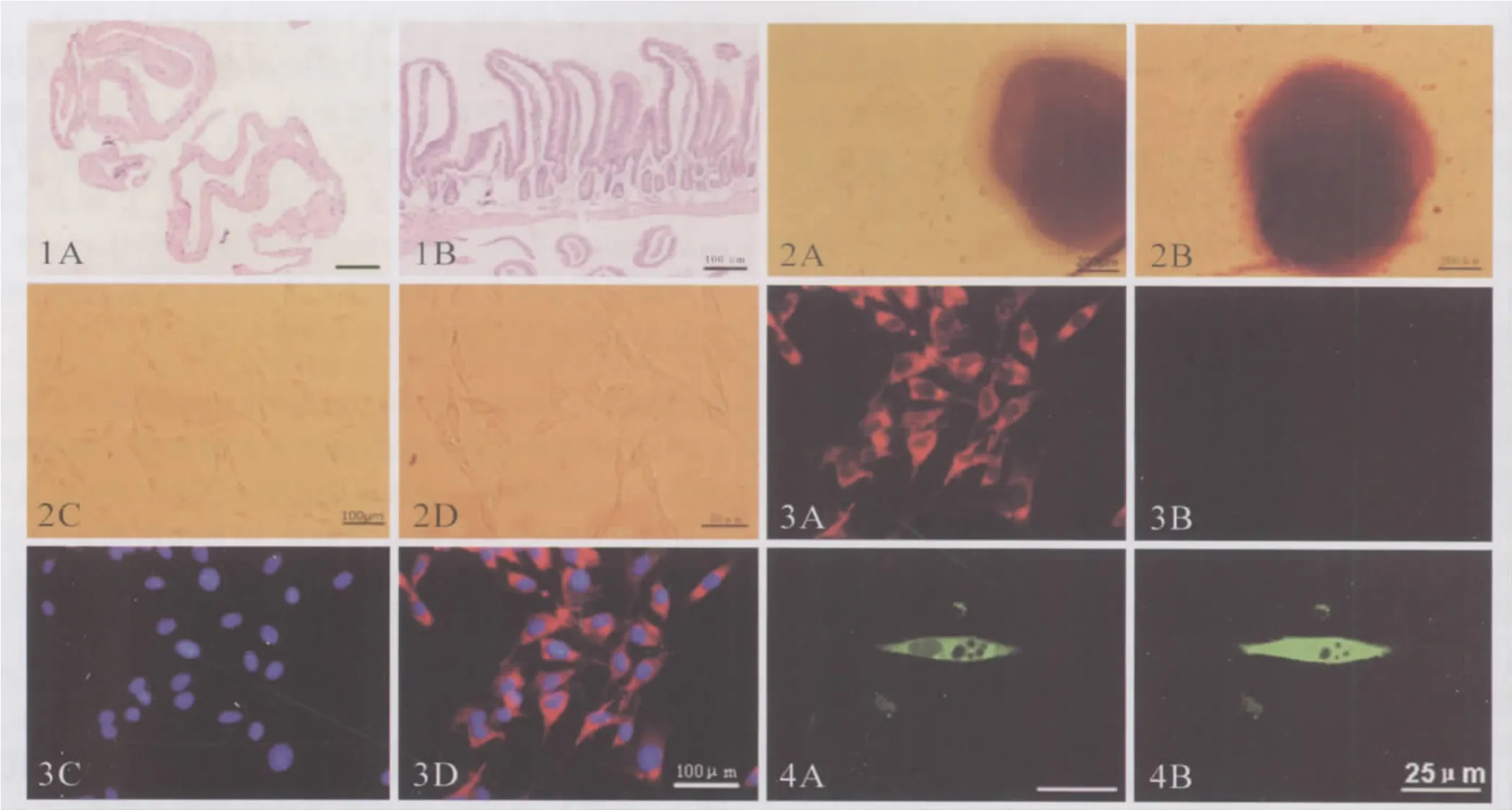
图1 HE染色确认分离组织的结构特点 A:分离所得组织的HE染色,可见仅含小肠肌层组织;B:撕片前完整小肠的HE染色(Bar=100 μm);图2 不同培养时间ICC细胞形态 A:培养24 h可见少量细胞贴壁;B:培养72 h可见大量细胞围绕组织块生长;C、D:培养至5~7 d的ICC细胞呈梭形,胞体有2~3个细胞突起,且彼此之间交织成细胞网络;图3 培养细胞的免疫荧光染色 A:Cy3标记二抗显示该细胞呈c-Kit阳性;B:FITC标记二抗显示该细胞呈SMA阴性;C:DAPI染色显示细胞核位置;D:叠加图像证实培养的细胞表达c-Kit而不表达SMA(Bar=100 μm);图4 培养的ICC自发产生钙离子振荡 A:细胞处于基础状态时的Fluo-3染色;B:细胞胞浆钙离子释放时的Fluo-3染色(Bar=25 μm)Fig 1 HE staining identified the structural characteristics of isolated tissues A:HE staining of isolated tissue showed that it only contained the muscle layer of small intestine;B:HE staining of whole small intestine before whole mount preparation(Bar=100 μm);Fig 2 Morphology of cultured ICC at different phase points A:several attached cells could be found at 24 h;B:Many cells attached around the tissue at 72 h;C,D:ICC cultured for 5~7 days appeared to be spindle shaped,contained 2~3 processes,and formed network structure;Fig 3 Immunofluorescence staining of cultured ICC A:Cy3 signals indicated c-Kit positive cells;B:No FITC signals indicated these cells were SMA negative;C:DAPI showed cell nucleus;D:Merged image showed cultured cells expessed c-Kit but not SMA(Bar=100 μm);Fig 4 Cultured ICC generated spontaneous calcium oscillation A:Basic Fluo-3 staining of ICC;B:Spontaneously increased Fluo-3 signals in cytoplasm of cultured ICC(Bar=25 μm)
1893 年西班牙神经解剖学家Cajal通过甲基兰和镀银染色在豚鼠和家兔小肠发现了Cajal间质细胞(interstitial cells of Cajal,ICC),随后学者们相继证实ICC在正常胃肠运动产生和维持及胃肠动力障碍性疾病的发生过程中重具有重要作用。大量的研究表明ICC具有产生电慢波功能,能够起搏胃肠运动,介导胃肠神经元和平滑肌细胞之间的信号传导。以往对ICC的研究大多使用动物在体模型,然而由于在体实验影响因素较多,因而学者们尝试对ICC进行体外培养,以进一步研究其生物学特性。截止目前,国内外培养ICC 的方法主要包括消化培养[3,6]和组织块培养[7],这两种培养方法各有利弊。不同发育阶段中的ICC细胞网络和增殖能力不同,与幼年动物的ICC相比,成年动物的ICC在正常条件下增殖能力较低,但损伤后可出现增殖[8-9]。为了使分离所得细胞更接近实际需要,我们尝试联合使用酶消化和组织块培养这两种方法来培养成年小鼠的空肠ICC。
根据解剖位置的不同,胃肠道的ICC被分作四种亚型,分别为黏膜下ICC(submucosal ICC,ICC-SM)、肌内ICC(intramuscular ICC,ICC-IM)、肌间丛ICC(myenteric ICC,ICC-MY)和深肌丛ICC(deep muscular plexus ICC,ICC-DMP)。在小鼠空肠中,ICC-MY是发挥起搏功能的主要细胞类型。因此我们在分离小肠肌条的过程中,通过HE染色确认分离所得肌条为空肠的环形肌和纵行肌,而不含有黏膜层和固有层,减少了其他杂细胞的污染。
以往有关ICC分离培养的方法中均使用到了Ⅱ型胶原酶,使用该胶原酶能够较方便地消化肌条组织,进而获得较多的单细胞。然而这种方法在获取单细胞的同时,会造成ICC细胞表面相应受体(特别是c-Kit受体)的破坏,降低细胞活力[5]。因而在本实验中,我们尝试将胶原酶的消化时间缩短至20 min,这样既对肌条进行了适度消化以便ICC从肌条中脱离,同时保证不过度损伤ICC活性。吴志轩等曾报道使用组织块培养法培养幼鼠空肠ICC[7],此方法的优势在于能够最大程度保持ICC细胞的组织微环境特点,提供维持ICC生长和表型的多种信号刺激。我们发现使用组织块法培养成年小鼠的小肠平滑肌时,通常需要1周左右时间才有细胞从肌条中爬出并贴壁生长,且细胞数量较少。而使用胶原酶消化后的肌条进行培养,3 d左右即有大量细胞贴壁生长,因此联合使用酶消化和组织块培养能够更方便获得ICC,该细胞呈梭形,具有2~3个细胞突起,彼此之间相互交织成网络状。
酪氨酸激酶受体c-Kit是ICC重要的标志分子和功能分子,c-Kit/SCF信号刺激对于维持ICC的表型至关重要,因此在培养ICC时需要加入适量的SCF。考虑到培养过程中SCF的消耗和降解,本实验中我们增加了培养基中SCF的浓度,结果表明培养至14 d左右的ICC仍能保持c-Kit阳性。肌层中另一类c-Kit阳性的细胞是肥大细胞,但其通常呈圆形,可以从形态上与ICC相区分。研究表明周期性的钙离子振荡(calcium oscillation)是ICC产生电慢波的基础[10]。我们使用Fluo-3 AM对培养的ICC进行染色,共聚焦显微镜观察该细胞胞浆中的钙离子浓度能够自发地周期性波动,提示培养所得细胞具备产生电慢波的能力。在使用该方法培养ICC时,培养所得细胞中有时会混有一定量的平滑肌细胞,可以通过适当缩短首次换液时间减少平滑肌细胞的数量。
综上所述,本文证实联合使用胶原酶消化和组织块培养能够较方便地培养出成年小鼠的空肠ICC。该方法的建立为进一步研究成年小鼠空肠ICC的生物学行为和机制提供相对单一的细胞模型,该模型亦可用于多种胃肠运动障碍疾病中ICC功能异常机制的研究。
[1]Huizinga JD,Zarate N,Farrugia G.Physiology,injury,and recovery of interstitial cells of Cajal:basic and clinical science[J].Gastroenterology,2009,137(5):1548-56.
[2]Streutker CJ,Huizinga JD,Driman DK,et al.Interstitial cells of Cajal in health and disease.Part II:ICC and gastrointestinal stromal tumours[J].Histopathology,2007,50(2):190-202.
[3]Li CX,Tong WD,Liu BH,et al.Isolation and culture of interstitial cells of Cajal[J].Journal of Digestive Surgery,2004,3(4):267-269.李春穴,童卫东,刘宝华,等.Cajal间质细胞的分离、培养方法探讨[J].消化外科,2004,3(4):267-269.
[4]Zhao P,Han YF,Huang X,et al.Characterization of Cajal-like cells freshly isolated from mouse stomach and their electrophysiological features[J].Acta Biophysica Sinica,2008,24(4):277-281.赵鹏,韩燕飞,黄旭,等.新鲜分离小鼠胃Cajal间质细胞样细胞的鉴定及其电生理学特性[J].生物物理学报,2008,24(4):277-281.
[5]Koh SD,Sanders KM,Ward SM.Spontaneous electrical rhythmicity in cultured interstitial cells of cajal from the murine small intestine[J].J Physiol,1998,513(Pt 1):203-13.
[6]Ordog T,Redelman D,Horowitz NN,et al.Immunomagnetic enrichment of interstitial cells of Cajal[J].Am J Physiol Gastrointest Liver Physiol,2004,286(2):G351-60.
[7]Wu ZX Yu BP,Xia H,et al.Isolation and culture of interstitial cells of Cajal in mice jejunum[J].Chin J Gastroenterol Hepatol,2005,15(5):455-457.吴志轩,余保平,夏虹,等.小鼠空肠Cajal间质细胞的分离与培养[J].胃肠病学和肝病学杂志,2005,15(5):455-457.
[8]Mei F,Zhu J,Guo S,et al.An age-dependent proliferation is involved in the postnatal development of interstitial cells of Cajal in the small intestine of mice[J].Histochem Cell Biol,2009,131(1):43-53.
[9]Mei F,Guo S,He YT,et al.Apoptosis of interstitial cells of Cajal,smooth muscle cells,and enteric neurons induced by intestinal ischemia and reperfusion injury in adult guinea pigs[J].Virchows Arch,2009,454(4):401-409.
[10]Torihashi S,Fujimoto T,Trost C,et al.Calcium oscillation linked to pacemaking of interstitial cells of Cajal:requirement of calcium influx and localization of TRP4 in caveolae[J].J Biol Chem,2002,277(21):19191-19197.

