对比晚期大肠癌三种不同化疗途径的疗效
朱小三,戴益琛,陈章兴,谢军培,曾 伟,傅育卡,林园园,连清娜,桑巧芳,詹晓娟
解放军174医院消化内科,福建厦门361003
大肠癌发病率逐年增加,且就诊时大部分患者已属中晚期,常因癌肿梗阻无法排便导致机械性肠梗阻、便血,甚至危及生命[1]。因此,大肠癌患者需要一种安全、有效的治疗方法。观察我院2004年5月~2010年1月120例晚期大肠癌患者行全身静脉化疗、口服化疗及5-FU化疗粒子植入术疗效,发现5-FU化疗粒子植入治疗较其他两组疗效佳,现报道如下。
1 资料与方法
1.1 临床资料 本组120例患者中男79例,女41例;年龄29~81岁,平均(51±3)岁;经病理及影像学检查证实为大肠腺癌且均属Dukes D期;原发病灶长度2~9 cm,平均5.5 cm;其中肝转移25例,腹腔淋巴结转移102例,盆腔转移41例,合并癌性腹水9例;血常规、肝肾功能及心电图未见明显异常;KPS评分≥70分。
1.2 治疗方法
1.2.1 全身静脉化疗:A组患者行奥沙利铂(L-OHP)85 mg/m2持续静脉滴入3 h,第1天;亚叶酸钙(CF)0.2 g/m2静脉滴入2 h,第1、2天;5-氟尿嘧啶(5-FU)400 mg/m2静脉推注,第1、2天,再600 mg/m2静脉滴入维持22 h;2周后重复1次,治疗4个周期为止,化疗期间每周查血常规、肝肾功能及电解质,嘱患者化疗期间忌冷饮食、水。
1.2.2 口服希罗达化疗:B组患者每日口服希罗达2 000 mg/m2,餐后早晚2次,持续2周,休息1周为1个周期,连续3个周期,每个周期前后均查血常规、肝肾功能。
1.2.3 5-FU化疗粒子植入术:化疗粒子推注器末端由肠镜活检孔进入,暴露针尖后,先上后下,先中心后外周的方法对肿瘤灶进行标记,将植入器依次刺入标记位置,每点释放3~4枚化疗粒子,每次植入100个粒子,约5-Fu 200 mg,1周植入一次,间歇4周再行一次。
1.3 疗效观察 治疗6个月后复查CT及肠镜进行综合评估原发病灶大小情况,应用1998年WHO实体瘤近期评价标准(RECIST 1.0)[2]:①完全缓解(CR):肿瘤完全消失;② 部分缓解(PR):肿瘤缩小≥50%,并持续1个月以上;③稳定(SD):肿瘤缩小<50%或增大<25%;④ 进展(PD):肿瘤增大≥25%。CR、PR及SD视为有效,否则视为无效。统计病灶治疗有效率,1、2年生存率及治疗过程中并发症发生情况。
1.4 统计学方法 采用SPSS 15.0统计软件进行分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组1、2年生存率情况 3组1、2年生存率分别为 77.50%、60.00%;70.00%、50.50%;75.00%、57.50%,且差异有统计学意义(χ2=6.11;P<0.05)。
2.2 3组治疗后并发症情况 治疗后采用电话方式随访所有病例(全部病例无失访),了解治疗过程中并发症情况,主要评估有无便血、穿孔、呕吐、再狭窄等,A、B组并发症发生率明显高于C组,差异有统计学意义(χ2=6.83;P <0.05)(见表1)。
2.3 3组治疗后原发病灶治疗有效情况 根据治疗6个月后复查腹部、盆腔CT及肠镜结果进行综合评估原发灶大小,A、C组有效率高于B组,差异有统计学意义(χ2=6.29;P <0.05)(见表2)。
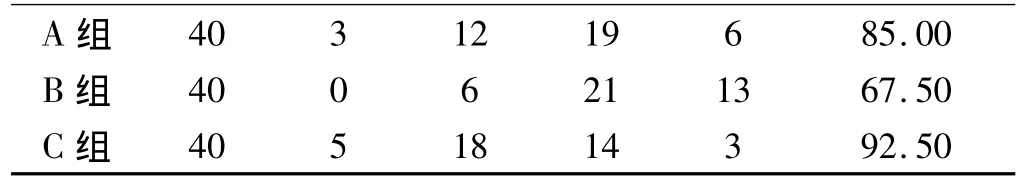
表2 3组治疗有效率比较Tabl 2 Comparison of the efficacy among the three groups
3 讨论
晚期大肠癌患者常因原发灶梗阻及远涉脏器转移导致生活质量及生存率明显下降,甚至直接全身衰竭死亡。对于已失去手术机会的晚期大肠癌患者内科保守治疗成为主要的治疗方法,常见方法有化疗、放疗、内镜下治疗、中医中药、综合治疗等[3]。我院对120例晚期大肠癌患者进行全身静脉化疗、口服希罗达化疗及5-FU化疗粒子植入术,比较1、2年生存率、并发症发生率及有效率,发现5-FU化疗粒子植入治疗晚期大肠癌疗效明显。
奥沙利铂(L-OHP)是继顺铂和卡铂之后的第三代铂类化合物,阻断DNA复制和转录,与传统铂类抗瘤活性谱和耐药机制不完全相同,因此,无完全交叉耐药,同时发现其与5-Fu有良好的协同作用,是目前治疗晚期大肠癌的有效方案[4-5]。因L-OHP遇冷副作用会加剧,故化疗前嘱患者忌冷饮食。A组1、2年生存率较B组明显提高(P<0.05),但两组并发症较多,如呕吐、头晕、腹痛等,其中A组出现1例便血,考虑因肿瘤组织过度坏死导致出血可能性大。结合内镜及影像学检查发现肿瘤原发灶较前缩小,与B组相比差异有统计学意义(P<0.05),但与5-FU化疗粒子植入术相比1、2年生存率及有效率相当,并发症发生率较高,有显著差异(P<0.05)。
希罗达又名卡培他滨(Capecitabine),是新一代口服氟脲嘧啶类药物,在体内经肝脏转化生成有效的代谢产物(5'-脱氧-5-氟胞嘧啶核苷),进而形成对肿瘤有活性的5-Fu,最终影响肿瘤细胞DNA合成达到抗肿瘤的作用[6-7]。该药给药途径方便,尤其适用于老年体质弱、行动不便的晚期大肠癌患者。B组1、2年生存率及有效率明显低于其他两组,但其副作用与全身静脉化疗相当,可以因药物体内蓄积所致毒性反应,因此,需动态监测血常规、肝肾功能情况,治疗后原发肿瘤灶缩小不明显。
5-Fu化疗粒子植入术为近年来新起的消化道肿瘤常用内镜下治疗方法,其活性成分在体内“以假乱真”的方式阻断脱氧嘧啶核苷酸转变为脱氧胸腺嘧啶核苷酸,从而抑制DNA的生物合成。该治疗为局部给药,可局部长效、高浓度杀伤肿瘤细胞,与全身静脉化疗相比毒副作用明显减轻,同时加大肿瘤灶药物负荷剂量[8-9]。本组40例治疗后复查肠镜及局部CT病灶均明显减缩,排便顺畅,1、2年生存率及有效率均高于B组,且并发症发生率均较其他两组低,因其操作简便、住院时间较短,该治疗方法逐渐被患者接受。
综上所述,晚期大肠癌特别是已失去手术时机、不能耐受手术或不愿手术的患者,在同时兼顾生存率、并发症发生率及有效率的基础上,内镜下5-FU化疗粒子植入术不失为一种有效、安全的治疗途径。
[1]Shimizu H,Taniguchi F,Sonoda H,et al.Two cases of advanced rectal cancer resected successfully after neoadjuvant chemotherapy with FOLFOX regimen[J].Gan To Kagaku Ryoho,2009,36(12):2073-2075.
[2]Nishino M,Jackman DM,Hatabu H,et al.New Response Evaluation Criteria in Solid Tumors(RECIST)guidelines for advanced non-small cell lung cancer:comparison with original RECIST and impact on assessment of tumor response to targeted therapy[J].AJR Am J Roentgenol,2010,195(3):W221-W228.
[3]Derwinger K,Kodeda K,Gerjy R.Age aspects of demography,pathology and survival assessment in colorectal cancer[J].Anticancer Res,2010,30(12):5227-5231.
[4]Ohnishi T,Kanoh T,Tono T,et al.Adjuvant chemotherapy with FOLFOX4 regimen after curative resection of liver metastases from colorectal cancer[J].Gan To Kagaku Ryoho,2010,37(12):2554-2556.
[5]Des Guetz G,Lecaille C,Mariani P,et al.Prognostic impact of microsatellite instability in colorectal cancer patients treated with adjuvant FOLFOX[J].Anticancer Res,2010,30(10):4297-4301.
[6]von Moos R,Roth A,Ruhstaller T,et al.Oxaliplatin,irinotecan and capecitabine(OCX)for first-line treatment of advanced/metastatic colorectal cancer:a phaseⅠ trial(SAKK 41/03)[J].Onkologie,2010,33(6):295-299.
[7]Chan AK,Wong AO,Jenken DA.Preoperative capecitabine and pelvic radiation in locally advanced rectal cancer--is it equivalent to 5-FU infusion plus leucovorin and radiotherapy?[J].Int J Radiat Oncol Biol Phys,2010,76(5):1413-1419.
[8]Nicolini A,Conte M,Rossi G,et al.Additional 5-FU-LV significantly increases survival in gastrointestinal cancer[J].Front Biosci(Elite Ed),2011,3:1475-1482.
[9]Gusella M,Frigo AC,Bolzonella C,et al.Predictors of survival and toxicity in patients on adjuvant therapy with 5-fluorouracil for colorectal cancer[J].Br J Cancer,2009,100(10):1549-1557.

