双歧杆菌对实验性结肠炎中趋化因子的影响
吴正祥,丁 洁,杨九华,吴 强,杨 枫
1.安徽省立医院消化内科,安徽合肥230001;2.安徽医科大学第一附属医院检验科;3.安徽医科大学病理学教研室
活化的Th1细胞促进了大量的巨噬细胞和中性粒细胞浸润和活化,引起肠黏膜的透壁性炎症,以持续的、不能控制的炎性细胞因子和趋化因子的释放为特征[1]。CC趋化因子配体20(CC chemokine ligand 20,CCL20)属cc亚族,通过与其受体CC趋化因子受体(CC chemokine receptor 6,CCR6)的作用,趋化未成熟树突状细胞进入结肠黏膜,同时活化和趋化淋巴细胞[2-4]。钟万锷等[5]研究CCL20表达的强弱与炎症程度呈正相关,与其受体CCR6的表达具有相关性。双歧杆菌在肠道内通过诱导激活免疫反应而发挥免疫调节作用,且对宿主无毒副作用,适合长期服用。本实验观察应用双歧杆菌在三硝基苯磺酸 (TNBS)/乙醇诱导的结肠炎模型中对趋化因子CCL20及其受体CCR6表达及炎症因子白细胞介素(interleukin 10,IL-10)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)变化的影响,探讨双歧杆菌在IBD治疗的可能作用与机制。
1 材料与方法
1.1 材料 SPF级雄性Sprague-Dawley(SD)大鼠,体质量180~220 g;由安徽医科大学动物实验中心提供;2,4,6-三硝基苯磺酸(trinitrobenzene sulfonic acide,TNBS),Sigma公司;双歧杆菌活菌胶囊(丽珠集团丽珠制药厂,国药标字:S10960040);CCL20、CCR6、IL-10 及TNF-α酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒(R&D From USA Components assembled in China Expirtion:08/2010);CCL20、CCR6 一抗与过氧化物酶标记的链酶卵白素(SP)染色试剂盒(北京博奥森生物技术有限公司);DAB显示剂(北京中山生物技术有限公司)。
1.2 方法
1.2.1 动物分组情况及模型建立:(1)分组:大鼠称体质量后编号,随机均分为正常对照组(N组)、TNBS模型组(M组)、干预组(双歧杆菌预防性应用组:A组;双歧杆菌治疗组:B组),每组10只。(2)TNBS/乙醇法诱导结肠炎模型[6]:大鼠适应性饲养1周,禁食不禁水24 h,按30 mg/kg剂量腹腔注射30 g/L戊巴比妥钠,麻醉后,倒悬位,将直径约2 mm的聚丙烯管经肛门缓慢插入直肠约8 cm处,正常组灌入生理盐水1 mL,造模组每只大鼠灌入 TNBS/乙醇混合溶液(按100 mg/kg的量计算TNBS加上等体积的无水乙醇)。(3)双歧杆菌菌悬液制备[7]:将丽珠肠乐1粒用PBS 1 mL稀释溶解,800 r/min离心5 min后取上清,再4 000 r/min离心10 min去上清,沉淀用1 mL PBS稀释,4℃保存备用。1 mL约含双歧杆菌5×107个。(4)处理:造模24 h后开始,A组造模前7 d始给予双歧杆菌0.1 mL灌胃,B组造模后给予双歧杆菌0.1 mL灌胃,双歧杆菌悬液浓度1×108cfu/mL[8],正常组与模型组给予生理盐水2 mL灌胃,均为每天1次,连续给药14 d。
1.2.2 观察指标及检测方法:(1)记录体质量变化、大便性状和便血情况(大便潜血试纸检测),进行疾病活动指数(disease activity index,DAI)评分。DAI=(体质量下降分数+大便性状分数+便血分数)/3。(2)大鼠结肠组织大体损伤评分和组织学损伤评分:各组大鼠均在14 d后,禁食不禁水24 h,全麻下取远端结肠约8 cm,沿纵轴剪开肠管并用冰盐水冲洗干净后,结肠大体形态损伤指数(colon macroscopic damage index,CMDI)[9]进行局部结肠大体损伤评分。此后,取病变段明显处结肠标本2 cm经40 g/L甲醛固定、石蜡包埋后切片1份进行HE染色,光镜下观察炎症浸润情况,并采用Fedorak积分标准进行组织学损伤评分[10]。(3)免疫组织化学SP法检测CCL20及CCR6:每张切片光镜下(10×40倍)随机摄取5个视野,输入计算机,Image Pro Plus软件(美国Media Cybernetics公司)进行图像分析,以累积光密度(IOD)值代表表达强度。(4)大鼠血清 CCL20、CCR6、TNF-α、和 IL-10 浓度检测:处死动物,腹主动脉采血,离心(1 500 r/min,5 min),留血清,-75℃保存待检。酶联免疫吸附实验(ELISA)检测血清含量浓度。具体方法及操作步骤按试剂盒说明书进行,根据测得标准品的A值及对应浓度结果绘制出标准曲线,根据标准曲线估算出样本中指标的浓度。
2 结果
2.1 DAI、CMDI及TDI评分 模型组DAI、CMDI及TDI评分,明显高于正常组大鼠(P均<0.01);与模型组比较,干预组DAI、CMDI及TDI评分明显下降(P均<0.01),A组与B组比较差异无统计学意义(见表1)。
表1 大鼠结肠炎DAI、CMDI和TDI评分结果(n=10,±s)Tab 1The results of DAI,CMDI and TDI(n=10,±s)

表1 大鼠结肠炎DAI、CMDI和TDI评分结果(n=10,±s)Tab 1The results of DAI,CMDI and TDI(n=10,±s)
与N组比较,aP<0.01;与M组比较,bP<0.01
组别 DAI均值 CMDI均值 TDI 0.00±0.00 0.00±0.00 0.00±0.00 M组 1.84±0.24a 6.00±1.16a 4.90±0.88a A组 0.73±0.16b 3.10±1.85b 1.90±0.74b B组 0.59±0.08b 4.67±0.56b 2.58±0.53均值N组b
2.2 大鼠结肠组织CCL20和CCR6的表达 正常组结肠组织中CCL20和CCR6少量较弱的表达,阳性颗粒见于结细胞浆中。CCL20表达主要局限于与淋巴滤泡相连的上皮细胞中;CCR6主要表达于与CCL20表达区域邻近的T细胞中,上皮下非淋巴细胞中亦有表达。模型组结肠组织CCL20、CCR6阳性表达显著高于正常组、A组和B组(P均<0.01),但A、B组之间差异无统计学意义(见表2、图1、图2)。
表2 大鼠结肠组织中CCL20和CCR6表达(n=10,±s)Tab 2 The expression of CCL20 and CCR6 in colon tissues(n=10,±s)
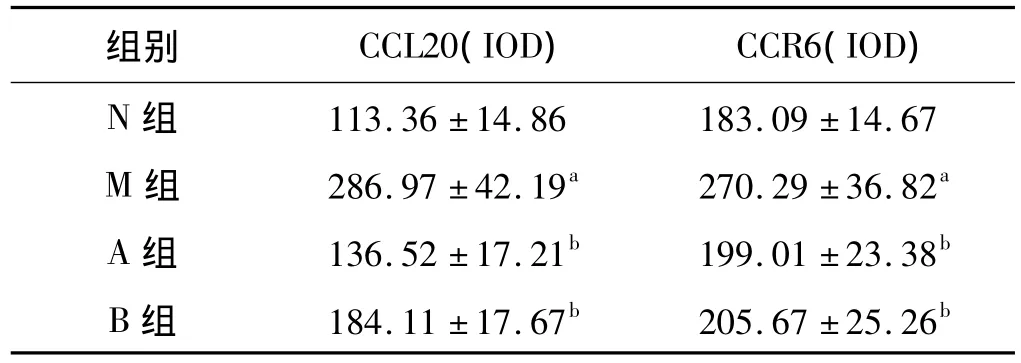
表2 大鼠结肠组织中CCL20和CCR6表达(n=10,±s)Tab 2 The expression of CCL20 and CCR6 in colon tissues(n=10,±s)
与N组比较,aP<0.01;与M组比较,bP<0.01
组别 CCL20(IOD) CCR6(IOD)N组 113.36±14.86 183.09±14.67 M组 286.97±42.19a 270.29±36.82a A组 136.52±17.21b 199.01±23.38b B组 184.11±17.67b 205.67±25.26b

图1 大鼠结肠组织CCL20的表达(SP 400×);图2 大鼠结肠组织CCR6的表达(SP 400×)MC:模型组;AC:双歧杆菌预防性应用组;NC:正常组;BC:双歧杆菌治疗组Fig 1 The expression of CCL20 in colonic tissues(SP 400×);Fig 2 The expression of CCR6 in colonic tissues(SP 400×)MC:model group;AC:Bifidobacterium prevention group;NC:normal group;BC:Bifidobacterium treatment group
2.3 大鼠血清 CCL20、CCR6、TNF-α和 IL-10浓度
先通过标准品绘制出标准曲线,通过标准曲线计算出各组样本中CCL20、TNF-α和IL-10浓度含量的平均值,经统计分析发现:模型组血清CCL20及其受体CCR6、TNF-α浓度明显高于正常组、A组和B组,差异具有显著性(均P<0.01),模型组血清IL-10浓度明显低于正常组、A组和B组,差异有显著性(均P<0.01),但A、B组之间差异无统计学意义(见表3)。
表3 大鼠结肠炎血清中CCL20、CCR6、TNF-α和IL-10的含量(n=10,±s)Tab 3 The serum levels of CCL20,CCR6,TNF-α and IL-10(n=10,±s)
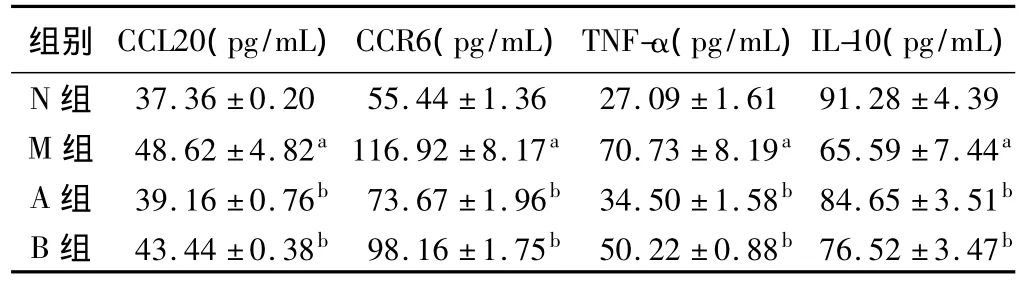
表3 大鼠结肠炎血清中CCL20、CCR6、TNF-α和IL-10的含量(n=10,±s)Tab 3 The serum levels of CCL20,CCR6,TNF-α and IL-10(n=10,±s)
与N组比较,aP<0.01;与M组比较,bP<0.01
组别 CCL20(pg/mL)CCR6(pg/mL)TNF-α(pg/mL)IL-10(pg/mL)N组 37.36±0.20 55.44±1.36 27.09±1.61 91.28±4.39 M组 48.62±4.82a116.92±8.17a 70.73±8.19a65.59±7.44a A组 39.16±0.76b 73.67±1.96b 34.50±1.58b84.65±3.51b B组 43.44±0.38b 98.16±1.75b 50.22±0.88b76.52±3.47b
2.4 相关性分析 双歧杆菌造模前应用组(A组)血清CCL20与DAI、CMDI、TDI和血清CCR6呈正相关(r=0.726、0718、0.743、0.800,P 均 < 0.05),血清CCR6与 DAI、CMDI和 TDI呈正相关(r=0.792、0.783、0.777,P均 <0.05)。结肠组织 CCL20与DAI、CMDI、TDI和 CCR6 呈正相关(r=0.790、0.792、0.804、0.786,P 均 <0.05),结肠组织 CCR6 与 DAI、CMDI和 TDI呈正相关(r=0.754、0.783、0.782,P 均<0.05)。
3 讨论
肠道免疫系统中的促炎因子与抗炎因子通过相互作用处于平衡状态,维持宿主黏膜防御能力,使肠组织免遭破坏。IBD病因及发病机制迄今还未明确,目前较多学者认为其发病机制是由多种因素相互作用,导致体内免疫系统失调,细胞因子网络平衡破坏,大量炎症细胞活化并向炎症部位趋化募集,释放多种炎症因子,引起肠组织的炎症反应[11-12]。在此过程中,趋化因子通过细胞内信号转导过程控制着渗出细胞的选择性及被选择细胞的稳固黏附。
趋化因子是具有趋化功能的细胞因子的总称,其相应受体对多种细胞如淋巴细胞、单核细胞、中性粒细胞、树突状细胞等的趋化作用在免疫反应及炎症损伤中发挥着重要作用。CCL20通过其受体CCR6的作用活化和募集淋巴细胞至结肠上皮[2];在炎症或病原微生物感染刺激下,肠上皮细胞能吸引中性粒细胞、淋巴细胞等炎症细胞至受累的肠黏膜表面,并释放细胞因子,而在众多细胞因子中TNF-α和IL-10被认为是促炎因子和抑炎因子的代表。其中TNF-α是炎症反应中关键的细胞因子,可使白细胞在炎症局部聚集,促进大量炎症因子释放,肠上皮细胞凋亡,肠黏膜破坏;且在细胞因子 IL-α、INF-α 等的作用下 TNF-κB表达上调,NF-κB 进一步上调 CCL20 及 CCR6 的表达[3]。而IL-10是一种免疫调节性细胞因子,可以抑制多种炎症性细胞因子的合成,在调节肠道细胞因子平衡、维持正常肠道黏膜免疫调节中发挥重要作用[13]。本实验中模型大鼠结肠组织和血清中CCL20及CCR6表达均增加,提示它们参与结肠炎炎症反应过程。同时TNF-α水平升高,IL-10水平下降,据此可推断可能通过促进促炎因子TNF-α的合成、正反馈调节及抑炎因子IL-10水平下降,细胞因子网络平衡破坏,局部免疫调节紊乱,致使肠黏膜损伤和炎症。
双歧杆菌是人肠道正常菌群中占优势的益生菌,被机体摄入后可激活宿主的免疫系统,通过免疫排斥、免疫清除和免疫调节作用加强肠道防御的各条防线,发挥抗感染和抗肿瘤作用。以往的研究也表明,双歧杆菌、乳酸杆菌等益生菌制剂可有效调节机体免疫功能,防治某些胃肠道感染性疾病[14]。Bartosch 等[15]将来自于急性溃疡性结肠炎患者的活组织与长双歧杆菌共培养24 h,通过ELISA测定培养上清中TNF-α和IL-8发现,共培养上清比单独培养上清中两者含量明显降低。Lammers等[16]将来自于健康捐赠者的外周血单核细胞分别与纯化的双歧杆菌DNA和自愿者口服双歧杆菌前后粪便中总菌DNA共培养,发现双歧杆菌基因组DNA可诱导单核细胞分泌抗炎因子IL-10,益生菌处理后粪便标本中总菌DNA可通过降低IL-1β和增加IL-10调节免疫反应。炎症的特征之一是炎症细胞募集到炎症部位,通过阻断有关趋化因子及其受体从而阻止炎症细胞募集到炎症部位是一种新的抗炎策略。本研究发现双歧杆菌干预后,组织及其血清CCL20及其受体CCR6、TNF-α活性表达均显著降低,提示双歧杆菌能抑制CCL20及其受体CCR6,降低趋化,从而抑制TNF-α,促进IL-10表达,减轻炎症细胞浸润和结肠黏膜的损伤。与双歧杆菌治疗组比较,CMDI、TDI评分、结肠组织中和血清中 CCL20、CCR6及TNF-α在双歧杆菌预防性应用组表达水平降低,而血清IL-10水平升高,但两者差异无显著性,提示双歧杆菌提前应用对结肠的保护作用可能优于治疗组,对实验性结肠炎存在一定的预防作用。
总之,此次实验中经双歧杆菌治疗后,肠黏膜炎症减轻,较模型组DAI、CMDI和TDI明显降低,同时肠黏膜内CCL20及其受体CCR6表达较模型组亦明显降低,血清TNF-α、CCL20及其受体CCR6水平均降低,而血清IL-10水平升高。双歧杆菌能明显减少TNBS大鼠模型的急症反应,可能是抑制CCL20及其受体CCR6的表达,提高IL-10水平,降低TNF-α水平,使促炎因子与抗炎因子处于平衡状态,达到调节肠道局部免疫反应。
[1]Strober W,Fuss IJ,Blumberg RS.The immunology of mucosal models of inflammation[J].Annu Rev Immunol,2002,20(4):495-549.
[2]Banks C,Bateman A,Payne R,et al.Chemokine expression in IBD.Mucosal chemokine expression is unselectively increased in both ulcerative colitis and Crohn’s disease[J].J Pathol,2003,199(1):28-35.
[3]Izadpanah A,Dwinell MB,Eckmann L,et al.Regulated MIP-3alpha/CCL20 production by human intestinal epithelium:mechanism for modulating mucosal immunity[J].Am J Physiol Gastrointest Liver Physiol,2001,1280(4):G710-719.
[4]Jin Y,Fuller L,Ciancio G,et al.Antigen presentation and immune regulatory capacity of immature and mature-enriched antigen presenting(dendritic)cells derived from human bone marrow [J].Hum Immunol,2004,65(2):93-103.
[5]Zhong WE,Zhou GX,Ding XL,et al.Expression of chemokine MIP-3αand its receptor CCR6 in ulcerative colitis and its significance[J].Academic Journal of Second Military Medical University,2008,29(10):1180-1183.钟万锷,周国雄,丁晓凌,等.趋化因子MIP-3α及其受体CCR6在溃疡性结肠炎中的表达及其意义[J].第二军医大学学报,2008,29(10):1180-1183.
[6]Zhu F,Qian JM,Pan GZ.The establishment of TNBS-induced experimental colitis[J].Acta Academiae Medicinae Sinicae,1998,20(4):271-278.朱峰,钱家鸣,潘国宗.细胞免疫反应性炎症性肠病动物模型的建立[J].中国医学科学院学报,1998,20(4):271-278.
[7]Ma HL,Wang HP,Wang L,et al.The effects ofBifidobacteriumon the secretion of IL-10and IL-12by dendritic cells from children with allergic asthma [J].Chinese Journal of Microecology,2009,21(5):407-414.马红玲,王和平,王莉,等.双歧杆菌对过敏性哮喘儿童树突状细胞分泌IL-10、IL-12等细胞因子的影响[J].中国微生态学杂志,2009,21(5):407-414.
[8]Bai AP,Ouyang Q,Hu RW.The research on bifidobacterium inhibits inflammatory response in murine experimental colitis[J].Chin J Dig,2005,25(6):344-347.白爱平,欧阳钦,胡仁伟.双歧杆菌抑制小鼠实验性结肠炎肠道炎症反应的研究[J].中华消化杂志,2005,25(6):344-347
[9]Luk HH,Ko JK,Fung HS,et al.Delineation of the protective action of zinc sulfate on ulcerative colitis in rats [J].Eur J Pharmacol,2002,443(1-3):197-204.
[10]Fedorak RN,Empey LR,MacArthur C,et al.Misoprostol provides a colonic mucosal protective effect during acetic acid-induced colitis in rats[J].Gastroenterology,1990,98(3):615-625.
[11]Malhotra V,Eave-Pyles T,Odoms K,et al.Heat shock inhibits activation of NF-kappa B in the absence of heat shock factor-1 [J].Biochem Biophys Res Commun,2002,291(3):453-457.
[12]Claesson MH,Nicoletti F,Stosic-Grujicic S,et al.Interactions between infections and immune-inflammatory cells in type 1 diabetes mellitus and inflammatory bowel diseases:evidences from animal models[J].Clin Exp Rheumatol,2008,26(1 Suppl 48):S8-S11.
[13]Papadakis KA,Targan SR.Role of cytokines in the pathogenesis of in flammatory bowel disease[J].Annu Rev Med,2000,51:289-298.
[14]Hooper LV,GordonJL.Commensal hos-tbacterial relationships in the gut[J].Science,2001,292(5519):1115-1118.
[15]Bartosch S,Woodmansey EJ,Paterson JC,et al.Microbiological effects of consuming a synbiotic containing Bifidobacterium bifidum,Bifidobacterium lactis,and oligofructose in elderly persons,determined by real-time polymerase chain reaction and counting of viable bacteria[J].Clin Infect Dis,2005,40(1):28-37.
[16]Lammers KM,Brigidi P,Vitali B,et al.Immunomodulatory effects of probiotic bacteria DNA:IL-1 and IL-10 response in human peripheral blood mononuclear cells[J].FEMS Immunol Med Microbiol,2003,38(2):165-172.

